Cell分享:通過模擬pre-TCR添加pTα-1A獲得超級CAR-T細胞以攻克實體瘤
文章來源公眾號:生物世界 作者:生物世界
目前的 CAR-T 細胞療法,在多種血液類癌癥以及自身免疫疾病中展現了強大的治療效果,然而,對于占據癌癥絕大多數的實體瘤,其療效一直未能獲得實質性突破。
2025 年 12 月 2 日,CAR-T 細胞療法先驅 Michel Sadelain 教授(Shi Yuzhe 為論文第一作者)在國際大獎學術期刊 Cell 上發表了題為:pTα enhances mRNA translation and potentiates CAR T cells for solid tumor eradication 的研究論文。
該研究通過模擬 T 細胞天然發育中的強大增殖信號——pre-TCR,將其關鍵結構域 pTα-1A 整合到 CAR 結構中,在抗原刺激下通過持續激活 YBX1 以增強 mRNA 翻譯,讓 CAR-T 細胞具有更強的增殖能力、細胞因子產生能力和持久性,并伴有更低的耗竭,以及在多種血液類癌癥和實體腫瘤模型中更長期的抗腫瘤能力。
這項研究為開發下一代更強大、更持久的的 CAR-T 細胞療法提供了全新的思路,也為攻克實體瘤帶來了新的希望。


Michel Sadelain 教授在 CAR-T 細胞療法中取得了多項開創性突破,包括首次將 CD28 共刺激域引入 CAR 結構設計出第二代 CAR、證實了 CD19 可作為有效靶點等。近幾年獲得了包括科學突破獎、蓋爾德納獎、引文桂冠獎等科學大獎,被認為是諾貝爾獎的熱門候選人。
CAR-T的“阿喀琉斯之踵”:實體瘤與細胞耗竭
CAR-T 細胞療法在血液腫瘤中取得了革命性成功。然而,面對占癌癥 90% 以上的實體瘤時,CAR-T 細胞卻常常顯得力不從心。究其根源,主要有兩大難題:一是實體瘤的腫瘤微環境的抑制作用;二是 CAR-T 細胞在持續對抗腫瘤后,容易進入“耗竭”狀態,就像士兵連續作戰后疲憊不堪,失去戰斗力。
科學家們一直在尋找讓 CAR-T 細胞“續航”更久、戰斗力更強的方法。而這項新研究的靈感,竟然來源于我們每個人體內都曾發生過的過程——T 細胞在胸腺中的發育。
靈感來源:胸腺中的“增殖風暴”
在我們體內,T 細胞誕生于胸腺。在發育過程中,會經歷一個名為“β-選擇”的關鍵節點。此時,未成熟的 T 細胞會表達一種名為“前 T 細胞受體”(pre-TCR)的蛋白。這個受體的激活會觸發一場劇烈的“增殖風暴”,使得胸腺細胞在短時間內擴增上百倍,為后續篩選出多樣化的 T 細胞大軍奠定基礎。
這項研究的核心思路就是:能否將胸腺細胞這種強大的增殖能力,“借給” CAR-T 細胞,讓它也變得更強?
神來之筆:給 CAR-T 裝上“增殖引擎”
研究團隊將目光聚焦于 pre-TCR 的一個獨特組成部分——pTα 鏈。他們嘗試將 pTα 鏈細胞內部分的一個關鍵區域——“1A 結構域”,整合到經典的 CD28-CAR(稱為 19-28z)中。
經過多種構型的測試,他們最終找到了最優設計:將 1A 結構域插入到 CAR 的 CD28 和 CD3ζ 信號域之間,這個新型 CAR 結構被命名為——19-28z-1A。
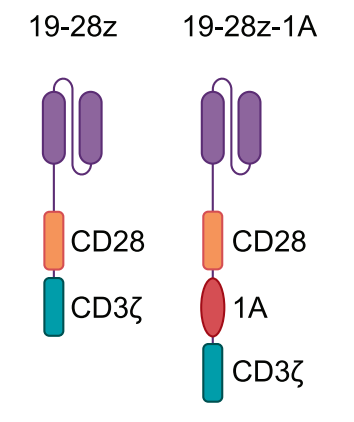
效果驚人:新型 CAR-T 細胞表現超群
在體外反復用腫瘤細胞刺激時,19-28z-1A CAR-T 細胞展現出更強大的擴增能力和細胞因子(例如干擾素-γ、腫瘤壞死因子等)分泌水平。更重要的是,這種優勢隨著刺激次數的增加而愈發明顯。
在白血病小鼠模型中,19-28z-1A CAR-T 細胞能更有效地清除腫瘤,小鼠存活率顯著提高。分析發現,這些細胞在體內存活更久,數量更多,并且表達更少的耗竭標志物(例如 PD-1、LAG-3 等),意味著它們能更好地保持“年輕態”的戰斗力。
那么,這個小小的 1A 結構域,是如何發揮如此巨大作用的呢?
機制揭秘:掌控蛋白質合成的“總開關”
通過磷酸化蛋白質組學分析,研究團隊發現了一個關鍵蛋白——YBX1。YBX1 被稱為 mRNA 翻譯的“主調控因子”,它就像工廠的“生產調度員”,決定哪些 mRNA 可以被翻譯成蛋白質。
研究團隊發現,在抗原刺激后,19-28z-1A CAR-T 細胞能夠比傳統 CAR-T 細胞更持久地維持 YBX1 蛋白的磷酸化(激活狀態)。這種持續激活的 YBX1,進而推動了一整套蛋白質翻譯合成機器的高效運轉,還促進了 IL-2、IFN-γ 等重要殺傷性細胞因子的翻譯合成。
當研究團隊敲除 YBX1 基因后,1A 結構域所帶來的所有優勢都消失了,CAR-T 細胞擴增受損,更快走向耗竭。這直接證明了 YBX1 是 1A 結構域發揮作用不可或缺的關鍵因素。
從血液瘤到實體瘤:廣譜抗癌潛力初現
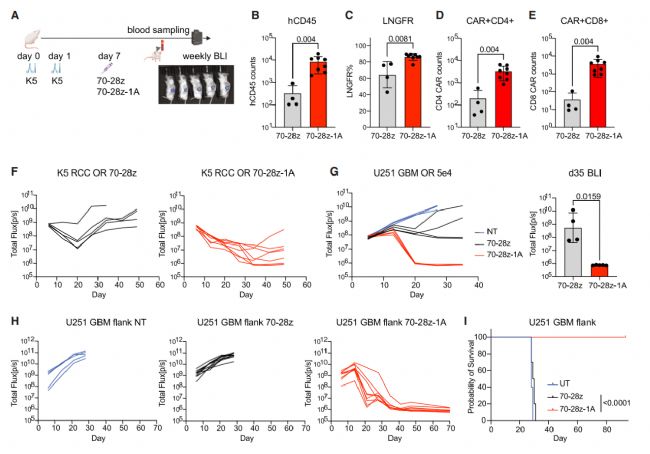
最后,研究團隊將靶點從 CD19(血液類癌癥靶點)換成了 CD70(腎細胞癌、膠質母細胞瘤等實體瘤靶點),構建了 70-28z-1A CAR-T 細胞。
結果令人振奮:在腎細胞癌原位模型中,70-28z-1A CAR-T 細胞在體內增殖更多,能有效控制腫瘤生長。在惡性程度極高的膠質母細胞瘤(GBM)模型中,無論是顱內原位腫瘤還是皮下腫瘤,70-28z-1A CAR-T 細胞都展現了強大的清除腫瘤的能力,而傳統 CAR-T 細胞幾乎無效。
強強聯合:1A 與現有技術擦出更強火花
研究團隊還將 1A 結構域與另一種先進的 CAR 設計——“1XX CAR”相結合。1XX 通過減少信號強度來降低細胞耗竭。而 1A 通過增強翻譯來提升細胞功能,兩者機制不同。結果顯示,1XX-1A 這種“強強聯合”的 CAR 結構,表現出了當前最強的抗腫瘤效果,為未來的臨床開發提供了更優的選擇。
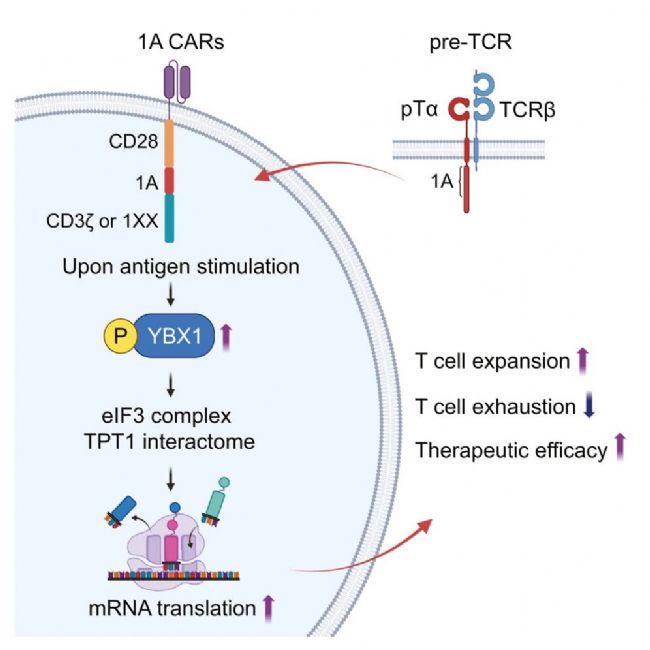
這項研究的意義重大,它開辟了 CAR-T 細胞療法優化的一個新維度:通過調控 mRNA 翻譯來重編程細胞狀態。
創新性:不同于以往專注于調控轉錄因子或表觀遺傳,該研究另辟蹊徑,從胸腺發育中汲取靈感,通過增強蛋白質合成這一基礎生命活動來根本性地提升 T 細胞功能。
有效性:在多種臨床前模型中證實了其對血液瘤,尤其是實體瘤的顯著增強效果。
安全性:初步研究顯示,1A CAR-T 細胞的激活仍依賴于抗原,在無腫瘤小鼠體內會正常清除,未發現自主增殖等安全隱患,具有良好的轉化前景。






