T細胞作為免疫功能調控核心密碼的代謝重編程機制及核心途徑
T細胞作為適應性免疫系統的核心組成部分,其功能激活、增殖分化及效應發揮均依賴精密的代謝調控。代謝重編程作為T細胞適應生理或病理狀態的關鍵機制,指細胞根據功能需求與環境變化,動態調整代謝途徑以滿足能量供應和生物大分子合成需求,這一過程貫穿T細胞活化至效應執行的全周期,是調控免疫應答強度與方向的核心樞紐。
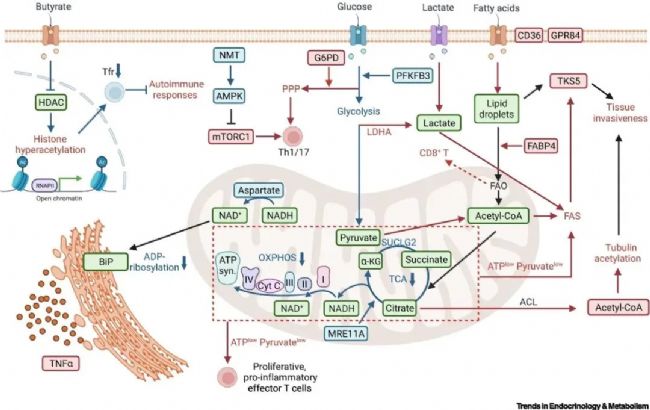
一、 T細胞激活與代謝重編程的啟動
靜止狀態下的T細胞處于低代謝水平,主要通過氧化磷酸化(OXPHOS)產生少量ATP,維持基本生命活動。當T細胞通過TCR受體識別抗原呈遞細胞呈遞的抗原肽-MHC復合物后,激活信號快速傳導至細胞內,引發能量和物質需求的急劇上升——為支持細胞增殖、效應分子合成及功能分化,T細胞必須啟動代謝重編程,從靜止期的"節能代謝模式"切換為活化期的"高效合成代謝模式"。這一轉換過程由PI3K-Akt-mTOR、AMPK等多條信號通路協同調控,確保代謝調整與功能需求精準匹配。
二、 T細胞代謝重編程的核心途徑
(一)糖代謝重編程:有氧糖酵解的核心作用
激活后的T細胞糖代謝發生顯著重塑,最關鍵的特征是有氧糖酵解的強勢激活——即使在氧氣充足的條件下,T細胞也優先將葡萄糖轉化為乳酸,同時糖酵解速率大幅提升。這一過程并非簡單的能量供應方式改變,而是通過快速產生ATP滿足即時能量需求,同時生成葡萄糖-6-磷酸、丙酮酸等中間產物,為核酸、蛋白質等生物大分子合成提供前體。其中,葡萄糖-6-磷酸脫氫酶(G6PD)介導的磷酸戊糖途徑(PPP)尤為關鍵,可生成NADPH和核苷酸合成原料,支撐T細胞的快速增殖。此外,部分活化T細胞也會同步增強線粒體氧化代謝活性,形成"糖酵解為主、氧化代謝為輔"的雙重供能模式,保障持續的功能執行。
(二)氨基酸代謝重編程:氮源供應與信號調控的雙重支撐
氨基酸代謝是T細胞代謝重編程的重要環節,為細胞提供關鍵的氮源和碳源。谷氨酰胺作為核心營養物質,被激活的T細胞大量攝取后,經谷氨酰胺酶催化轉化為谷氨酸,進而參與三羧酸循環(TCA)、蛋白質合成等多條代謝途徑,是維持T細胞增殖和效應功能的必需物質。同時,精氨酸等氨基酸的攝取量顯著增加,不僅參與蛋白質合成,更通過調控mTORC1等信號通路,進一步放大代謝重編程效應,形成"氨基酸供應-信號激活-代謝增強"的正反饋循環。
(三)脂代謝重編程:結構合成與信號調控的雙重功能
脂代謝的動態調整直接影響T細胞的功能狀態。激活后的T細胞通過上調CD36等脂質轉運蛋白,增加脂肪酸的攝取,同時激活脂肪酸合成酶(FAS)、乙酰輔酶A羧化酶(ACC)等關鍵酶類,增強內源性脂肪酸合成。這些脂質既可以通過β-氧化進入線粒體產生ATP,為長期免疫應答提供能量;也可用于合成細胞膜磷脂等結構成分,支撐T細胞的快速增殖與形態重塑。此外,脂質代謝產物還可作為信號分子,調控T細胞分化方向,例如促進Th1/Th17等效應T細胞亞群的形成,影響免疫應答的類型。
三、 代謝重編程與T細胞功能的精準調控
T細胞的代謝表型與功能狀態高度關聯,形成"代謝-功能"的雙向調控網絡。糖代謝活躍的T細胞通常傾向于分化為增殖能力強、炎癥因子分泌旺盛的效應T細胞(如CD8+細胞毒性T細胞、Th1/Th17細胞),其有氧糖酵解產生的乳酸等代謝產物還可通過調節腫瘤微環境等方式,增強免疫殺傷效率;而依賴脂肪酸氧化(FAO)的T細胞則更易形成記憶T細胞,通過維持線粒體穩態和代謝可塑性,實現長期免疫記憶功能。 代謝重編程的異常調控還與疾病發生密切相關。若糖代謝過度激活可能導致T細胞功能亢進,引發自身免疫性疾病;而腫瘤微環境中T細胞的代謝受限(如葡萄糖匱乏、乳酸堆積)則會導致其功能耗竭,削弱抗腫瘤免疫應答。因此,靶向T細胞代謝重編程關鍵分子(如PFKFB3、LDHA、FAS等)調節代謝途徑,已成為免疫相關疾病治療的潛在方向。
四、T 細胞代謝重編程機制研究的核心蛋白指標
T 細胞代謝重編程涉及糖、氨基酸、脂類三大代謝途徑及信號與表觀調控,核心蛋白指標的表達或活性變化,直接反映其代謝模式切換與功能狀態,具體關鍵蛋白如下:
| 代謝類別 | 核心蛋白 | 功能描述 |
| 糖代謝相關 | PFKFB3 | T 細胞激活后上調,催化生成果糖 - 2,6 - 二磷酸以激活糖酵解,推動有氧糖酵解速率提升,關聯效應 T 細胞增殖與炎癥因子分泌。 |
| LDHA | 有氧糖酵解標志蛋白,將丙酮酸轉化為乳酸以維持糖酵解運轉,乳酸積累可調控腫瘤微環境中 T 細胞功能。 | |
| G6PD | 磷酸戊糖途徑限速酶,生成 NADPH 與核苷酸合成前體,為 T 細胞增殖提供核酸原料,連接糖代謝與生物大分子合成。 | |
| SUCLG2 | 參與三羧酸循環,功能異常致琥珀酸堆積,影響線粒體呼吸鏈效率,調控 T 細胞代謝可塑性(如效應與記憶 T 細胞分化切換)。 | |
| Cyt C | 線粒體呼吸鏈關鍵蛋白,反映線粒體功能完整性與 T 細胞能量供應穩定性,表達模式隨代謝模式切換調整。 | |
| 氨基酸代謝相關 | GLS(谷氨酰胺酶) | 催化谷氨酰胺分解為谷氨酸,激活后 T 細胞上調其表達以增強谷氨酰胺代謝,為三羧酸循環供碳源,維持氧化還原平衡,是效應 T 細胞功能必需蛋白。 |
| mTORC1 | 氨基酸充足時激活的信號蛋白,調控糖酵解(如上調 PFKFB3)、脂合成相關酶表達,促進 T 細胞向效應態分化,活性異常致代謝紊亂與功能失衡(如自身免疫反應、免疫耗竭)。 | |
| 脂代謝相關 | CD36 | 跨膜脂質轉運蛋白,激活后 T 細胞上調其表達以增加脂肪酸攝取,為 β- 氧化供能(如記憶 T 細胞穩態維持)或細胞膜磷脂合成(支撐增殖),與代謝表型(糖酵解型 vs 氧化代謝型)密切相關。 |
| FABP4 | 胞內脂質轉運蛋白,參與脂肪酸運輸利用,調控脂質信號分子生成,影響 T 細胞分化(如促進 Th17 細胞分化)與組織浸潤能力。 | |
| FAS | 脂肪酸合成限速酶,效應 T 細胞上調其表達以增強脂肪酸合成,用于細胞膜合成與脂滴儲存,活性受 mTORC1 調控,抑制后致 T 細胞增殖受阻、效應功能下降。 | |
| ACC | 催化乙酰 - CoA 轉化為丙二酰 - CoA(脂肪酸合成前體),影響脂肪酸合成速率,丙二酰 - CoA 抑制脂肪酸 β- 氧化,維持 “合成 vs 分解” 代謝平衡,調控代謝模式切換。 | |
| 信號與表觀調控相關 | AMPK | 能量感知蛋白,T 細胞能量匱乏時激活,抑制 mTORC1 與脂合成,促進脂肪酸 β- 氧化以維持代謝穩態,與 mTORC1 形成 “拮抗平衡”,共同調控代謝選擇與功能狀態。 |
| HDAC | 表觀調控蛋白,通過調節組蛋白乙酰化水平,調控糖酵解、脂代謝相關酶(如 LDHA、FAS)基因表達,影響代謝重編程,其抑制劑可重塑表觀遺傳狀態以調整 T 細胞代謝與免疫功能。 |
五、T細胞研究實驗服務
深入解析 T 細胞代謝重編程機制,離不開精準、高效的多維度檢測技術支撐。LabEx 作為覆蓋基因、蛋白、細胞及組織水平的一站式生物標志物發現平臺,憑借 30 + 成熟技術平臺(包括單細胞測序、空間多組學、流式檢測、蛋白芯片、多色免疫組化等)與年超 100 萬樣本的檢測經驗,可提供從代謝相關蛋白定量、信號通路分析到空間代謝表型解析的全流程服務。無論是糖代謝關鍵酶(如 PFKFB3、LDHA)、脂代謝調控蛋白(如 CD36、FAS)的精準檢測,還是 mTORC1、AMPK 等信號通路的多因子同步分析,LabEx 均能以標準化操作與專業數據分析,助力研究者快速挖掘代謝重編程核心機制、篩選關鍵標志物。依托務真嚴謹的服務理念與全面的技術覆蓋,LabEx 將為 T 細胞代謝重編程相關研究提供強有力的技術支持,加速基礎研究向臨床轉化的進程。
樂備實是國內專注于提供高質量蛋白檢測以及組學分析服務的實驗服務專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務技術平臺已擴展到單細胞測序、空間多組學、流式檢測、超敏電化學發光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學等30多個,建立起了一套涵蓋基因、蛋白、細胞以及組織水平實驗的完整檢測體系。






