通過后包封法在溫和條件下高效包封mRNA的現(xiàn)貨型LNP開發(fā)研究
mRNA 因其誘導(dǎo)目標(biāo)蛋白表達(dá)的能力,在個性化醫(yī)療和疫苗開發(fā)等領(lǐng)域展現(xiàn)出巨大的潛力。眾所周知,mRNA 是一個帶負(fù)電的生物大分子,無法自主穿透細(xì)胞膜,必須依賴遞送系統(tǒng)才能發(fā)揮作用。脂質(zhì)納米顆粒已被證明是遞送 mRNA 的理想載體,其制備主要依賴微流控乙醇稀釋法。該方法雖然高效,卻需要精確控制乙醇濃度、pH 梯度和混合速率等多種參數(shù),且必須在顆粒形成過程中同步加入 mRNA。一旦 mRNA 序列發(fā)生變更,整個工藝流程往往需要重新優(yōu)化,這一局限性嚴(yán)重阻礙了在個性化醫(yī)療場景中實(shí)現(xiàn)快速響應(yīng)的能力。
為了簡化 mRNA-LNPs 的制備過程,日本千葉大學(xué)聯(lián)合東北大學(xué)、大阪大學(xué)研究團(tuán)隊(duì)近日在 Nano Letters 發(fā)表了題為“A post encapsulation method for the preparation of mRNA-LNPs via the nucleic acid bridged fusion of mRNA free LNPs”的研究論文。該研究開發(fā)了一種新型現(xiàn)貨型 LNPs(LNPs (RtoU/Liq)),即通過后包封法(post-encapsulation method)將 mRNA 溶液與預(yù)先制備的空包的 LNPs(mRNA-free LNPs)混合,在溫和條件下即可實(shí)現(xiàn)高效包封。此方法操作簡單,無需復(fù)雜的設(shè)備。此外,與需要加熱的“凍干即用型 LNPs”相比,該方法避免了加熱對 mRNA 質(zhì)量的潛在影響,為 mRNA 藥物的開發(fā)提供高效且簡便的解決方案。
一、后包封法的流程
后包封法的核心步驟包括:
1、制備空包的 LNPs:利用微流體混合技術(shù)將脂質(zhì)溶液(乙醇中)與酸性緩沖液混合,形成空包的 LNPs。隨后,通過超濾技術(shù)將緩沖液替換成 2-(N-morpholino) 乙磺酸(MES)/蔗糖緩沖液,調(diào)整 pH 值至 6.0。
2、配置 mRNA 溶液:將合成的 mRNA 溶解在 MES/蔗糖緩沖液中,調(diào)整 pH 值至 6.0。
3、混合封裝:將 mRNA 溶液與空包的 LNPs 進(jìn)行快速渦旋混合,隨后在 37℃ 下孵育 5 分鐘,以促進(jìn) mRNA 的吸附和 LNPs 的融合。
4、中和完成:加入 PBS 中和 pH 值,完成封裝過程。
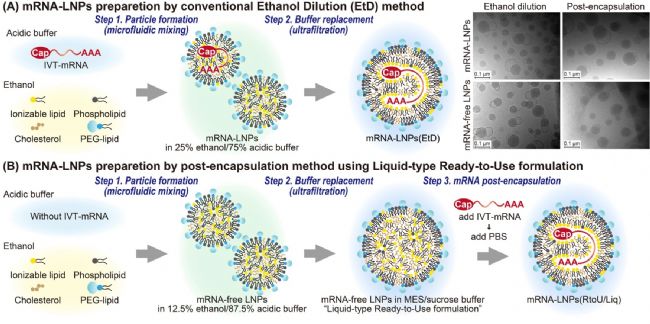
圖1. 兩種包封方法的示意圖
二、后包封法的優(yōu)化與評估
1、脂質(zhì)組成的優(yōu)化
LNP 的核心組分包括可電離脂質(zhì)、PEG 脂質(zhì)、磷脂和膽固醇。其中,可電離脂質(zhì)通過靜電作用與帶負(fù)電荷的核酸(如 mRNA)結(jié)合,直接影響 mRNA 包封率。研究團(tuán)隊(duì)篩選了三種可電離脂質(zhì)(DODAP、DLin-MC3-DMA 和 ssPalmO-Phe-P4C2),發(fā)現(xiàn)三種脂質(zhì)在 pH≤6.0 時均能實(shí)現(xiàn)超過 70% 的包封率(encapsulation efficiency)。
此外,磷脂分子具有親水頭部和疏水尾部,參與構(gòu)建 LNP 的穩(wěn)定結(jié)構(gòu),可與膽固醇協(xié)同提升核酸的包封率。而膽固醇在 LNP 中起到調(diào)節(jié)膜流動性、穩(wěn)定性和提高包封率的作用。實(shí)驗(yàn)發(fā)現(xiàn),當(dāng)膽固醇占比 20%-40% 且磷脂占比 7.5%-20% 時,包封率最高(圖 2)。
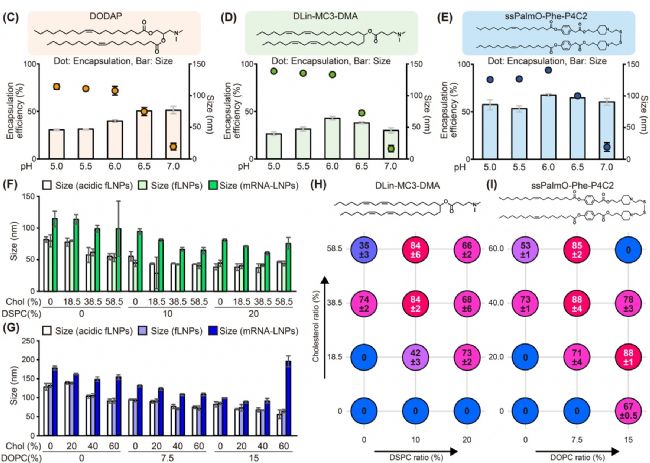
圖2. 脂質(zhì)組分對包封率的影響
2、mRNA 橋連介導(dǎo)的 LNPs 的融合機(jī)制
本研究發(fā)現(xiàn),后包封法(包封率超過 70%)會導(dǎo)致顆粒粒徑顯著增加至原尺寸的 1.27 到 1.78 倍(圖 2H, I)。這種增幅遠(yuǎn)超單純 mRNA 封裝所能解釋的范圍,提示存在 LNPs 間的粒子融合。
為了驗(yàn)證此機(jī)制,研究團(tuán)隊(duì)利用納米流式檢測儀(NanoFCM)在單顆粒水平對 mRNA-LNPs 的粒徑和 mRNA 裝載率(loading ratio)進(jìn)行分析。分別對傳統(tǒng)乙醇稀釋法(EtD)和后包封法(RtoU/Liq)制備的 mRNA-LNPs 進(jìn)行脂質(zhì)(DiD)和核酸(SYTO 9)雙重標(biāo)記,NanoFCM 結(jié)果顯示,后包封法的 mRNA 裝載率相比傳統(tǒng)方法提升約 16%(圖 3A-C)。此外,在后包封組中,包封后顆粒的粒徑顯著大于空包的 LNPs(圖 3D),表明在后包封法制備過程中,mRNA 的包封過程中同步發(fā)生了顆粒粒徑的增大。
為了進(jìn)一步驗(yàn)證 LNPs 之間的融合,研究團(tuán)隊(duì)使用了熒光共振能量轉(zhuǎn)移技術(shù)(fluorescence resonance energy transfer, FRET):將 DiA(熒光供體)與 DiD(熒光受體)共同標(biāo)記在空包 LNPs 的脂膜上,因二者距離非常接近,發(fā)生 FRET,導(dǎo)致 DiA 熒光變?nèi)醵?DiD 熒光增強(qiáng);隨后將雙標(biāo)記的空包 LNPs 與未標(biāo)記的 LNPs 以 1:9 的比例混合,加入 mRNA 后,mRNA 通過靜電作用介導(dǎo)“核酸橋連的 LNPs 融合”,原緊密相鄰的 DiA 與 DiD 被未標(biāo)記 LNPs 的脂質(zhì)分子分隔,F(xiàn)RET 顯著減弱,DiA 熒光恢復(fù)而 DiD 熒光減弱。結(jié)果顯示,pH 6.0 條件下 mRNA 可橋接相鄰 LNPs,高效觸發(fā)顆粒間的融合(圖 3E-G),從而同步提升包封率和顆粒粒徑。
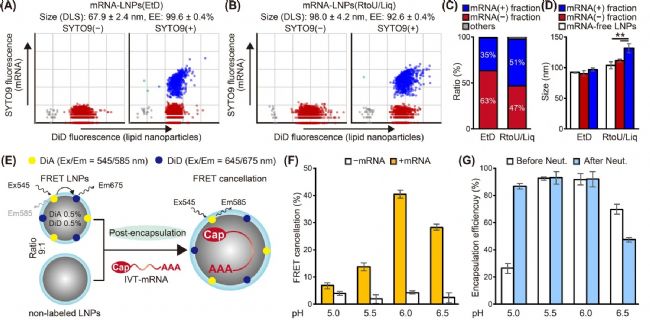
圖3. mRNA 橋連介導(dǎo)的 LNPs 融合驗(yàn)證
3、LNPs/mRNA 摩爾比優(yōu)化
接下來,在 pH 6.0 條件下考察 LNPs/mRNA 的摩爾比(L/R比)對后包封法包封率的影響。如圖 4 所示,當(dāng) L/R 比低于 50 時,包封率顯著下降;增加 mRNA 相對含量(即降低 L/R 比)會增強(qiáng) FRET 消除效應(yīng)并增大顆粒尺寸。進(jìn)一步通過電泳分析 mRNA 狀態(tài),發(fā)現(xiàn)在 L/R 比為 100 的情況下,mRNA 包封率高達(dá) 81%,僅有 11% 的核酸被檢測為游離 mRNA;而在 L/R 比為 25 的樣品中,包封率降至 0%,62% 的核酸被檢測為游離狀態(tài),剩余的 38% 在表面活性劑溶解顆粒后被釋放。這一結(jié)果表明在低 L/R 比條件下,大部分未包封的 mRNA 以游離形式存在,另有部分 mRNA 可能僅吸附在 LNPs 脂質(zhì)復(fù)合物表面而未被有效包裹。充分說明合適的 L/R 比對于 mRNA 高效吸附于 LNPs 表面并實(shí)現(xiàn)穩(wěn)定封裝至關(guān)重要。
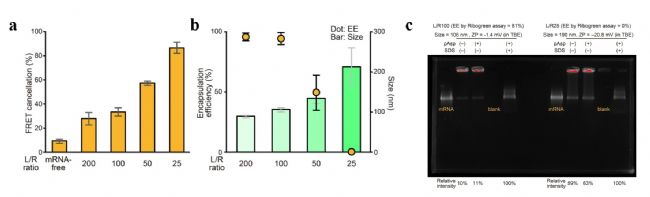
圖4. L/R 比對包封率的影響
4、混合條件的優(yōu)化
混合條件對包封率也有顯著影響。研究中比較了快速混合(渦旋混合)和慢速混合(輕柔移液)兩種方法。結(jié)果表明,快速混合能夠提高包封率,尤其是在高 L/R 比下。這是因?yàn)榭焖倩旌媳苊?nbsp;mRNA 在 LNPs 表面的局部過載,從而避免 LNPs 表面過度吸附 mRNA,導(dǎo)致融合過程受阻。相反,慢速混合會導(dǎo)致 mRNA 局部濃度過高,阻礙顆粒融合進(jìn)程。
綜上所述,后包封法的效率由 pH 值、脂質(zhì)組成、L/R 比及混合動力學(xué)協(xié)同調(diào)控。通過優(yōu)化這些參數(shù),可實(shí)現(xiàn) mRNA 的高效包封,為開發(fā)高效、簡便的 mRNA-LNPs 制備工藝提供了重要技術(shù)參數(shù)。
三、現(xiàn)貨型 LNPs 的 mRNA 遞送效率
接著研究團(tuán)隊(duì)對現(xiàn)貨型 LNPs 遞送 mRNA 的效率進(jìn)行評估。研究團(tuán)隊(duì)分別采用經(jīng)典乙醇法和后包封法制備了包封編碼熒光素酶基因的 mRNA-LNPs,分別注射至小鼠體內(nèi),活體成像顯示,兩種類型的 mRNA-LNPs 在肝臟中均實(shí)現(xiàn)了超過 98% 的選擇性基因表達(dá)(圖 5B, C),這表明現(xiàn)貨型 LNPs 在體內(nèi)遞送 mRNA 方面與傳統(tǒng)方法效果高度一致。
此外,利用后包封法制備包封雞卵清蛋白和新冠病毒刺突蛋白 mRNA 的 LNPs,經(jīng)小鼠肌肉多次注射,誘導(dǎo)出強(qiáng)效且持久的 IgG 抗體應(yīng)答(圖 5E)。表明現(xiàn)貨型 LNPs 可應(yīng)用于 mRNA 疫苗的快速開發(fā)。
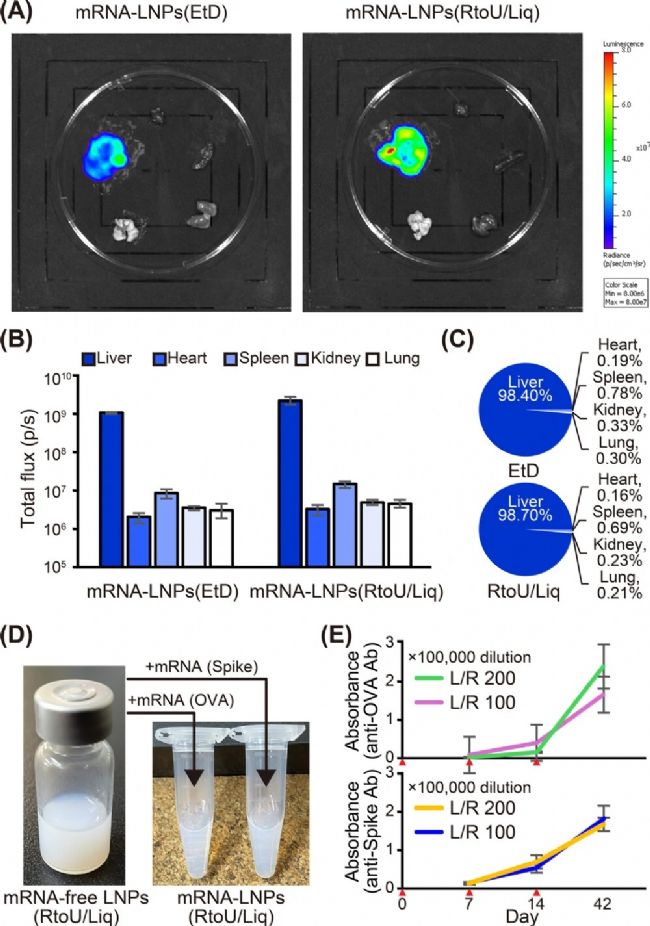
圖5. 現(xiàn)貨型 LNPs 的 mRNA 遞送效率評估
總結(jié)與展望
本研究開發(fā)了一種基于現(xiàn)貨型 LNPs 的 mRNA 包封新策略,通過核酸橋接融合的方式將 mRNA 高效封裝到預(yù)先準(zhǔn)備好的 LNPs 中,實(shí)現(xiàn)一步反應(yīng)制備高質(zhì)量的 mRNA-LNPs。此外,體內(nèi)外實(shí)驗(yàn)證實(shí),后包封法的基因遞送效率與經(jīng)典的乙醇稀釋法相當(dāng)。該方法操作簡單,無需復(fù)雜的設(shè)備,且省去了傳統(tǒng)凍干工藝的加熱環(huán)節(jié),保障了 mRNA 的質(zhì)量。因此,后包封法為 mRNA 藥物的開發(fā)提供了一種高效、簡便的解決方案,具有廣泛的應(yīng)用前景,有助于加速 mRNA 治療和疫苗開發(fā)。
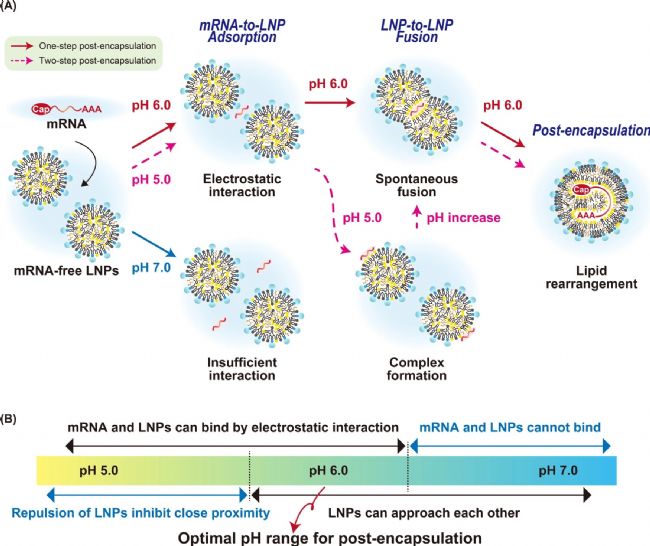
圖6. 后包封法工藝流程圖
NanoFCM 憑借其超高的靈敏度和完善的解決方案,可在單顆粒水平對 mRNA-LNPs 的粒徑分布和封裝率進(jìn)行評估。通過熒光標(biāo)記,NanoFCM 能夠精準(zhǔn)區(qū)分裝載 mRNA 的和空包的 LNPs 顆粒,從而精確計(jì)算封裝率。同時,基于單顆粒的散射光強(qiáng)度分析粒徑,發(fā)現(xiàn)成功包封 mRNA 后顆粒粒徑顯著增大,揭示 mRNA 封裝與粒徑增大緊密相關(guān),為核酸橋接融合機(jī)制提供直接的證據(jù),進(jìn)一步驗(yàn)證了后包封法的高效性和可靠性,為優(yōu)化封裝條件提供了關(guān)鍵依據(jù)。
- ApogeeFlow成美國科研團(tuán)隊(duì)開發(fā)新工具,助力耐藥菌VREfm可視化研究
- 流式細(xì)胞術(shù)數(shù)據(jù)處理軟件的核心功能、技術(shù)演進(jìn)與選型考量因素
- Luminex多因子檢測技術(shù)的原理、特性與前沿應(yīng)用綜述
- NanoFCM技術(shù)在超級細(xì)菌MRSA感染新型診斷方法研究中的應(yīng)用
- Moxi GO II 快速流式細(xì)胞儀為單細(xì)胞測序的樣本質(zhì)控建立新標(biāo)準(zhǔn)
- 血漿p-tau217/BD-tau比值可降低生物標(biāo)志物的短期波動性
- 通過后包封法在溫和條件下高效包封mRNA的現(xiàn)貨型LNP開發(fā)研究
- 國產(chǎn)流式新突破!達(dá)科為CytoPeak流式細(xì)胞儀發(fā)布
- 2026第二十屆(上海)細(xì)胞產(chǎn)業(yè)大會通知
- 福流生物邀您參加2025CSEV第九屆全國細(xì)胞外囊泡大會
- 2025年西安站細(xì)胞外囊泡應(yīng)用與轉(zhuǎn)化技術(shù)研討會通知
- 首站西安:貝克曼庫爾特光譜流式系列城市會即將啟航
- 直播預(yù)告:DNA工程化細(xì)胞外囊泡生物材料設(shè)計(jì)及應(yīng)用
- 多色流式免疫細(xì)胞精細(xì)分型臨床檢測及應(yīng)用培訓(xùn)班邀請
- 貝克曼庫爾特8月份活動預(yù)告(16日上海/24日北京)