非層狀液晶脂質納米顆粒與細胞外囊泡雜交實現核酸分子高效裝載的研究
近年來,mRNA 疫苗和 siRNA 藥物等 RNA 療法發展迅猛,取得了顯著的臨床進展,如 COVID-19 疫苗、Onpattro 和 Spinraza 等突破性藥物的獲批上市。然而,核酸藥物在體內的高效遞送仍是關鍵挑戰。常用的脂質納米顆粒(lipid nanoparticles, LNPs)載體雖然具備易于生產和載藥量高等優勢,但仍受限于靶向性不足和免疫原性等問題。
細胞外囊泡(extracellular vesicles, EVs)作為一種天然存在的細胞分泌囊泡,具備低免疫原性、良好的生物相容性和潛在的靶向性,被認為是理想的藥物遞送載體。有證據表明:相比于 LNPs,EVs 可以更安全和高效地遞送核酸。然而,如何將治療性核酸藥物有效裝載到 EVs 內部仍然是一個不小的挑戰。通過對生產 EVs 的細胞系進行基因工程改造來裝載蛋白質或核酸是一種廣泛應用的方法,然而該方法在面對臨床患者來源的 EVs 時適用性有限,且難以用于裝載經化學修飾的核酸。另一方面,在 EVs 分離后進行載藥的方法,如電穿孔和超聲處理等,則可能對其結構和功能造成負面影響。
為了應對這些挑戰,瑞士蘇黎世聯邦理工學院的研究團隊在 Advanced Science 發表了題為“Loading of Extracellular Vesicles with Nucleic Acids via Hybridization with Non-Lamellar Liquid Crystalline Lipid Nanoparticles”的研究論文。本研究提出了使用非層狀液晶脂質納米顆粒(non-lamellar liquid crystalline lipid nanoparticles, LCNPs)與 EVs 自發雜交形成雜交細胞外囊泡(HEVs)的新策略,實現包括 siRNA、mRNA 和核酸適配體在內的多種核酸分子的高效裝載,同時保持 EVs 的生物學功能。這一雜交體系的體外裝載效率遠高于它的“前輩”——LCNPs,有望進一步拓展至更廣泛的細胞來源甚至實現產業化。
一、LCNPs 的制備與表征
研究人員采用可電離脂質 DLin-MC3-DMA(MC3)、輔助脂質 DOPE 和非離子表面活性劑 HS15 制備了非層狀液晶脂質納米顆粒(LCNPs)。通過小角 X 射線散射 (small-angle X-ray scattering, SAXS) 和冷凍透射電鏡分析 LCNPs 的結構特性,發現 LCNPs 在 pH 5 時呈現反六角相(HII 相),而在 pH 7.4 時轉變為更無序的非層狀相(可能是反向膠束 L2 或海綿相 L3),表明 LCNPs 具有 pH 依賴性的結構轉變行為(圖 1)。
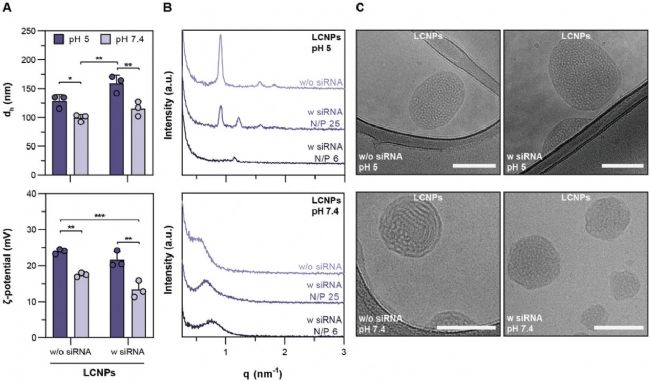
圖1. LCNPs 的理化特征
二、HEVs 的形成與表征
研究人員從 3D 培養的間充質干細胞(MSCs)中分離 EVs,并依照 ISEV 指南建議的多種技術手段表征 EVs 的質量。隨后,深入研究了 EVs 與 LCNPs 雜交形成 HEVs 的動力學。靜態光散射(SLS)和動態光散射(DLS)的結果顯示,EVs 與 LCNPs 混合后,顆粒濃度呈指數衰減,并在 30 min 后趨于穩定。同時,粒徑在 30 min 內從 160 nm 增大至 190 nm 并趨于穩定,表明雜交過程迅速進行。冷凍透射電鏡(cryo-TEM)直觀地觀察了雜交的過程,如圖 2 所示,混合后 5 分鐘內,半融合的 HEVs 已然出現;4 小時之后,幾乎全部形成了完全融合的 HEVs,且 EV 膜蛋白依然分布于顆粒表面。此外,研究者還探究了溫度和 pH 對雜交動力學的影響。結果表明,在 37℃ 時,雜交過程更為迅速;而在 4℃ 時,動力學顯著減緩。在酸性條件下(pH ≤ 6)EVs 與 LCNPs 之間的相互作用更為強烈,導致粒徑急劇增大,可能促使大聚集體的形成。
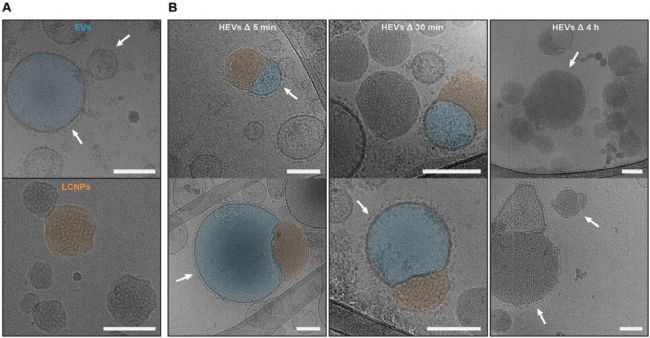
圖2. cryo-TEM 成像觀察 HEVs 的形成
進一步地,采用納米流式檢測技術(NanoFCM)在單顆粒水平上探究脂質納米載體的拓撲結構如何影響其與 EV 的相互作用。研究人員選取三種不同類型的脂質納米載體(LCNPs、DOPC-NPs 和 DOTMA-NPs),分別裝載了熒光標記的小核酸(FAM-siRNA),并與 CellTrace Red 標記的 EVs 以 1:1 比例混合。NanoFCM 的結果顯示,不同類型的 NPs 與 EVs 混合后,均形成了不同比例的雙陽性亞群,證實 HEVs 的形成(圖 3A 中以青綠色方框突出顯示)。進一步分析雙陽性顆粒計數相對于 CellTrace 群體的比例,發現在酸性條件下,與高度正電荷的納米顆粒(如 LCNPs 或 DOTMA-NPs)形成的 HEVs,分別達到了 57% 和 53% 的最高共定位率。而在 pH 7.4 下,LCNPs 與 EVs 的相互作用效率降至 40%;相比之下,DOPC-NPs 與 EVs 的相互作用效率最低,僅為 12%(圖 3B)。這表明 NPs 的表面電荷、脂質組成以及拓撲結構對其與 EVs 的相互作用均有顯著影響。此外,研究人員通過不同類型的核酸載物(mRNA 和核酸適配體)來評估 HEVs 的形成,進一步驗證 HEVs 平臺裝載多種類型的核酸分子的有效性和普適性。
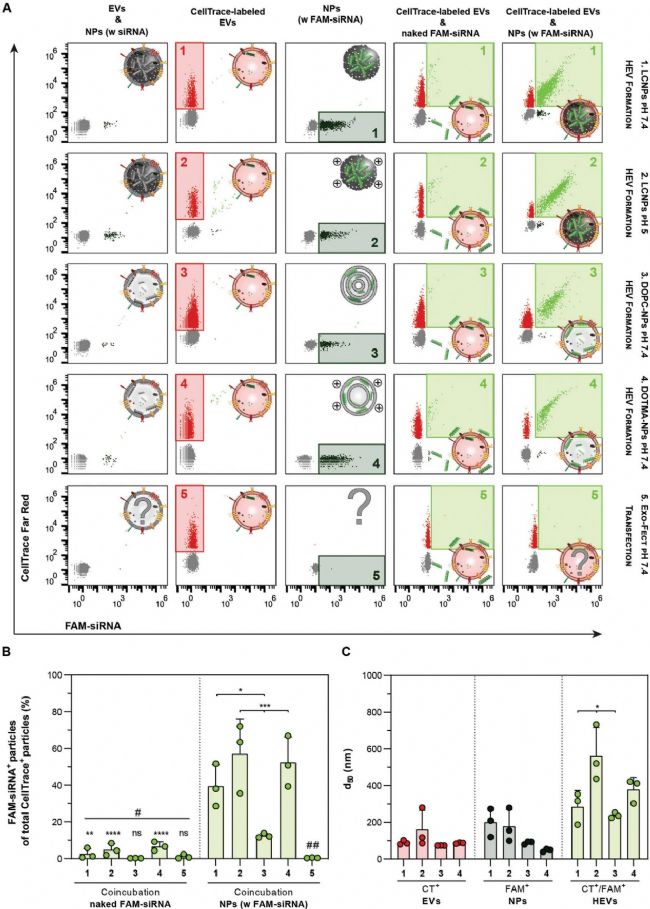
圖3. NanoFCM 分析不同條件下 HEVs 的形成
三、HEVs 的生物學特性
為了探究 EVs 膜蛋白是否存在于 HEVs 表面以及 LCNPs 是否傾向于與特定的 EVs 亞群相互作用,研究人員利用光流體平臺的免疫親和捕獲和熒光顯微技術進行評估。
研究人員選擇了多種 EV 和 MSC 特征膜蛋白的抗體作為捕獲探針,結果顯示,EVs 和 HEVs 的膜蛋白表達譜沒有顯著差異,且呈現 CD26 >> CD73 > CD9 > CD63 > IgG 的相對趨勢(圖 4C)。此外,不同膜蛋白與核酸的共定位比例均在 30%~40% 之間,這個結果與 NanoFCM 的結果互相印證(圖 4D)。這表明 LCNPs 與 EVs 的雜交過程是非特異性的,不偏好任何特定的 EV 亞群。
進一步地,對膜蛋白的生物活性及核酸載物的完整性進行了驗證。酶活性實驗沒有發現 HEVs 的 CD73 和 CD26 酶活性與天然 EVs 有顯著差異(圖 4E, F)。此外,HEVs 的結構能夠保護核酸載物免受降解。
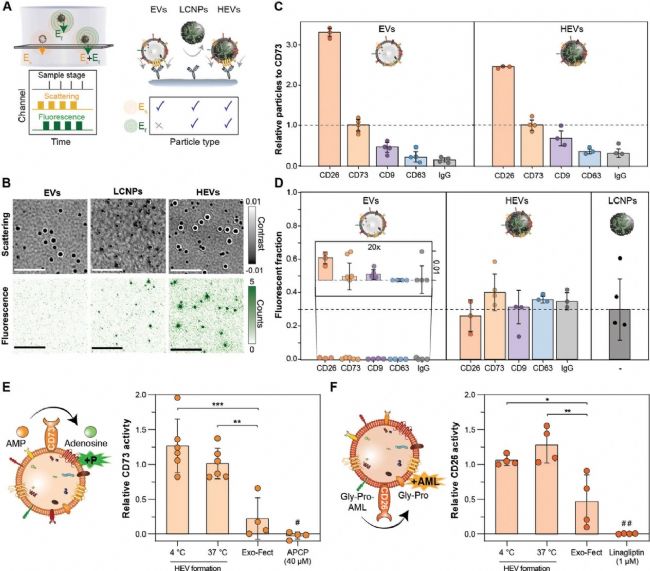
圖4. HEVs 生物學特性的綜合表征
四、HEVs 的基因遞送功能
研究人員以 HeLa 細胞作為模型,構建了穩定表達綠色熒光蛋白(GFP)或熒光素酶(FLuc)的細胞株,進一步通過轉染 siRNA 或 mRNA 的質粒以評估 HEVs 和 LCNPs 的基因沉默和基因表達效率。
1)在基因沉默實驗中,裝載 siGFP 的 HEVs 于低血清條件下可使 GFP 熒光強度降低約 75%,其沉默效率與商業轉染試劑相當(圖 5A);即使在高血清條件下,經過 4 小時處理,裝載 siGFP 的 HEVs 仍能顯著降低 GFP 熒光強度約 15%(圖 5B)。
2)在基因表達實驗中,低血清條件下,裝載 mRNA 的 HEVs 即使在較低 mRNA 劑量下仍可誘導較高的熒光素酶表達水平(圖 5C);而在高血清條件下,即便在較高的 mRNA 劑量下,該載體系統仍能實現顯著增強的熒光素酶表達(圖 5D)。
上述結果表明,HEVs 的體外基因沉默和基因表達效率均優于傳統的 LCNPs。
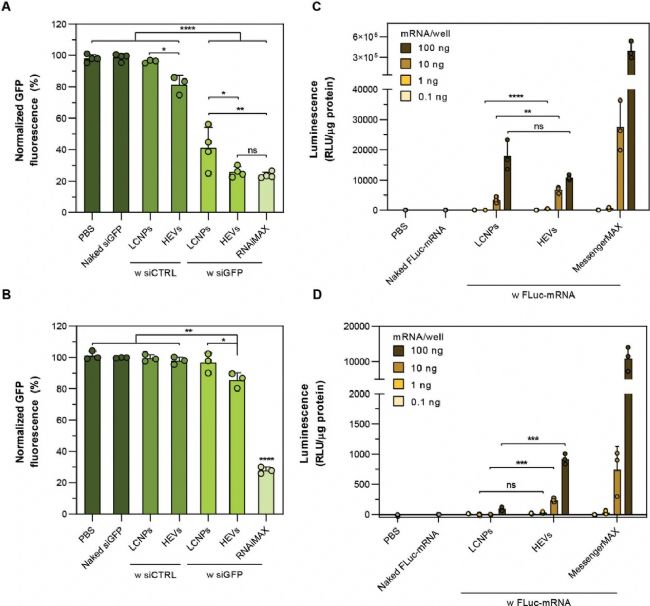
圖5. HEVs 在體外的基因沉默和基因表達效率
結論
本研究開發了一種新型非層狀液晶脂質納米顆粒與 EVs 的雜交策略,獲得的雜交 EVs 成功實現了核酸的高效裝載。這一策略在避免了傳統方法對 EVs 結構影響的前提下,顯著提高了核酸的裝載效率,同時保留了 EVs 的生物活性。這一多功能平臺展現了將各種治療性藥物裝載到 EVs 中的巨大潛力,為開發基于 EV 的基因遞送系統開辟了新的路徑。
展 望
NanoFCM 憑借卓越的散射和熒光靈敏度,在單顆粒水平解析了 HEVs 的粒徑分布、濃度、融合效率和膜蛋白表達等多維信息。這使得研究者能夠精確監測 EVs 與 LCNPs 的雜交過程,并高效評估了多種非編碼 RNA 分子(即 mRNA、siRNA 和核酸適配體)載入 EVs 的效率。NanoFCM 的單顆粒多參數表征能力為深入探究生物雜交載體平臺提供了有力支持,進而推動基于 EVs 的基因遞送系統的發展。






