Pipetty電動移液器在犬細小病毒檢測(熒光PCR實驗)中的應用
方案摘要:熒光 PCR 技術,是基于聚合酶鏈式反應(PCR)技術結合熒光探針實時監測,實現對病毒核酸(DNA)進行高靈敏、高特異、可定量檢測的分子生物學方法,廣泛應用于臨床快速診斷、流行病學調查及疫苗效果評估等場景。為提升實驗效率,本方案使用了Pipetty電動移液器,通過其自動混勻和連續分液功能,提高上樣效率,并且由于其體積小,重量輕,在提高效率的同時,還能減少操作者的手部疲勞。

方案詳情:
一、實驗原理
犬細小病毒(CPV)熒光 PCR 實驗基于實時熒光定量 PCR(qPCR)技術,核心是通過特異性核酸擴增與熒光信號實時監測實現病毒檢測。實驗針對 CPV 高度保守的 VP2 基因設計特異性引物與 TaqMan 熒光探針 —— 探針兩端分別標記熒光報告基團與淬滅基團,未反應時淬滅基團抑制熒光信號。PCR 反應中,Taq 酶延伸引物時,其 5'→3' 外切酶活性水解結合靶序列的探針,使兩基團分離,釋放熒光。熒光信號強度與 PCR 產物量(即初始 CPV DNA 量)正相關,通過儀器實時采集信號,以熒光達到閾值的循環數(Ct 值)及 “S 型” 擴增曲線判讀結果,兼具高靈敏度、高特異性與定量能力。
二、實驗準備
1、設配和材料
① Pipetty電動移液器MSIC01-03-20,MSIC01-03-250;
② 冰箱(4℃、-20 ℃、-70 ℃);
③ 熒光 PCR 儀;
④ 高速冷凍離心機(4℃、離心速度12000r/min 以上);
⑤ 無DNA酶離心管與帶濾芯吸頭。

2、試劑和材料
① DEPC水(0.1%);
② Premix Ex Taq(Probe qPCR)(2X);
③ 反應緩沖液;
④ MgCl2 ;
⑤ dNTP Mix;
⑥ Taq 酶。
⑦ 上游引物(PrimerF):5'-GACAATCTTGCACCAATGAG-3';
下游引物(PrimerR):5'-CCAGATCCTGTAGCTCTTTC-3';
Primer P:5'-(FAM)TGGAGCAGTTCAACCAGACGG(BHQ1)-3'。

三、實驗步驟
1、用DEPC水作為CPV陰性對照,用CPV的細胞培養物作為CPV陽性對照,無酶水作為空白對照。
2、使用Pipetty電動移液器,取處理好的待檢樣品上清液500μL置于1.5mL無DNA酶離心管中,加入500μL DNAiso Reagent 試劑,顛倒混勻6次~8次,靜置約10 min后,12 000 r/min 離心 10 min。

3、取上清液(至少500 μL)至新的 1.5 ml無 DNA酶離心管中,每管加入 400 μL無水乙醇,顛倒混勻6次~8次,4000r/min離心2min。
4、 小心棄掉上清液,加1mL 75%(體積分數)乙醇溶液,顛倒混勻6次~8次,12000 r/min離心5 min。
5、小心棄掉上清液,倒置在干凈的吸水紙上晾干水分,加入20μL DEPC水溶解DNA沉淀。-20℃冰箱中保存備用。
注:可以使用等效的商品化試劑盒進行DNA提取。
6、使用Pipetty電動移液器,根據表2的熒光PCR反應體系,設置單次分液模式,將除DNA模板之外的試劑按照所需孔數計算體積并×10%,移取至離心管中,混勻模式,自動混勻。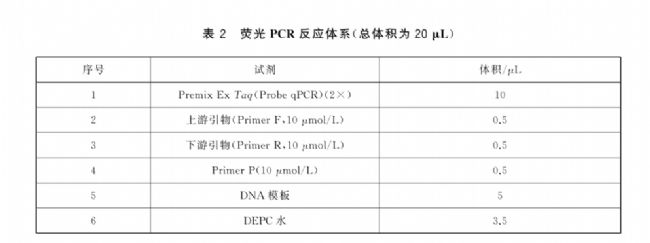
7、設置連續分液模式,將混合好的試劑和DNA模板分別加入到96孔板中,離心。
8、將PCR管置熒光 PCR儀上按如下程序擴增:95℃預變性3min;95℃變性10s,60℃退火延伸30s,40個循環。每個循環60℃收集FAM 熒光。
四、結果判定
1、試驗成立條件
a) 陰性對照無Ct值或C≥40,且無特定的S型擴增曲線;
b) 陽性對照的Ct<35,且出現特定的S型擴增曲線;
c) 陰性對照和陽性對照同時滿足以上條件可判定試驗有效,否則試驗無效;
2、 結果描述及判定
a) 無Ct值或Ct≥40,目無特定的S型擴增曲線,判為CPV核酸陰性。
b) Ct≤38,且出現特定的S型擴增曲線,判為CPV核酸陽性,擴增曲線圖見附錄D。
c) 38<Ct<40且出現特定的S型擴增曲線,判為可疑。在排除樣本或產物污染的可能性后,重新提取核酸檢測,無 Ct值或 Ct≥40且無特定的S型擴增曲線,判為 CPV 核酸陰性,Ct<40且出現特定的S型擴增曲線,判為CPV核酸陽性。

方案詳情:
一、實驗原理
犬細小病毒(CPV)熒光 PCR 實驗基于實時熒光定量 PCR(qPCR)技術,核心是通過特異性核酸擴增與熒光信號實時監測實現病毒檢測。實驗針對 CPV 高度保守的 VP2 基因設計特異性引物與 TaqMan 熒光探針 —— 探針兩端分別標記熒光報告基團與淬滅基團,未反應時淬滅基團抑制熒光信號。PCR 反應中,Taq 酶延伸引物時,其 5'→3' 外切酶活性水解結合靶序列的探針,使兩基團分離,釋放熒光。熒光信號強度與 PCR 產物量(即初始 CPV DNA 量)正相關,通過儀器實時采集信號,以熒光達到閾值的循環數(Ct 值)及 “S 型” 擴增曲線判讀結果,兼具高靈敏度、高特異性與定量能力。
二、實驗準備
1、設配和材料
① Pipetty電動移液器MSIC01-03-20,MSIC01-03-250;
② 冰箱(4℃、-20 ℃、-70 ℃);
③ 熒光 PCR 儀;
④ 高速冷凍離心機(4℃、離心速度12000r/min 以上);
⑤ 無DNA酶離心管與帶濾芯吸頭。

2、試劑和材料
① DEPC水(0.1%);
② Premix Ex Taq(Probe qPCR)(2X);
③ 反應緩沖液;
④ MgCl2 ;
⑤ dNTP Mix;
⑥ Taq 酶。
⑦ 上游引物(PrimerF):5'-GACAATCTTGCACCAATGAG-3';
下游引物(PrimerR):5'-CCAGATCCTGTAGCTCTTTC-3';
Primer P:5'-(FAM)TGGAGCAGTTCAACCAGACGG(BHQ1)-3'。

三、實驗步驟
1、用DEPC水作為CPV陰性對照,用CPV的細胞培養物作為CPV陽性對照,無酶水作為空白對照。
2、使用Pipetty電動移液器,取處理好的待檢樣品上清液500μL置于1.5mL無DNA酶離心管中,加入500μL DNAiso Reagent 試劑,顛倒混勻6次~8次,靜置約10 min后,12 000 r/min 離心 10 min。

3、取上清液(至少500 μL)至新的 1.5 ml無 DNA酶離心管中,每管加入 400 μL無水乙醇,顛倒混勻6次~8次,4000r/min離心2min。
4、 小心棄掉上清液,加1mL 75%(體積分數)乙醇溶液,顛倒混勻6次~8次,12000 r/min離心5 min。
5、小心棄掉上清液,倒置在干凈的吸水紙上晾干水分,加入20μL DEPC水溶解DNA沉淀。-20℃冰箱中保存備用。
注:可以使用等效的商品化試劑盒進行DNA提取。
6、使用Pipetty電動移液器,根據表2的熒光PCR反應體系,設置單次分液模式,將除DNA模板之外的試劑按照所需孔數計算體積并×10%,移取至離心管中,混勻模式,自動混勻。

7、設置連續分液模式,將混合好的試劑和DNA模板分別加入到96孔板中,離心。

8、將PCR管置熒光 PCR儀上按如下程序擴增:95℃預變性3min;95℃變性10s,60℃退火延伸30s,40個循環。每個循環60℃收集FAM 熒光。
四、結果判定
1、試驗成立條件
a) 陰性對照無Ct值或C≥40,且無特定的S型擴增曲線;
b) 陽性對照的Ct<35,且出現特定的S型擴增曲線;
c) 陰性對照和陽性對照同時滿足以上條件可判定試驗有效,否則試驗無效;
2、 結果描述及判定
a) 無Ct值或Ct≥40,目無特定的S型擴增曲線,判為CPV核酸陰性。
b) Ct≤38,且出現特定的S型擴增曲線,判為CPV核酸陽性,擴增曲線圖見附錄D。
c) 38<Ct<40且出現特定的S型擴增曲線,判為可疑。在排除樣本或產物污染的可能性后,重新提取核酸檢測,無 Ct值或 Ct≥40且無特定的S型擴增曲線,判為 CPV 核酸陰性,Ct<40且出現特定的S型擴增曲線,判為CPV核酸陽性。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






