Pipetty電動移液器在豬藍耳病毒檢測(間接Elisa)中的應用
方案摘要:豬繁殖與呼吸綜合征,是由病毒(PRRSV)感染豬引起的一種高度傳染性疫病,臨床表現為母豬繁殖系統障礙,斷奶仔豬消瘦、生長遲緩以及死亡率增加。該病能引起豬體溫升高、呼吸困難,導致豬耳朵發紺,又稱藍耳病,間接 ELISA 檢測是臨床和實驗室中常用的血清學檢測方法,核心目的是通過檢測豬血清 / 血漿中的 PRRSV 特異性抗體,判斷豬只是否感染過 PRRSV 或接種疫苗后是否產生免疫應答。使用Pipetty電動移液器連續多次分液功能,可以大幅縮短加樣時間,降低人為引起的精度誤差,減少使用者的手部疲勞,有效提升了檢測效率。

方案詳情:
一、實驗原理
該方法通過檢測豬血清中 PRRSV 特異性抗體,判斷感染或疫苗免疫情況,核心為 “固相抗原捕獲 + 酶標二抗信號放大”:先將 PRRSV 特異性抗原(需匹配美洲型 / 歐洲型)包被酶標板并封閉,加入待檢樣本后,若含目標抗體則與抗原結合,洗去游離成分;再加入酶標抗豬 IgG 二抗,結合形成“抗原 - 抗體 - 酶標二抗”復合物,洗板后加底物顯色。通過酶標儀讀 OD 值,結合陰陽性對照定臨界值判讀結果。需注意:無法區分自然感染與疫苗免疫,感染后 7-14 天內抗體未產生可能漏檢。
二、實驗準備
1、設配和材料
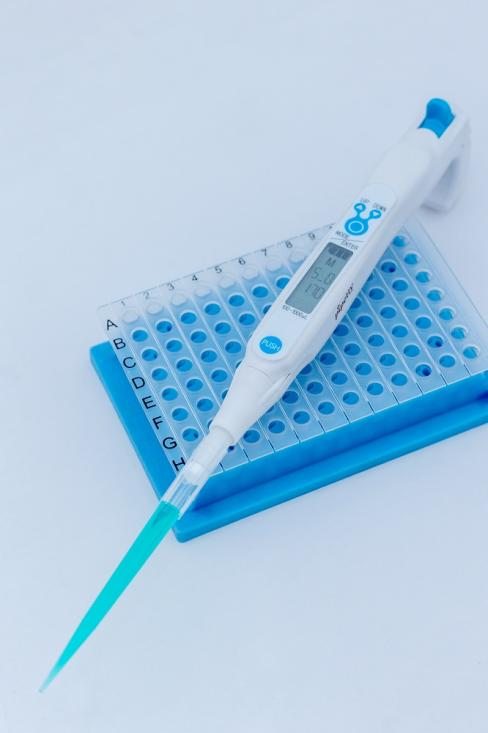
① Pipetty電動移液器MSIC01-03-250、MSIC01-02-1000及配套吸頭;
② 96孔平底聚苯乙烯酶標反應板;
③ 酶聯免疫測定儀;
④ 37 ℃恒溫箱。
2、試劑和材料
① PRRSV 抗原:提純的 PRRSV 重組 N蛋白抗原(PRRSV-1或 PRRSV-2或其混合抗原);
② PRRSV 陽性血清、陰性血清、HRP-免抗豬IgG結合物。使用前用稀釋液稀釋至工作濃度;
③ 洗滌液、血清稀釋液、顯色/底物溶液(TMB-H202)、抗原稀釋液、封閉液等(也可使用商品化的檢測 PRRSV N蛋白抗體的試劑盒)。

三、實驗步驟
1、用抗原稀釋液將 PRRSV抗原稀釋成工作濃度,使用Pipetty電動移液器,設置連續分液模式,每孔 100 μL,加入 96 孔反應板中,封板后置濕盒內 37 ℃恒溫箱中 60 min,然后放入4℃冰箱過夜。

2、棄去板中稀釋液,加洗滌液洗板,300μL/孔,洗滌3次,每次1min,在吸水紙上輕輕拍干。
3、加入封閉液,200μL/孔,封板后置濕盒內 37 ℃恒溫箱中反應 60 min。
4、用步驟2的方式,再一次進行洗滌。
5、取5 μL血清樣本,加入195μL血清稀釋液,自動混勻,進行1:40稀釋。在 PRRSV 抗原包被反應板中加入稀釋的被檢血清、陽性血清對照和陰性血清對照,每孔100μL。陽性血清對照和陰性血清對照名加入相鄰的2個孔,每份血清樣本加1孔。封板后置濕盒內于 37 ℃恒溫箱中反應 30 min。

6、用步驟2的方式,再一次進行洗滌。
7、加入工作濃度的 HRP-免抗豬 IgG 結合物,100 μL/孔,封板后置濕盒內于 37 ℃恒溫箱中反應30 min。
8、用步驟2的方式,再一次進行洗滌。
9、加入新配制的顯色/底物溶液(TMB-H2O2),100 μL/孔,封板后在 37 ℃恒溫箱中避光反應15 min。
10、加入反應終止液(1 mol/L 氫氟酸溶液或 10%SDS 溶液),100 μL/孔,終止反應。
11、光密度(OD)值測定:在酶聯免疫測定儀上讀取反應板各孔波長450 nm(氫氟酸終止)或650 nm(SDS 終止)的 OD值。

四、結果判定
1、試驗成立條件:陽性血清對照平均 OD 值與陰性血清對照平均 OD 值的差值≥0.15 時,試驗成立。否則,應重新進行試驗。
2、計算血清樣本的 S/P比值。若被檢血清樣本的 S/P比值≥0.4,判定為 PRRSV 抗體陽性。被檢血清樣本的 S/P 比值<0.3,判定為PRRSV 抗體陰性。0.3≤被檢血清樣本的 S/P 比值<0.4,判定為可疑;對可疑樣本重復檢測一次,若仍為可疑,則可判定為陽性。
血清樣本 S/P 比值的計算公式:S/P=(樣本 OD值 - 陰性血清對照平均 OD值)/(陽性血清對照平均 OD 值 - 陰性血清對照平均 OD 值)。

方案詳情:
一、實驗原理
該方法通過檢測豬血清中 PRRSV 特異性抗體,判斷感染或疫苗免疫情況,核心為 “固相抗原捕獲 + 酶標二抗信號放大”:先將 PRRSV 特異性抗原(需匹配美洲型 / 歐洲型)包被酶標板并封閉,加入待檢樣本后,若含目標抗體則與抗原結合,洗去游離成分;再加入酶標抗豬 IgG 二抗,結合形成“抗原 - 抗體 - 酶標二抗”復合物,洗板后加底物顯色。通過酶標儀讀 OD 值,結合陰陽性對照定臨界值判讀結果。需注意:無法區分自然感染與疫苗免疫,感染后 7-14 天內抗體未產生可能漏檢。
二、實驗準備
1、設配和材料
① Pipetty電動移液器MSIC01-03-250、MSIC01-02-1000及配套吸頭;
② 96孔平底聚苯乙烯酶標反應板;
③ 酶聯免疫測定儀;
④ 37 ℃恒溫箱。

2、試劑和材料
① PRRSV 抗原:提純的 PRRSV 重組 N蛋白抗原(PRRSV-1或 PRRSV-2或其混合抗原);
② PRRSV 陽性血清、陰性血清、HRP-免抗豬IgG結合物。使用前用稀釋液稀釋至工作濃度;
③ 洗滌液、血清稀釋液、顯色/底物溶液(TMB-H202)、抗原稀釋液、封閉液等(也可使用商品化的檢測 PRRSV N蛋白抗體的試劑盒)。

三、實驗步驟
1、用抗原稀釋液將 PRRSV抗原稀釋成工作濃度,使用Pipetty電動移液器,設置連續分液模式,每孔 100 μL,加入 96 孔反應板中,封板后置濕盒內 37 ℃恒溫箱中 60 min,然后放入4℃冰箱過夜。

2、棄去板中稀釋液,加洗滌液洗板,300μL/孔,洗滌3次,每次1min,在吸水紙上輕輕拍干。
3、加入封閉液,200μL/孔,封板后置濕盒內 37 ℃恒溫箱中反應 60 min。
4、用步驟2的方式,再一次進行洗滌。
5、取5 μL血清樣本,加入195μL血清稀釋液,自動混勻,進行1:40稀釋。在 PRRSV 抗原包被反應板中加入稀釋的被檢血清、陽性血清對照和陰性血清對照,每孔100μL。陽性血清對照和陰性血清對照名加入相鄰的2個孔,每份血清樣本加1孔。封板后置濕盒內于 37 ℃恒溫箱中反應 30 min。

6、用步驟2的方式,再一次進行洗滌。
7、加入工作濃度的 HRP-免抗豬 IgG 結合物,100 μL/孔,封板后置濕盒內于 37 ℃恒溫箱中反應30 min。
8、用步驟2的方式,再一次進行洗滌。
9、加入新配制的顯色/底物溶液(TMB-H2O2),100 μL/孔,封板后在 37 ℃恒溫箱中避光反應15 min。
10、加入反應終止液(1 mol/L 氫氟酸溶液或 10%SDS 溶液),100 μL/孔,終止反應。
11、光密度(OD)值測定:在酶聯免疫測定儀上讀取反應板各孔波長450 nm(氫氟酸終止)或650 nm(SDS 終止)的 OD值。

四、結果判定
1、試驗成立條件:陽性血清對照平均 OD 值與陰性血清對照平均 OD 值的差值≥0.15 時,試驗成立。否則,應重新進行試驗。
2、計算血清樣本的 S/P比值。若被檢血清樣本的 S/P比值≥0.4,判定為 PRRSV 抗體陽性。被檢血清樣本的 S/P 比值<0.3,判定為PRRSV 抗體陰性。0.3≤被檢血清樣本的 S/P 比值<0.4,判定為可疑;對可疑樣本重復檢測一次,若仍為可疑,則可判定為陽性。
血清樣本 S/P 比值的計算公式:S/P=(樣本 OD值 - 陰性血清對照平均 OD值)/(陽性血清對照平均 OD 值 - 陰性血清對照平均 OD 值)。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






