實(shí)驗(yàn)研究:慢病毒感染RAW264.7細(xì)胞的一般MOI值
非小細(xì)胞肺癌(NSCLC)是肺癌中最常見的類型,預(yù)后較差且轉(zhuǎn)移率高,其轉(zhuǎn)移過程涉及復(fù)雜機(jī)制,包括腫瘤相關(guān)巨噬細(xì)胞(TAMs)分泌的趨化因子。現(xiàn)有靶向趨化因子的策略如單克隆抗體、小分子抑制劑等存在腫瘤靶向性差、生物相容性低的問題。2025年11月,中山大學(xué)附屬第三醫(yī)院張凱、黃帥、徐建南聯(lián)合中山大學(xué)附屬第一醫(yī)院吉喆研究團(tuán)隊(duì)在Materials Today Bio (IF 10.2)發(fā)表題為“Targeting chemokine-driven metastasis in non-small cell lung cancer: Development and evaluation of chemokine nanosponges for therapy”的研究論文,構(gòu)建了CCR6修飾巨噬細(xì)胞膜(CCR6-MM)包裹Toll樣受體7/8激動(dòng)劑R848的趨化因子納米海綿(CCR6-MM@PS/R848),該納米海綿兼具CCL20吸附靶向能力與M2型TAMs向M1型極化功能,經(jīng)體外和體內(nèi)實(shí)驗(yàn)驗(yàn)證,其具有良好生物相容性,能雙重抑制腫瘤生長(zhǎng)與轉(zhuǎn)移,為NSCLC轉(zhuǎn)移治療提供了新型策略。

· 維真助力·
病毒產(chǎn)品:Lv-CCR6
感染細(xì)胞:RAW264.7細(xì)胞
MOI:50
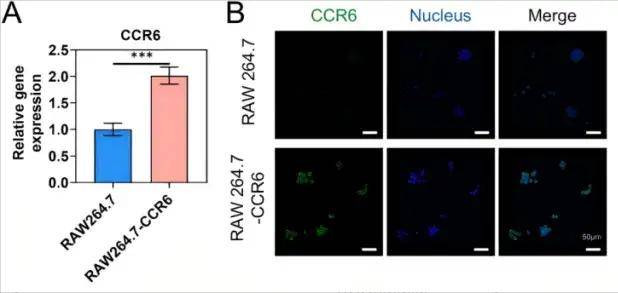
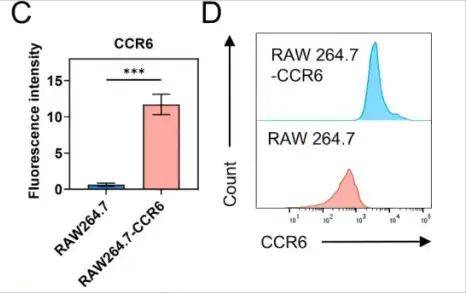
RAW264.7細(xì)胞中CCR6表達(dá)顯著增加
研究結(jié)果
1.CCR6-MM@PS/R848的構(gòu)建、表征及生物相容性評(píng)估
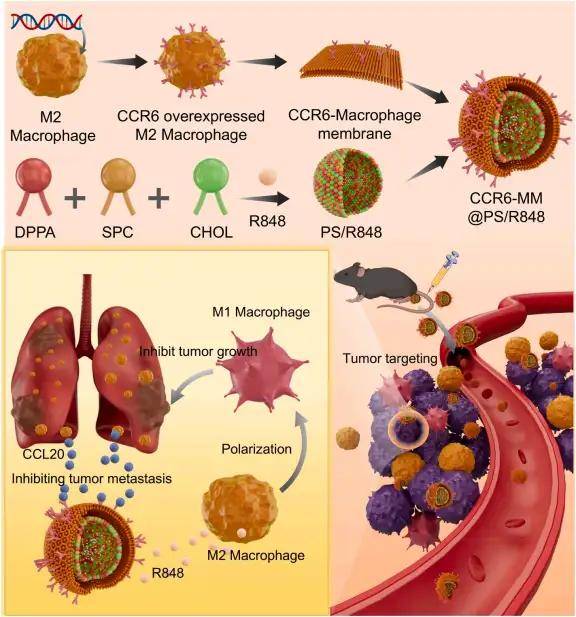
單細(xì)胞測(cè)序分析發(fā)現(xiàn),NSCLC轉(zhuǎn)移灶中M2型巨噬細(xì)胞通過高表達(dá)趨化因子CCL20驅(qū)動(dòng)腫瘤轉(zhuǎn)移,這為靶向CCL20-CCR6軸提供了理論依據(jù)。研究人員利用慢病毒轉(zhuǎn)染RAW264.7細(xì)胞,使其高表達(dá)CCR6(CCL20的受體),提取其細(xì)胞膜制備成CCR6修飾的巨噬細(xì)胞膜(CCR6-MM),然后使用薄膜水合法制備含R848(TLR7/8激動(dòng)劑)的脂質(zhì)體(PS/R848),將CCR6-MM與PS/R848融合,形成納米海綿復(fù)合物。驗(yàn)證結(jié)果顯示CCR6-MM@PS/ R848復(fù)合物在摻入R848組分的同時(shí)保留了原始細(xì)胞膜的功能特征,并能在體外和體內(nèi)有效靶向表達(dá)CCR6的細(xì)胞和組織。生物相容性評(píng)估表明,CCR6-MM@PS/R848納米顆粒在細(xì)胞和動(dòng)物層面均展現(xiàn)出優(yōu)異的安全性,該制劑無細(xì)胞毒性、溶血和器官毒性,表明其是進(jìn)一步臨床前和臨床開發(fā)的有希望的候選藥物。
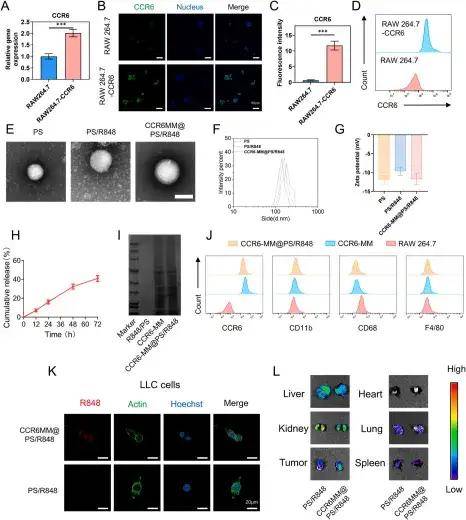 CCR6-MM@PS/R848的表征
CCR6-MM@PS/R848的表征
2.CCR6-MM@PS/R848將M2巨噬細(xì)胞重編程為M1表型
接下來,研究團(tuán)隊(duì)研究了CCR6-MM@PS/R848將Raw264.7巨噬細(xì)胞從M2表型重編程為M1表型的能力。結(jié)果顯示,經(jīng)CCR6-MM@PS/R848處理的細(xì)胞從M2典型的細(xì)長(zhǎng)紡錘形轉(zhuǎn)變?yōu)镸1典型的多角形形態(tài),且M1標(biāo)志物上調(diào),M2標(biāo)志物下調(diào);同時(shí)細(xì)胞因子分泌譜改變,促炎性的M1特征細(xì)胞因子分泌增加,抑炎性的M2特征細(xì)胞因子分泌減少。這些結(jié)果表明,CCR6-MM@PS/R848具有強(qiáng)大的將M2巨噬細(xì)胞重編程為M1表型的能力。皮下腫瘤模型中,CCR6-MM@PS/R848組腫瘤體積顯著小于其他組,Ki67陽性率最低(細(xì)胞增殖受抑),腫瘤組織壞死區(qū)域顯著。進(jìn)一步的研究表明,CCR6-MM@PS/R848在體內(nèi)同樣能有效地將腫瘤相關(guān)巨噬細(xì)胞從促瘤的M2表型重編程為抗瘤的M1表型。
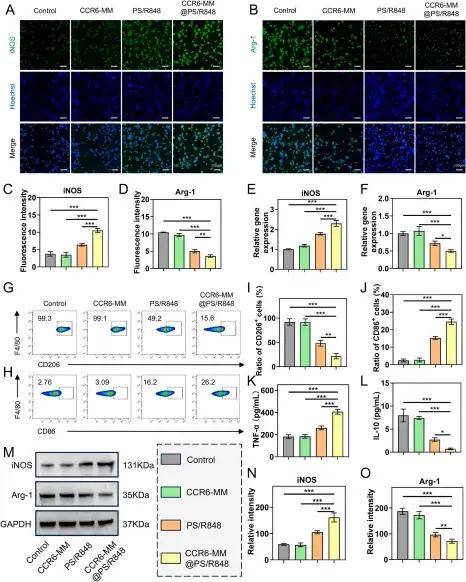
CCR6-MM@PS/R848體外促進(jìn)RAW264.7細(xì)胞M1極化
3.CCR6-MM@PS/R848抑制肺癌細(xì)胞轉(zhuǎn)移
最后,研究團(tuán)隊(duì)探究了該納米顆粒對(duì)腫瘤細(xì)胞惡性行為的影響。ELISA檢測(cè)證實(shí),經(jīng)CCR6-MM@PS/R848處理的巨噬細(xì)胞,其培養(yǎng)上清中的CCL20濃度因巨噬細(xì)胞M2向M1表型重編程和CCR6膜對(duì)CCL20的主動(dòng)吸附而顯著下降。使用上述處理后的巨噬細(xì)胞培養(yǎng)上清來培養(yǎng)肺癌細(xì)胞(LLC),發(fā)現(xiàn)肺癌細(xì)胞的遷移和侵襲數(shù)量均顯著減少,表明CCR6-MM@PS/R848對(duì)巨噬細(xì)胞的重編程有效地抑制了LLC細(xì)胞的轉(zhuǎn)移潛能。在實(shí)驗(yàn)性肺轉(zhuǎn)移模型中,體內(nèi)研究進(jìn)一步驗(yàn)證了其療效:與對(duì)照組相比,CCR6-MM@PS/R848治療組小鼠的生存期顯著延長(zhǎng),肺臟轉(zhuǎn)移結(jié)節(jié)數(shù)量顯著減少。免疫組化與ELISA分析均顯示,治療組腫瘤組織中的CCL20水平顯著降低,明確了其體內(nèi)作用機(jī)制。上述體內(nèi)外結(jié)果一致表明,CCR6-MM@PS/R848能有效抑制肺癌轉(zhuǎn)移,且在整個(gè)過程中保持良好的生物相容性,凸顯了其巨大的治療潛力。
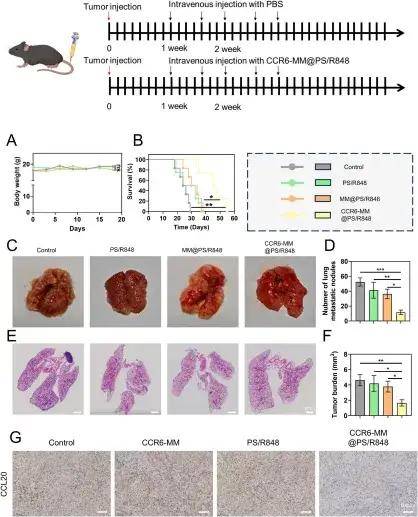
通過CCR6-MM@PS/R848進(jìn)行的體內(nèi)抗腫瘤轉(zhuǎn)移
研究結(jié)論
本研究通過單細(xì)胞RNA測(cè)序技術(shù),發(fā)現(xiàn)轉(zhuǎn)移灶中M2型腫瘤相關(guān)巨噬細(xì)胞的趨化因子分泌功能增強(qiáng),其中CCL20成為關(guān)鍵靶點(diǎn)。體外及體內(nèi)實(shí)驗(yàn)驗(yàn)證了CCR6-MM與R848組合的治療潛力,證實(shí)其具有良好生物相容性、巨噬細(xì)胞極化效能,并能雙重抑制腫瘤生長(zhǎng)與轉(zhuǎn)移,揭示了趨化因子納米海綿作為NSCLC轉(zhuǎn)移治療新策略的巨大潛力。
- 實(shí)驗(yàn)研究:慢病毒感染RAW264.7細(xì)胞的一般MOI值
- 增強(qiáng)AAV對(duì)腎臟組織的感染效率的方法分享
- 文獻(xiàn):AAA中內(nèi)皮細(xì)胞在單細(xì)胞水平上的異質(zhì)性和轉(zhuǎn)錄特征
- 鄰位連接技術(shù)(PLA)的原理、實(shí)驗(yàn)流程及在生命科學(xué)研究中的應(yīng)用
- 衰老標(biāo)志的因果關(guān)系:端粒/rDNA才是根本因素?
- 蛋白質(zhì)結(jié)構(gòu)預(yù)測(cè)的技術(shù)變革、新挑戰(zhàn)與發(fā)展方向
- 空間多組學(xué)助力揭示膠質(zhì)瘤中三級(jí)淋巴結(jié)構(gòu)的臨床意義
- CZ CELLxGENE Discover生物數(shù)據(jù)庫使用步驟介紹
- 上海生物芯片推出SMI WTX與空間蛋白聯(lián)合檢測(cè)方案
- 樂備實(shí)蛋白檢測(cè)拼板、趨化因子檢測(cè)多重年終福利開啟
- 上海生物芯片即將推出"血管化器官芯片"產(chǎn)品和服務(wù)
- 生物芯片推出WTX與多平臺(tái)蛋白組檢測(cè)技術(shù)解決方案
- 樂備實(shí)全線服務(wù)產(chǎn)品大促,滿減來襲,拼板滿10送1
- 國內(nèi)首批CosMx SMI WTX高通量轉(zhuǎn)錄組實(shí)測(cè)數(shù)據(jù)出爐
- Bruker發(fā)布GeoMx® DPA,實(shí)現(xiàn)1200+種蛋白質(zhì)空間表達(dá)
- SBC芯空一號(hào)產(chǎn)品中的關(guān)鍵技術(shù)平臺(tái)SMI完成重大升級(jí)






