空間多組學助力揭示膠質瘤中三級淋巴結構的臨床意義
題目:Spatial immune profiling defines a subset of human gliomas with functional tertiary lymphoid structures.
期刊:Immunity
IF:26.3
DOI:10.1016/j.immuni.2025.09.018
研究背景
成人彌漫性膠質瘤是最常見的原發性腦腫瘤之一,患者預后極差,且對免疫治療響應極低,被視為典型的免疫上的“冷”腫瘤(“cold” tumors)。膠質瘤的這種免疫抑制特征被認為與腦組織屏障、低突變負荷及免疫細胞浸潤不足密切相關。
近年來,研究者在部分膠質瘤樣本中觀察到類似淋巴結的三級淋巴結構(TLS),提示存在局部免疫活化的可能。TLS能在腫瘤組織內促進抗原呈遞和B/T細胞協同,是多種癌癥中預測免疫治療反應的潛在標志物。然而,TLS在中樞神經系統腫瘤中的存在形式與功能仍不清楚。
本研究利用GeoMx DSP空間轉錄組聯合空間多組學技術,對642例膠質瘤樣本進行了系統性的解析。研究發現,約15%的腫瘤存在功能性TLS,其富含活化的B/T細胞與抗體分泌特征,與患者生存顯著相關,揭示了膠質瘤中罕見但關鍵的免疫活躍的細胞亞群。
實驗設計與技術手段
本研究納入了642例成人型彌漫性膠質瘤樣本,包括434例初發與208例復發病例。研究首先通過免疫組織化學(IHC)與多重免疫熒光(mIF)篩查TLS,并在篩選出的TLS陽性樣本中進一步開展空間分子層面的深入解析。
空間轉錄組部分重點依托GeoMx DSP Whole Transcriptome Atlas平臺完成:
研究團隊在TLS區域、腫瘤區與基質區共選取多個ROIs,檢測約18,000個基因的空間表達譜,進而識別TLS的分子亞型,并利用通路富集、細胞解卷積等算法揭示免疫功能特征。
進一步聯合GeoMx DSP和空間多組學技術,構建了從空間免疫圖譜到臨床預后的系統模型,展示了空間多組學在解析腫瘤免疫異質性中的強大能力。
主要發現
1.TLS的發生頻率與臨床相關性
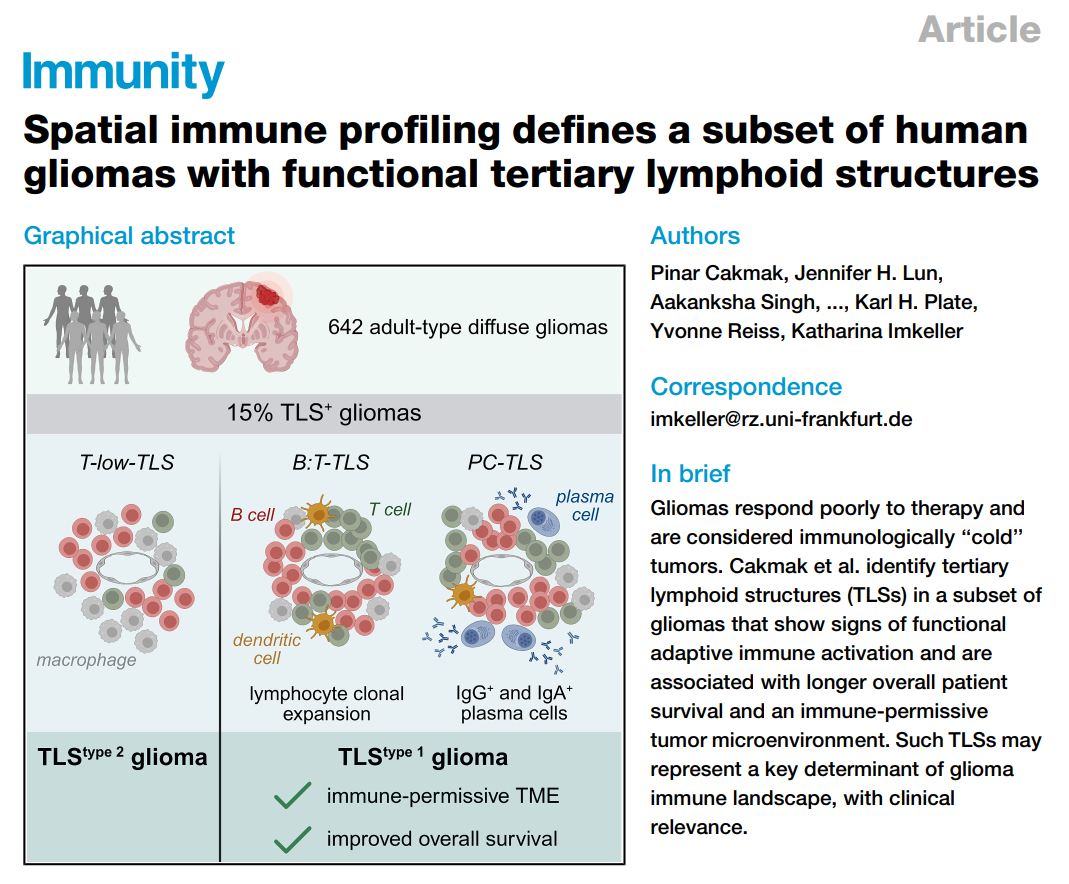
通過免疫組織化學與多重免疫熒光篩查TLS(TLS被定義為由至少50個CD20⁺B細胞,與CD3⁺T細胞和LAMP3⁺成熟樹突細胞緊密相鄰所形成的淋巴樣聚合結構),發現在642例膠質瘤中,約15%樣本存在TLS結構。TLS陽性患者顯示出更長的總體生存期(OS)與無進展生存期(PFS)。研究還發現,TLS的出現與IDH(膠質瘤核心的分子分型標志:IDH突變型預后較好,IDH野生型則高度惡性)基因類型無關。TLS更常見于初次發病的男性患者,以及位于顳頂葉的腫瘤。此外,TLS陽性與陰性樣本在腫瘤突變負荷(TMB)上沒有顯著差別,說明TLS的形成與突變數量無關,更可能與局部免疫環境和組織結構關系密切。
 TLS在膠質瘤中的流行率與預后價值
TLS在膠質瘤中的流行率與預后價值
2.TLS⁺腫瘤的轉錄與蛋白特征
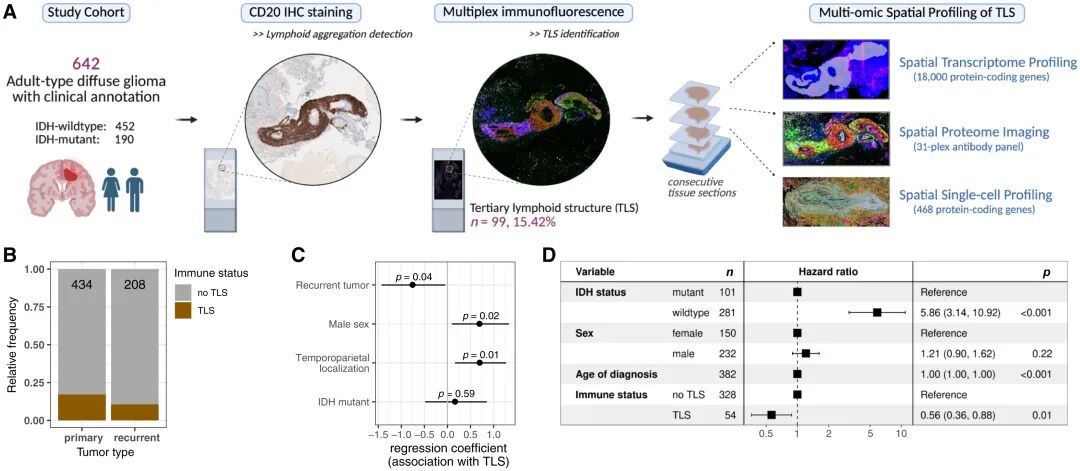
GeoMx DSP數據顯示,TLS⁺區域富集免疫活化相關基因(IGHG1、IGHA1、CD74、HLA-DRA)及基質重塑基因(COL6A1、MMP7),而神經元相關基因顯著下調。細胞解卷積結果提示,TLS⁺樣本中免疫細胞(B/T/DC)及血管周細胞比例上升。空間蛋白成像進一步驗證COL6A1在TLS周圍血管區域沉積,并觀察到CD163⁺巨噬細胞對ECM(細胞外基質)成分的攝取,揭示基質重塑與免疫細胞招募的關聯。
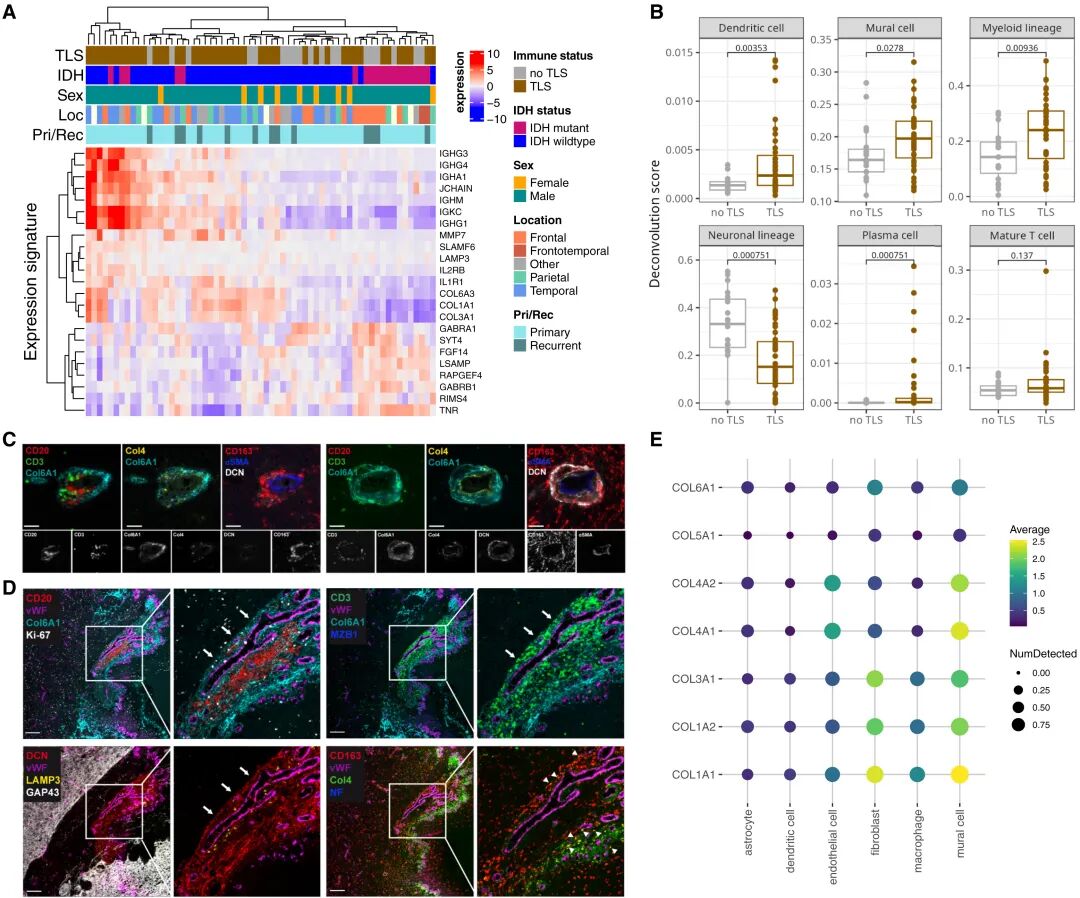 TLS⁺腫瘤的免疫激活與ECM重塑特征
TLS⁺腫瘤的免疫激活與ECM重塑特征
3.TLS的三種分子亞型
基于GeoMx DSP數據進行無監督聚類,研究團隊識別出TLS的三種主要分子亞型:
●T-low-TLS:T細胞稀少,富含神經元與巨噬細胞基因;
●B:T-TLS:抗原呈遞與T/B協同激活信號強,HLA與CXCL13顯著上調;
●PC-TLS:漿細胞標志基因(MZB1、IGHG1)富集,TLS面積與細胞密度更高。
這三種亞型反映了TLS從“早期募集→活化→漿細胞分化”的動態成熟軌跡。
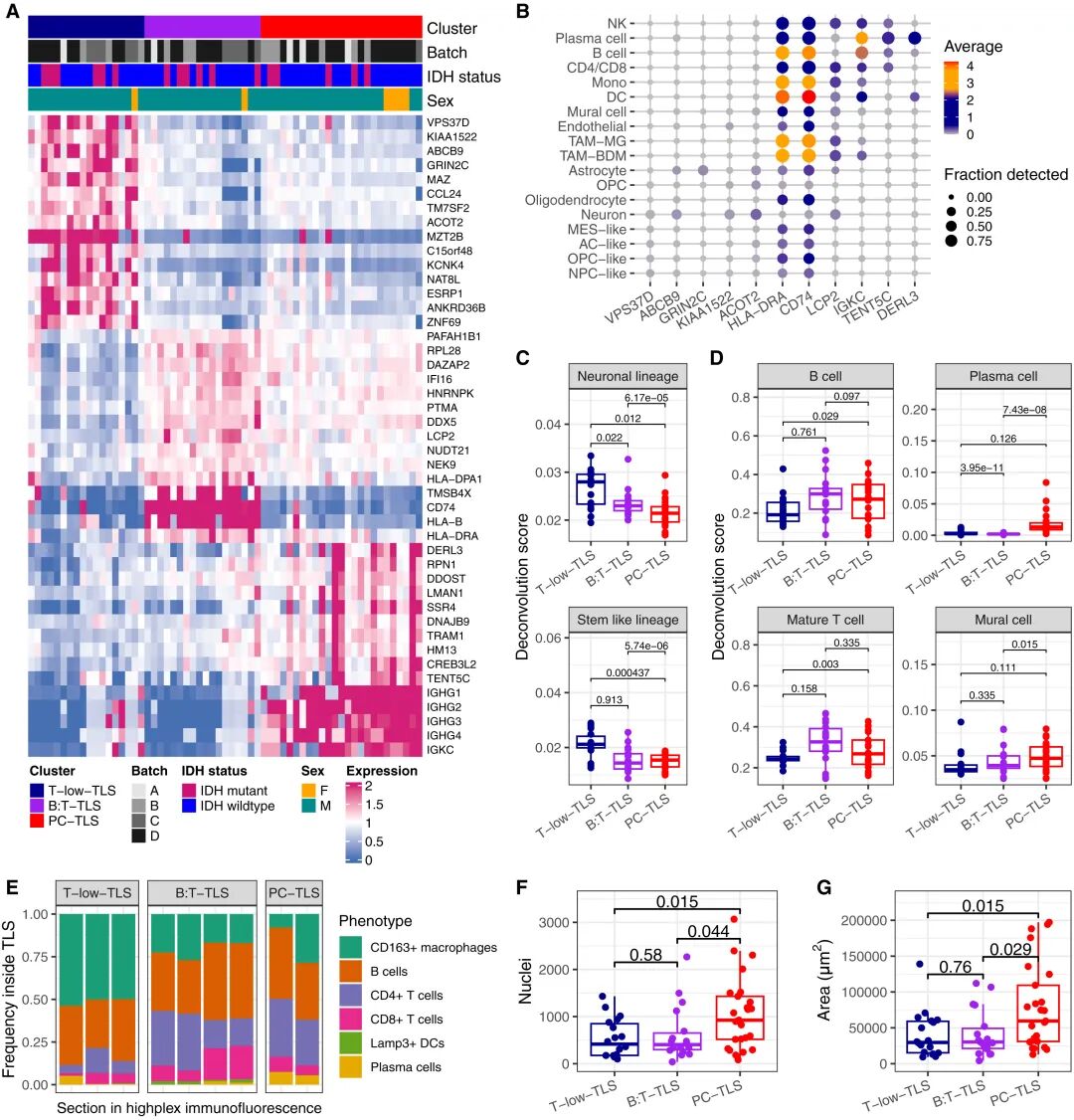 TLS的三種分子亞型與細胞組成差異
TLS的三種分子亞型與細胞組成差異
4.TLS的功能性與空間依賴
進一步研究發現,TLS的三種分子亞型中,B:T-TLS與PC-TLS展現明顯的功能性免疫特征:存在活化的CD4⁺T細胞、漿細胞分區、IgG⁺/IgA⁺抗體產生及BCR克隆擴增,但缺乏典型GC結構(Germinal Center:生發中心結構,淋巴器官內的一個免疫反應區域,與免疫反應密切相關)。聯合空間蛋白成像與空間轉錄組分析表明顯示,TLS的形成受到血管通透性與ECM重塑狀態的調控,而壞死區的免疫抑制環境會抑制TLS成熟。
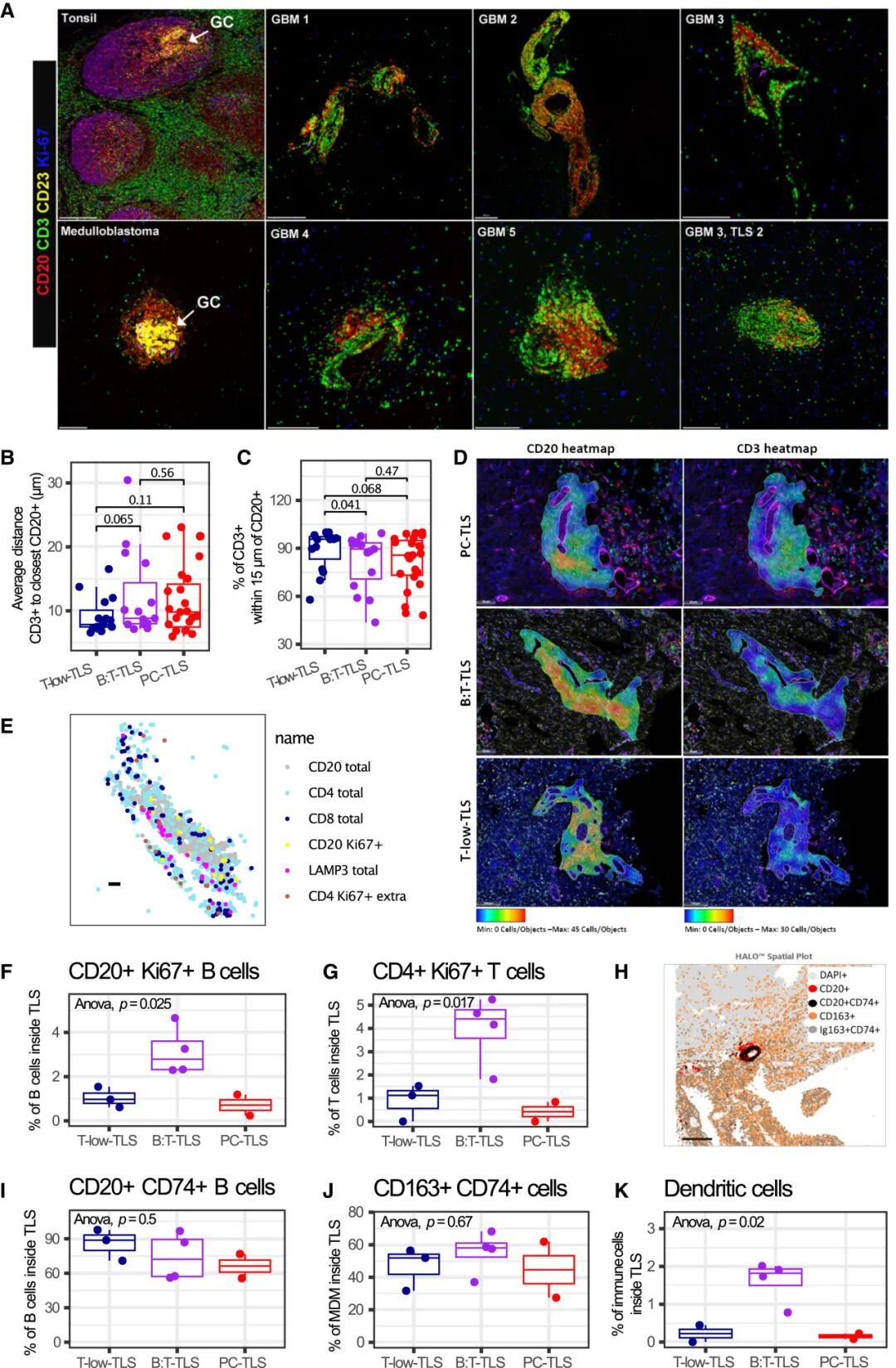 功能性TLS中的細胞互動
功能性TLS中的細胞互動
文章總結
本研究以空間多組學為核心,結合空間轉錄組和空間蛋白組技術,系統揭示了膠質瘤中TLS的空間特征、分子異質性及其臨床意義。研究發現,TLS的存在及其功能性亞型與患者生存顯著改善相關,提示TLS可作為預后和免疫敏感性的標志物,為膠質瘤免疫治療中的患者分層提供了潛在依據。該研究不僅為理解免疫“冷”腫瘤中的局部免疫生態位提供了有力示范,還為預測免疫治療反應和優化個體化治療決策提供了新的思路。






