上海生物芯片即將推出"血管化器官芯片"產品和服務

美國 FIERCE BIOTECH 報道,FDA 近期正式批準全球第一個完全基于人類血管化類器官療效數據的 IND 申請 ——SillaJen 公司提交的 BAL0891 與免疫檢查點抑制劑聯合療法臨床試驗許可。這一里程碑事件,首次證實動物療效(POC)測試不再是臨床前研究的 “必答題”,人類疾病模型研發迎來歷史性轉折。
這一重大突破背后的關鍵技術來自圣地亞哥的Qureator公司。該公司是一家專注于人工智能驅動的人類相關器官芯片(organ-on-chip)平臺的創新企業。他們的核心產品——血管化腫瘤免疫微環境模型(vTIME)是此次IND獲批的關鍵。
vTIME能精準再現人體血管與免疫環境,經 Quricore AI 引擎增強,研究中觀察到藥物協同效應(結果曾在 2025 年 4 月 AACR 年會公布),此次獲批的是評估 BAL0891 與替雷利珠單抗的 IND 修正案。Qureator CEO 表示,該里程碑源于監管與創新合作,正以更具預測性的人類基礎模型重塑臨床前數據向臨床結果的轉化。
美國監管機構推動替代動物模型里程碑
2024年12月 立法奠基:強制落地保障生效
美國國會全票通過《FDA現代化法案3.0》,以立法形式為2022年出臺的《FDA現代化法案2.0》(FDAMA 2.0)掃清實施障礙,明確要求FDA在法案生效后6個月內完成管理規章修訂,從制度層面強制推動替代動物實驗的技術落地。
2025年4月 雙機構協同:明確轉型路徑與技術方向
FDA宣布計劃逐步淘汰傳統動物實驗同步鼓勵采用AI計算模型、人體類器官及器官芯片等“新興替代方法”(NAMs);NIH宣布推動人體器官芯片替代動物模型,啟動跨部門協同驗證機制。
2025年7月 資金杠桿:從資源端倒逼轉型
NIH機構宣布終止純動物實驗資助,將資金導向類器官、器官芯片等替代技術研發,通過資源分配調整,加速科研機構從動物模型向人類相關模型的轉型。
2025年9月 基建支撐:破解標準化瓶頸
NIH牽頭設立全美第一個標準化類器官建模中心,聚焦解決替代模型“操作不統一、數據不可重復”的行業痛點。
2025年10月 規范落地:全流程指引行業轉型
FDA正式發布《替代和減少動物實驗》指導文件,明確替代技術的數據采信標準、驗證流程及應用范圍。
SBC血管化器官芯片
上海生物芯片有限公司即將推出“血管化器官芯片”產品和服務。該芯片通過精準控制細胞外液體微環境(含壓強、滲透液流向調節),生成剪切力誘導三維成熟血管;除了支持HUVEC、NHLF 與腫瘤細胞共培養,還成功實現了血管類器官模型構建,滿足復雜疾病微環境研究,助力藥企快速評估候選藥物療效。“血管化器官芯片”可以有效提升臨床前數據對人體療效的預測準確性,縮短研發周期,降低研發成本,規避實驗動物倫理,為創新藥物研發和精準醫療發展提供強有力的技術支撐。
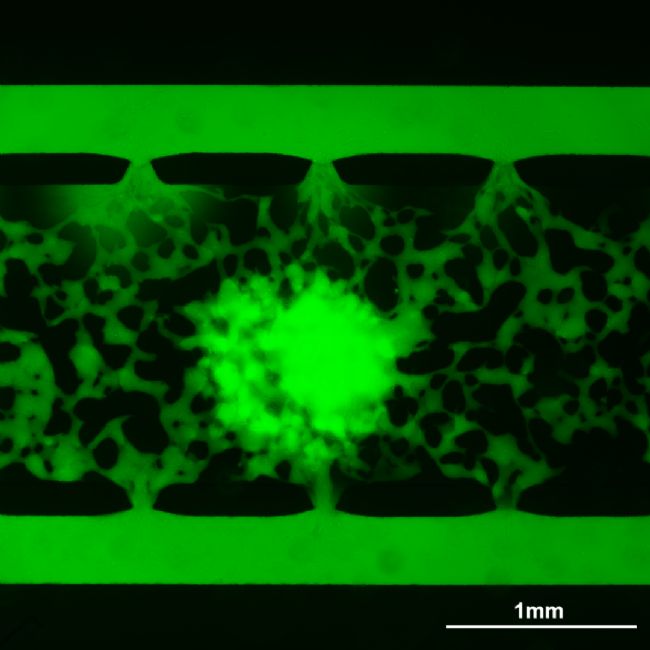
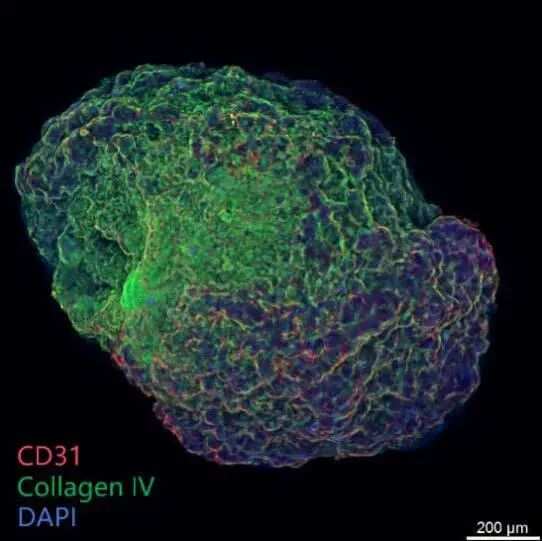
上血管網3D展示
器官芯片服務


參考鏈接:First FDA IND Milestone Achieved Using Human Vascularized Organoid Efficacy Data | Fierce Biotech
- 達科為與Mabtech聯合發布新品EYRA多因子分析儀
- 10x新一代Chromium Flex實現單細胞研究規模化飛躍
- 中喬新舟推出新品自然殺傷NK細胞培養試劑盒
- 新品:德國ViALUX公司發布DLP產品的便捷安裝套件
- NEST推出可滑動細菌皿-自動化灌裝新標配
- 打破常規:德伯科技推出預裝型香煙煙霧發生器CM20C
- 上海天能RapGel系列彩色凝膠快速制備試劑盒新品上市
- 安捷倫推出21 CFR Part 11實時細胞分析合規軟件
- 美國METER升級推出新一代ATMOS 41一體式氣象站
- 國產流式新突破!達科為CytoPeak流式細胞儀發布
- 美德聲推出新品安朗寵物和畜牧動物診斷試劑
- 埃賽力達科技pco.panda 26 DS sCMOS相機新品上市
- 奧偉登IXplore IX85 SpinSR超分辨顯微鏡煥新登場
- BMS公司Myra自動化工作站Workbench 2.0新品上市
- 無掩膜無真空,ATLANT 3D推出直接原子層加工技術
- 上海生物芯片推出SMI WTX與空間蛋白聯合檢測方案
- 樂備實蛋白檢測拼板、趨化因子檢測多重年終福利開啟
- 上海生物芯片即將推出"血管化器官芯片"產品和服務
- 生物芯片推出WTX與多平臺蛋白組檢測技術解決方案
- 樂備實全線服務產品大促,滿減來襲,拼板滿10送1
- 國內首批CosMx SMI WTX高通量轉錄組實測數據出爐
- Bruker發布GeoMx® DPA,實現1200+種蛋白質空間表達
- SBC芯空一號產品中的關鍵技術平臺SMI完成重大升級
- 首屆AI賦能智能化類器官創新與產業發展論壇邀請函
- MCE推出AI藥物篩選平臺,實現數千萬的分子快速篩選
- 生物芯片空間多組學平臺再添一臺CosMx SMI成像系統
- 亞洲首臺CellXpress.ai在上海生物芯片完成裝機
- SBC CosMX WTx單細胞空間全轉錄組正式開放預訂
- 生物芯片推出"芯空一號"方案重塑空間多組學新范式
- IPHASE課堂開課啦:細菌回復突變試驗常見問題與解答







