增強AAV對腎臟組織的感染效率的方法分享
在腎臟研究中常用的AAV載體有AAV2、AAV6、AAV8和AAV9,其中以AAV9居多。啟動子方面可以選擇廣譜性啟動子CMV,也可以選擇Ksp1.3、NPHS1、ACTHR.Tenascin-C(TNC)、Ggt1等特異性啟動子,增強腎臟靶向性,具體可根據您要轉染的腎臟細胞類型進行選擇。
維真案例參考:
糖尿病腎病(DKD)是糖尿病常見的微血管并發癥,足細胞損傷是其關鍵病理特征。長鏈非編碼RNA 在DKD中表達異常,但其在足細胞損傷中的具體作用尚不明確。山東第一醫科大學附屬山東省立醫院王榮/呂智美教授團隊在Cellular and Molecular Life Sciences (IF 6.2)期刊發文“LncRNA ENST00000532153.1 alleviates podocyte injury by inhibiting PARP1-mediated PARylation of ATF3 in diabetic kidney disease”,首次闡明lncRNA ENST00000532153.1(簡稱lncRNA 153) 通過直接結合PARP1,抑制其介導的ATF3 PAR化修飾,進而減輕內質網應激和細胞凋亡,最終緩解DKD中的足細胞損傷,提示lncRNA 153和PARP1可能成為DKD治療的潛在靶點。
糖尿病腎病(DKD)是糖尿病常見的微血管并發癥,足細胞損傷是其關鍵病理特征。長鏈非編碼RNA 在DKD中表達異常,但其在足細胞損傷中的具體作用尚不明確。山東第一醫科大學附屬山東省立醫院王榮/呂智美教授團隊在Cellular and Molecular Life Sciences (IF 6.2)期刊發文“LncRNA ENST00000532153.1 alleviates podocyte injury by inhibiting PARP1-mediated PARylation of ATF3 in diabetic kidney disease”,首次闡明lncRNA ENST00000532153.1(簡稱lncRNA 153) 通過直接結合PARP1,抑制其介導的ATF3 PAR化修飾,進而減輕內質網應激和細胞凋亡,最終緩解DKD中的足細胞損傷,提示lncRNA 153和PARP1可能成為DKD治療的潛在靶點。
· 維真助力 ·
病毒產品:AAV9-nphs1-shPARP1、AAV9-NC
注射方式:尾靜脈注射
病毒用量:1×10^12vg per mouse
病毒產品:AAV9-nphs1-shPARP1、AAV9-NC
注射方式:尾靜脈注射
病毒用量:1×10^12vg per mouse
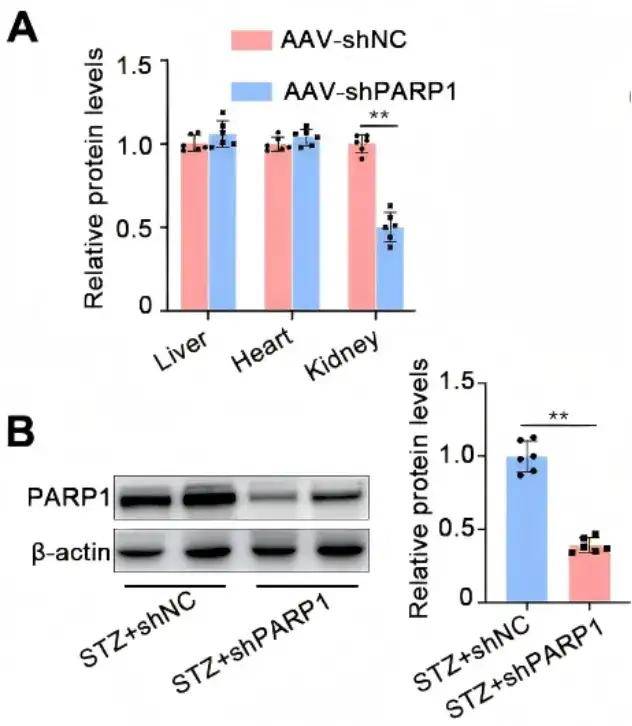
AAV9-nphs1-shPARP1有效介導腎臟組織中PARP1的敲低
部分研究結果
1、LncRNA 153通過調控PARP1表達緩解糖尿病腎病足細胞損傷
研究數據證實LncRNA 153在人類DKD中表達下調,并且其表達量與腎功能指標和疾病嚴重程度密切相關,過表達LncRNA 153可減輕高糖誘導的足細胞損傷。通過RNA Pull-down、RNA免疫共沉淀及熒光共定位等分析發現LncRNA 153與足細胞中的PARP1相互作用,LncRNA 153的過表達能降低PARP1的蛋白水平,但不影響其mRNA水平;相反,敲低LncRNA 153則會增加PARP1的蛋白水平。使用蛋白質合成抑制劑CHX進行的實驗表明,LncRNA 153的過表達會加速PARP1蛋白的降解,提示LncRNA 153通過影響蛋白穩定性來調控PARP1。為了闡明足細胞PARP 1在DKD中的功能,體外實驗中敲低PARP1或使用抑制劑PJ34可緩解高糖誘導的足細胞損傷,相反過表達PARP1則加重損傷。體內實驗中,通過尾靜脈注射AAV9-nphs1-shPARP1,成功構建足細胞特異性PARP1敲低小鼠模型。在STZ誘導的DKD模型中,與未敲低的DKD小鼠相比,PARP1敲低小鼠腎臟病理損傷得到改善,腎皮質中內質網應激和凋亡相關蛋白的表達水平向正常回歸。使用PARP1抑制劑PJ34處理同樣產生上述PARP1敲低所帶來的保護效應,這些結果表明PARP1的激活在DKD相關的ER應激和凋亡中擔當著重要角色。
1、LncRNA 153通過調控PARP1表達緩解糖尿病腎病足細胞損傷
研究數據證實LncRNA 153在人類DKD中表達下調,并且其表達量與腎功能指標和疾病嚴重程度密切相關,過表達LncRNA 153可減輕高糖誘導的足細胞損傷。通過RNA Pull-down、RNA免疫共沉淀及熒光共定位等分析發現LncRNA 153與足細胞中的PARP1相互作用,LncRNA 153的過表達能降低PARP1的蛋白水平,但不影響其mRNA水平;相反,敲低LncRNA 153則會增加PARP1的蛋白水平。使用蛋白質合成抑制劑CHX進行的實驗表明,LncRNA 153的過表達會加速PARP1蛋白的降解,提示LncRNA 153通過影響蛋白穩定性來調控PARP1。為了闡明足細胞PARP 1在DKD中的功能,體外實驗中敲低PARP1或使用抑制劑PJ34可緩解高糖誘導的足細胞損傷,相反過表達PARP1則加重損傷。體內實驗中,通過尾靜脈注射AAV9-nphs1-shPARP1,成功構建足細胞特異性PARP1敲低小鼠模型。在STZ誘導的DKD模型中,與未敲低的DKD小鼠相比,PARP1敲低小鼠腎臟病理損傷得到改善,腎皮質中內質網應激和凋亡相關蛋白的表達水平向正常回歸。使用PARP1抑制劑PJ34處理同樣產生上述PARP1敲低所帶來的保護效應,這些結果表明PARP1的激活在DKD相關的ER應激和凋亡中擔當著重要角色。
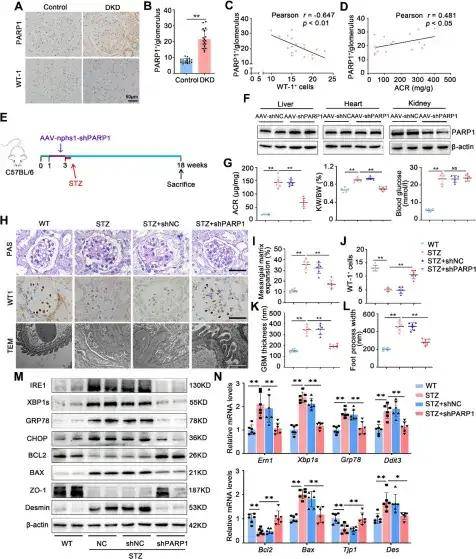
PARP1參與體內ER應激、凋亡和足細胞損傷
2、LncRNA 153通過調節PARP1和ATF3之間的相互作用參與HG誘導的足細胞損傷
研究人員進一步證實PARP1可與ATF3發生相互作用并介導其PAR化修飾,該修飾能激活ATF3的轉錄活性,激活的ATF3會通過結合GRP78等內質網應激相關基因的啟動子促進其轉錄,進而誘發足細胞內質網應激和細胞凋亡,最終加重足細胞損傷。由于lncRNA 153已被證明與PARP1結合并調節下游基因,因此研究團隊假設lncRNA可能充當PARP1和ATF3之間的連接分子。數據顯示,lncRNA 153的過表達降低了與ATF3結合的PARP1蛋白的水平,并抑制了由PARP1介導的ATF3的PAR化。同時,PARP1和ATF3的過表達顯著增強了GRP78啟動子與ATF3之間的相互作用,這種作用被lncRNA 153的異位表達所抵消。此外,LncRNA 153可以逆轉由PARP1/ATF3軸介導的足細胞內質網應激、凋亡和損傷。這些結果表明lncRNA153在PARP1和ATF3的相互作用中可發揮重要作用,影響下游基因的表達。
研究人員進一步證實PARP1可與ATF3發生相互作用并介導其PAR化修飾,該修飾能激活ATF3的轉錄活性,激活的ATF3會通過結合GRP78等內質網應激相關基因的啟動子促進其轉錄,進而誘發足細胞內質網應激和細胞凋亡,最終加重足細胞損傷。由于lncRNA 153已被證明與PARP1結合并調節下游基因,因此研究團隊假設lncRNA可能充當PARP1和ATF3之間的連接分子。數據顯示,lncRNA 153的過表達降低了與ATF3結合的PARP1蛋白的水平,并抑制了由PARP1介導的ATF3的PAR化。同時,PARP1和ATF3的過表達顯著增強了GRP78啟動子與ATF3之間的相互作用,這種作用被lncRNA 153的異位表達所抵消。此外,LncRNA 153可以逆轉由PARP1/ATF3軸介導的足細胞內質網應激、凋亡和損傷。這些結果表明lncRNA153在PARP1和ATF3的相互作用中可發揮重要作用,影響下游基因的表達。
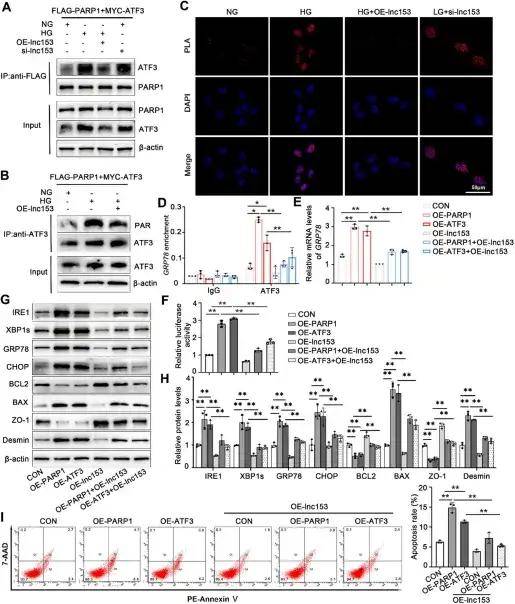
LncRNA 153通過調節PARP1和ATF3之間的互作參與HG誘導的足細胞損傷
研究結論
本研究證實了糖尿病腎病會降低足細胞中lncRNA 153的表達并增加PARP1的表達。LncRNA 153直接與PARP1結合,破壞其與ATF3的相互作用,并抑制ATF3的多聚ADP 核糖化修飾及其活性,從而減輕內質網應激和細胞凋亡,緩解DKD中的足細胞損傷。因此,過表達lncRNA 153或阻斷PARP1–ATF3相互作用可能成為DKD的潛在治療策略。
本研究證實了糖尿病腎病會降低足細胞中lncRNA 153的表達并增加PARP1的表達。LncRNA 153直接與PARP1結合,破壞其與ATF3的相互作用,并抑制ATF3的多聚ADP 核糖化修飾及其活性,從而減輕內質網應激和細胞凋亡,緩解DKD中的足細胞損傷。因此,過表達lncRNA 153或阻斷PARP1–ATF3相互作用可能成為DKD的潛在治療策略。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






