文獻速遞:頂刊CNS神經領域研究新進展10月(下)
小編匯總了2025年10月下旬在Nature、Science、Cell 三大國際頂刊上發表的神經科學領域的研究論文,歡迎閱覽!
想要獲取原文的老師同學們,可以拉到文末,掃碼添加禮智小客服為好友哦!
- "Kiss-shrink-run"機制統一突觸小泡胞吐與超快速循環過程
- 光化學切片技術實現納米級分辨率的中尺度三維熒光成像
- 頭方向細胞作為蝙蝠在遠洋島嶼戶外導航的神經羅盤
- 熊蜂群體中存在積極情緒傳染現象
- 樹鼩視覺形態處理中的壓縮層次結構
- 人類杏仁核活動速率與噪聲驅動厭惡學習中的探索行為增強
- 異源性小膠質細胞移植實現治療性基因功能恢復
- Hex–GM2–MGL2通路介導小膠質細胞-神經元互作維持腦穩態
- 成纖維細胞-免疫細胞動態互作塑造腦損傷后修復進程
- CRISPR激活技術治療SCN2A相關神經發育障礙
1、"Kiss-shrink-run"機制統一突觸小泡胞吐與超快速循環過程

2025年10月16日,中國科學技術大學/中國科學院深圳先進技術研究院腦認知與腦疾病研究所/深港腦科學創新研究院畢國強、劉北明、陶長路團隊,聯合美國加州大學洛杉磯分校周正洪團隊、南方科技大學王培毅團隊、深圳先進院孫堅原團隊在Science期刊上發表了題名為“”Kiss-shrink-run” unifies mechanisms for synaptic vesicle exocytosis and hyperfast recycling”的研究論文,研究通過開發毫秒級時間分辨冷凍電鏡技術,首次系統揭示了海馬體突觸中小型突觸囊泡(~29 nm與~41 nm)的七種狀態轉化路徑。
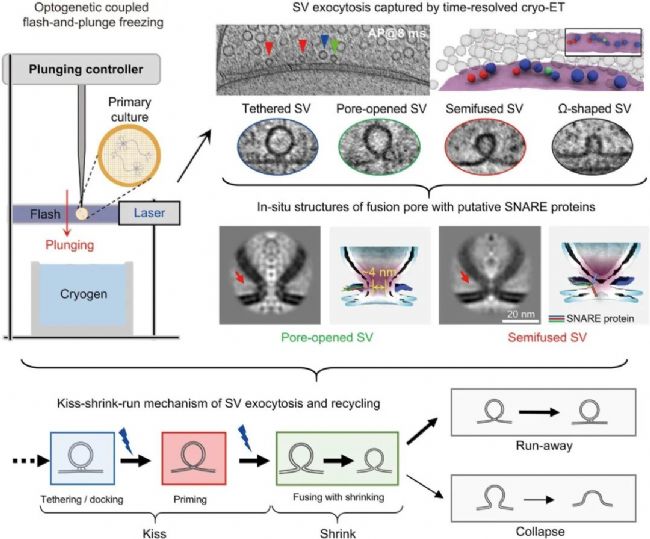
研究發現在動作電位觸發后,大型囊泡經歷“拴留-半融合-開孔(tethered, semifused, pore-opened)”的“Kiss”階段,隨后通過約4納米脂質融合孔快速收縮為小型囊泡。約70毫秒時,收縮囊泡通過“run”實現快速回收,或完全塌陷融入突觸前膜。
該“Kiss-shrink-run”機制統一了“kiss-and-run”與“full-collapse”理論模型,闡明了突觸傳遞高效性的結構基礎,并為原位研究膜動力學建立了新型方法學框架。
DOI:10.1126/science.ads7954
2、光化學切片技術實現納米級分辨率的中尺度三維熒光成像


該技術通過光敏水凝膠嵌入樣本,利用紫外激發實現非接觸式光化學切片,結合晶格光片顯微鏡進行迭代成像,在完整小鼠嗅球中實現了納米級分辨率的中尺度三維成像。研究重建了有髓/無髓軸突網絡,量化了軸突密度與髓鞘分布,并在神經退行性嗅球中發現向心性軸突變性模式。
VIPS技術規避了機械切片導致的樣本損傷,兼容多種水凝膠透明化與擴增方法,支持自動化連續采集,為超大樣本的跨尺度研究提供了技術支撐。當前挑戰主要集中于標記深度、海量數據處理與人工智能解析等方面。
DOI: 10.1126/science.adr9109
3、頭方向細胞作為蝙蝠在遠洋島嶼戶外導航的神經羅盤

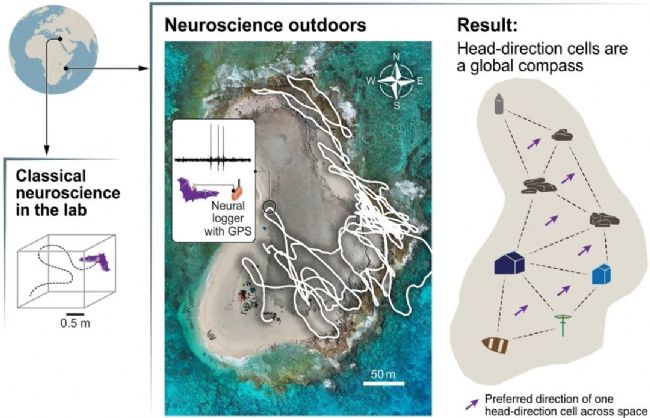
通過在坦桑尼亞桑給巴爾島對自由飛行的埃及果蝠進行無線神經記錄,發現頭方向細胞在廣闊地理范圍內保持穩定的方向調諧,支持“全局羅盤假說”而非“局部拼接假說”。研究證實這種神經羅盤不依賴天體(月亮/星辰)線索或地磁場,其方向編碼在數夜間逐漸穩定,表明環境空間學習的重要性。
該研究突破了實驗室環境的局限,論證了頭方向細胞在真實世界導航中作為可靠神經羅盤的功能,推動了自然生態環境下的神經科學研究范式轉型。
DOI:10.1126/science.adw6202
4、熊蜂群體中存在積極情緒傳染現象

2025年10月23日,南方醫科大學彭飛教授團隊在Science期刊上發表了題名為“Positive affective contagion in bumble bees”的研究論文,本研究首次在社會性昆蟲熊蜂中證實了積極情緒傳染現象。

通過認知偏差實驗發現,接觸處于積極情緒同伴的熊蜂在面對模棱兩可的彩色花朵時,比對照組更快更傾向于降落,表現出積極的判斷偏差轉移。進一步實驗證實這種情緒傳遞無需身體接觸,僅通過視覺模態即可實現。
該發現表明情緒傳染作為共情的核心組成部分,不僅存在于社會性脊椎動物,也存在于社會性昆蟲中,提示這可能是進化過程中廣泛存在的機制,為共情行為的演化起源提供了新見解。
DOI:10.1126/science.adr0216
5、樹鼩視覺形態處理中的壓縮層次結構

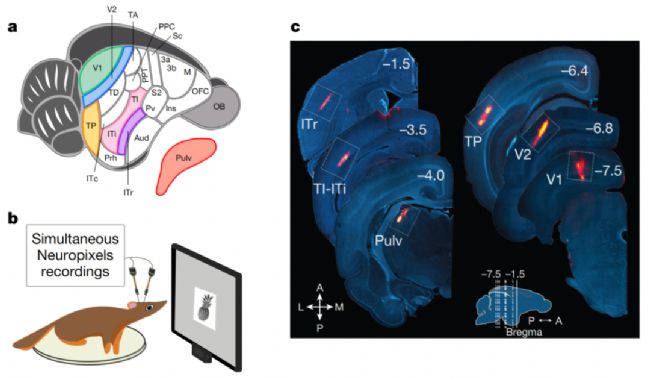
研究發現樹鼩視覺系統具有與靈長類相似的層級結構:感受野尺寸、反應潛伏期及對自然紋理的選擇性均沿視覺通路前向遞增。然而,樹鼩V2區已具備高級物體表征能力——不僅完整編碼高維物體特征空間,其物體解碼與重建精度甚至超越獼猴V2區,與獼猴后顳葉皮層相當,并存在類似獼猴顳葉面部選擇性細胞。
研究表明,靈長類視覺形態處理的核心計算原理在樹鼩中得以保留,但層級結構更為壓縮,揭示了視覺系統演化過程中的保守性與適應性變異。
DOI:10.1038/s41586-025-09441-w
6、人類杏仁核活動速率與噪聲驅動厭惡學習中的探索行為增強

2025年8月27日,以色列學者在Nature期刊上發表了題名為“Rate and noise in human amygdala drive increased exploration in aversive learning”的研究論文,研究通過記錄人類杏仁核單神經元活動,揭示了在損益情境下探索行為的雙重神經機制。

研究發現杏仁核與顳葉皮層神經元在探索決策前均出現活動調制,其中神經元放電速率變化與情境效價無關,而杏仁核整體噪聲水平增加會特異性驅動損失情境下的過度探索行為。這種神經噪聲機制解釋了為何人類在規避損失時表現出更強的探索傾向,為理解情緒障礙中杏仁核亢進與異常探索行為(如強迫癥、焦慮癥)的關聯提供了神經依據,表明病理性探索可能源于效價依賴的神經噪聲信號失調。
DOI:10.1038/s41586-025-09466-1
7、異源性小膠質細胞移植實現治療性基因功能恢復

2025年8月6日,美國學者在Natue期刊上發表了題名為“Therapeutic genetic restoration through allogeneic brain microglia replacement”的研究論文,研究開發了一種無需清髓預處理的同種異體小膠質細胞高效替換療法。
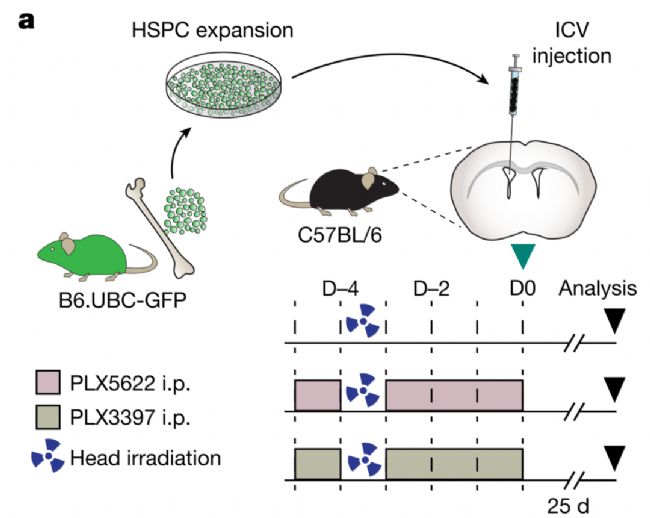
研究發現腦內注射Sca1⁻定向祖細胞即可高效替換宿主小膠質細胞,據此開發了腦部限定預處理方案,避免外周植入及移植物抗宿主病風險。在Sandhoff病(己糖胺酶B缺乏癥)小鼠模型中,該方法成功挽救疾病表型。研究進一步證實人胚胎干細胞來源的髓系祖細胞具有類似植入潛力,突破了傳統造血干細胞移植需全身清髓的限制,為治療腦部遺傳疾病開辟了新型同種異體細胞治療路徑。
DOI:10.1038/s41586-025-09461-6
8、Hex–GM2–MGL2通路介導小膠質細胞-神經元互作維持腦穩態

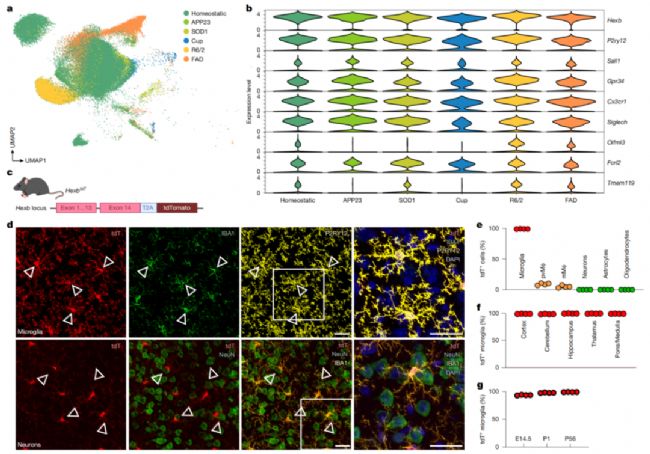
研究首次發現,用外周來源的類小膠質細胞替換病變細胞可打破這一惡性循環,完全恢復中樞神經系統穩態。該發現不僅揭示了以GM2代謝為核心的雙向細胞通訊機制,還為相關神經退行性疾病提供了治療新策略。
DOI:10.1038/s41586-025-09477-y
9、成纖維細胞-免疫細胞動態互作塑造腦損傷后修復進程

2025年9月3日,美國、澳大利亞以及法國的學者在Nature期刊上聯合發表了題名為“Dynamic fibroblast–immune interactions shape recovery after brain injury”的研究論文,研究系統闡明了腦損傷后成纖維細胞與免疫細胞的動態互作機制。

研究發現,早期促纖維化肌成纖維細胞由預存腦成纖維細胞分化,在TGFβ信號、巨噬細胞/小膠質細胞及病灶周圍膠質細胞協同下浸潤損傷區域。這些細胞后期轉化為淋巴細胞互作型成纖維細胞等多個狀態。阻斷早期肌成纖維分化會加劇急性腦損傷和組織缺損,而破壞晚期淋巴細胞-成纖維細胞生態位(通過敲除成纖維細胞趨化因子CXCL12)則引發特異性腦內先天免疫炎癥及淋巴細胞分散伴IFNγ升高。結果表明,時空調控的成纖維細胞狀態演變協調了腦損傷修復進程,有效限制組織損失與慢性神經炎癥。
DOI:10.1038/s41586-025-09449-2
10、CRISPR激活技術治療SCN2A相關神經發育障礙

2025年9月17日,美國以及英國學者在Nature期刊上聯合發表了題名為“CRISPR activation for SCN2A-related neurodevelopmental disorders”的研究論文,研究利用CRISPR激活技術治療SCN2A單倍體不足相關神經發育障礙。

在Scn2a單倍體不足小鼠模型中,青春期通過AAV遞送CRISPRa系統可有效上調功能基因拷貝表達,挽救新皮質錐體細胞的固有電生理特性與突觸功能缺陷,并顯著提升化學誘導癲癇的抗性。研究同時證實該療法可糾正人干細胞來源SCN2A單倍體不足神經元的興奮性異常。結果表明,即使在青春期進行干預,CRISPRa仍能有效改善神經發育表型,為單倍體不足相關疾病提供了新型治療策略。
DOI:10.1038/s41586-025-09522-w






