負載BMSC源性凋亡囊泡的纖維支架通過誘導巨噬細胞極化促進傷口愈合

近日,重慶醫科大學附屬第一醫院胡寧、秦磊磊與重慶醫科大學袁擁華在皮膚創傷修復與再生醫學領域取得了新進展,相關研究成果已經發表在國際權威期刊《Genes & diseases》(IF=9.4、Q1期刊)上。
皮膚是人體最大的器官,也是抵御外界傷害的第一道屏障。當皮膚受損后,機體需要啟動一系列精密調控的修復過程,其中巨噬細胞扮演著至關重要的角色。這類免疫細胞具有高度的可塑性,能在不同微環境信號下分化為促炎的M1表型或抗炎修復的M2表型。在正常的傷口愈合過程中,巨噬細胞會從早期的促炎狀態逐步轉變為后期的抗炎修復狀態,從而協調炎癥消退、血管新生與組織重建。然而,若這一極化過程發生障礙,傷口極易陷入持續炎癥狀態,導致愈合延遲甚至形成慢性創面。因此,如何有效調控巨噬細胞向修復型M2極化,成為促進傷口愈合的關鍵策略。
近年來,間充質干細胞因其強大的旁分泌與免疫調節能力,在組織修復領域備受關注。其釋放的細胞外囊泡,尤其是凋亡過程中產生的凋亡小體,被發現能夠高效遞送生物活性分子,并調控受體細胞的功能。前期研究表明,凋亡小體可被巨噬細胞識別與攝取,并促進其向M2表型轉化,但具體的作用機制尚不明確。同時,如何在傷口局部實現凋亡小體的持續釋放與靶向遞送,也是轉化應用中的一大挑戰。
基于此,本研究成功構建了一種負載骨髓間充質干細胞來源凋亡小體(BMSC-ABs)的聚己內酯纖維支架,并系統闡明了其通過調控巨噬細胞極化促進傷口愈合的作用機制。研究發現,該支架能通過靜電紡絲技術實現凋亡小體的局部緩釋,并借助其中富含的微小核糖核酸miR-21a-5p,靶向抑制巨噬細胞中的CCL-1基因表達,從而驅動M0型巨噬細胞向修復型M2表型轉化。轉化后的M2巨噬細胞不僅分泌抗炎因子如IL-10與TGF-β,有效緩解傷口局部炎癥反應,還能上調血管內皮生長因子等促血管生成因子的表達,協同促進膠原沉積與新生血管形成。在動物模型中,該支架顯著加速了全層皮膚缺損的愈合進程,表現出良好的生物相容性與治療安全性。
該研究首次揭示了凋亡小體通過miR-21a-5p/CCL-1軸調控巨噬細胞極化的分子通路,并開發了一種兼具緩釋與協同作用的新型復合材料,為慢性傷口、免疫失衡相關疾病的治療提供了重要的實驗依據與策略參考。
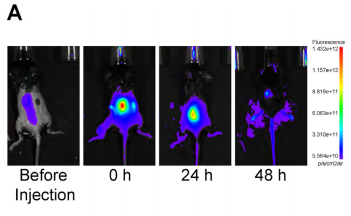
文章中,研究團隊利用廣州博鷺騰的AniView多模式動物活體成像系統觀察了BMSC-ABs在小鼠創傷部位及周邊組織的動態分布與留存時間。實驗結果顯示,經 Cy7-NHS標記的BMSC-ABs在小鼠創傷部位的熒光信號于創傷后 2 天內仍能清晰檢測到,之后隨時間推移逐漸減弱,到注射后 2 天時信號強度降至初始值的 10% 以下,這表明局部注射的 BMSC-ABs 能在創傷區域有效留存足夠長時間。

https://doi.org/10.1016/j.gendis.2024.101388
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






