研究成果:USP2抑制釋放CD47抑制的吞噬作用,增強抗腫瘤免疫
文獻(xiàn)信息
湖北省腫瘤生物學(xué)行為重點實驗室,湖北省腫瘤生物學(xué)行為重點實驗室,武漢大學(xué)中南醫(yī)院放射與醫(yī)學(xué)腫瘤科,醫(yī)學(xué)研究院,免疫與代謝前沿科學(xué)中心等團(tuán)隊的研究成果“USP2 inhibition unleashes CD47-restrained phagocytosis and enhances anti-tumor immunity”(抑制USP2解除CD47介導(dǎo)的吞噬抑制作用,并增強抗腫瘤免疫)在學(xué)術(shù)期刊《Nature Communications》(IF:14.7)上發(fā)表。平生公司的離活一體CT(NEMO)在論文中提供了小鼠肺部腫瘤圖像和定量分析結(jié)果。
該論文的通訊作者為張金方教授,第一作者為代盼盼老師。

文獻(xiàn)摘要
CD47/SIRPα軸傳遞“不要吃我”的信號,從而阻礙腫瘤細(xì)胞的吞噬清除。盡管靶向CD47的阻斷抗體在臨床前模型中顯示出有希望的抗腫瘤效果,但涉及人類癌癥患者的臨床試驗尚未產(chǎn)生理想的結(jié)果。探索CD47的調(diào)控機制對于設(shè)計更有效的組合療法至關(guān)重要。在這里,作者報告說,抑制USP2會促進(jìn)CD47降解并重塑腫瘤微環(huán)境(TME),從而增強抗PD-1免疫治療。從機制上講,USP2與CD47相互作用,通過去泛素化修飾使其蛋白穩(wěn)定。抑制USP2會破壞CD47的穩(wěn)定性,從而增強巨噬細(xì)胞的吞噬作用。單細(xì)胞RNA測序顯示抑制USP2重編程TME,具體表現(xiàn)為抑制USP2增加M1巨噬細(xì)胞和CD8+T細(xì)胞的浸潤,同時減少M2巨噬細(xì)胞的浸潤。將ML364與抗PD-1抗體聯(lián)合使用可減輕小鼠模型中的腫瘤負(fù)擔(dān)。在臨床水平上,USP2低表達(dá)預(yù)示著對抗PD-1治療的更好反應(yīng)。作者的發(fā)現(xiàn)揭示了USP2對CD47的調(diào)控機制,靶向這一信號軸可以增強抗腫瘤免疫。
實驗方法
對于原發(fā)肺腫瘤模型,KrasLSL-G12D/+;使用Trp53fl/fl(KP)和KrasLSL-G12D/+Trp53fl/fl Usp2−/−(KPU)小鼠。KPU小鼠是通過將KP小鼠與Usp2−/-小鼠交配而產(chǎn)生的。為了誘導(dǎo)肺部腫瘤發(fā)生,用1%戊巴比妥鈉麻醉7周齡的KP和KPU小鼠,并在每只小鼠鼻內(nèi)滴注50μl PBS(含有2×106pfu腺病毒Cre)。誘導(dǎo)5周后,進(jìn)行治療。在圖7a中,KP小鼠被合并并隨機分為對照組、ML364組、抗PD-1單克隆抗體組和聯(lián)合治療組。KP小鼠每三天腹腔注射抗PD-1單克隆抗體(每只小鼠100μg),共7次治療,或每天注射ML364(5mg/kg小鼠體重),共21次治療。在圖7e中,KP和KPU小鼠分別分為對照組和抗PD-1單克隆抗體治療組。KP或KPU小鼠每三天通過腹腔注射抗PD-1單克隆抗體(每只小鼠100μg)給藥,共7次治療。治療21天后,分離KP和KPU小鼠的全肺進(jìn)行H&E染色和分析。
應(yīng)用小型動物微型CT掃描儀(NEMO®Micro-CT,平生醫(yī)療科技有限公司)掃描不同治療組的小鼠,進(jìn)行活體成像,以顯示肺部病變。簡而言之,使用2%-3%的異氟烷對動物進(jìn)行麻醉,將其放置在恒溫控制的CT床上,并通過鼻錐輸送1%-1.5%的異氟烷,使其保持麻醉狀態(tài)。小鼠處于仰臥位,使用Cruiser掃描軟件(平生醫(yī)療科技有限公司)執(zhí)行標(biāo)準(zhǔn)CT掃描協(xié)議。同時,使用呼吸門控墊片監(jiān)測小鼠的實時呼吸頻率,每只小鼠的總掃描時間約為10分鐘。CT掃描完成后,根據(jù)制造商的說明,按照Avatar分析軟件(平生醫(yī)療科技有限公司)程序?qū)?shù)據(jù)集進(jìn)行重建和成像。根據(jù)儀器制造商的指南,在Avatar程序中進(jìn)行了整個肺的3D重建和重建肺的體積計算。
實驗結(jié)果
為了進(jìn)一步研究USP2抑制在體內(nèi)調(diào)節(jié)抗PD-1免疫治療中的作用,作者使用了基因工程的KrasLSL-G12D/+;Trp53fl/fl(KP)小鼠腫瘤模型,在鼻內(nèi)滴注表達(dá)Cre重組酶的腺病毒(Ad-Cre),誘導(dǎo)其形成原位肺腫瘤。攜帶肺腫瘤的KP小鼠接受ML364單藥,抗PD-1單克隆抗體單藥或聯(lián)合腹腔注射治療(圖7a)。與同基因小鼠LLC腫瘤模型的結(jié)果一致(圖4),與ML364或抗PD-1抗體單一療法相比,聯(lián)合治療顯著抑制了KP小鼠的腫瘤發(fā)展,具體表現(xiàn)為腫瘤面積的減小和腫瘤面積占全肺面積比例的減小(圖7b-d)。
接下來,作者在KP小鼠中基因敲除了Usp2,并探討了Usp2缺乏對肺癌進(jìn)展和免疫療法反應(yīng)的影響。為此,通過KP小鼠交配Usp2−/−小鼠產(chǎn)生KPU小鼠(補充圖9a-d)。用抗PD-1抗體或?qū)φ誌gG治療攜帶Ad-Cre誘導(dǎo)肺腫瘤的KP和KPU小鼠(圖7e)。然后,作者對小鼠進(jìn)行了CT掃描活體成像,展示小鼠肺部病變,同時對不同治療組的小鼠全肺進(jìn)行了3D重建。隨著腫瘤侵襲鄰近正常肺組織,肺實質(zhì)結(jié)構(gòu)完整性逐漸喪失,其肺缺損體積隨腫瘤進(jìn)展呈進(jìn)行性增大。因此,重建的健康肺間質(zhì)的體積被用作自發(fā)肺癌進(jìn)展的替代標(biāo)志物。全肺體積定量顯示,與其余處理組相比,KPU聯(lián)合PD-1單克隆抗體治療組的殘余肺體積明顯更大,腫瘤進(jìn)展明顯減緩(圖7f,g)。值得注意的是,肺部的H&E染色顯示,與其他治療組小鼠相比,經(jīng)過PD-1抗體治療的KPU小鼠顯著延緩了肺部腫瘤發(fā)展(圖7h-j)。總之,這些結(jié)果表明,在KP肺癌模型中,通過其小分子抑制劑ML364或基因缺失抑制USP2使肺腫瘤對抗PD-1抗體免疫療法更敏感。
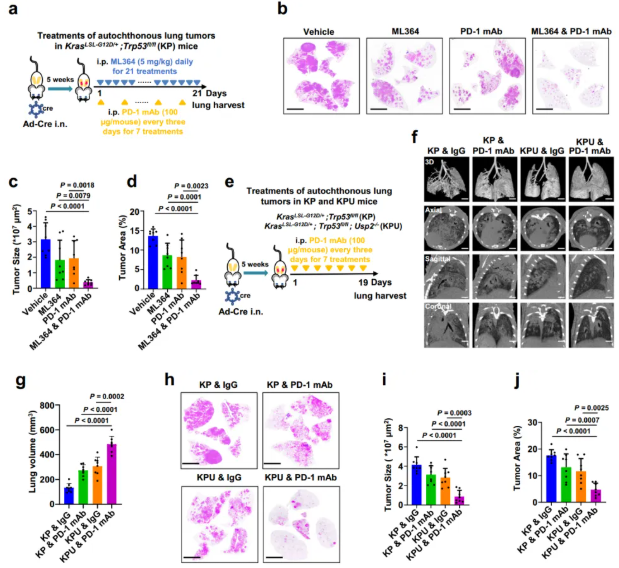 圖7|ML364或基因缺失抑制USP2克服了KrasLSL-G12D/+ Trp53fl/fl(KP)小鼠對抗PD-1抗體免疫療法的耐藥性。a KP鼠原發(fā)性肺腫瘤的治療方案示意圖。KP小鼠經(jīng)鼻注射Ad-Cre,劑量為2×106pfu/只。誘導(dǎo)后五周,分別用ML364(5mg/kg)、抗PD-1單克隆抗體(每只小鼠100μg)或聯(lián)合治療對小鼠進(jìn)行治療。b-d不同處理組小鼠肺組織的代表性H&E染色圖像(b),通過測量所有肺腫瘤的橫截面積來量化腫瘤大小(c),并根據(jù)每只KP小鼠的三個非連續(xù)切片計算腫瘤面積占全肺面積的比例(%)(d)。e KP和KPU小鼠原發(fā)性肺腫瘤的治療示意圖。KP和KPU小鼠經(jīng)鼻注射Ad-Cre,劑量為2×106pfu/只。誘導(dǎo)五周后,按照指示用對照載體或抗PD-1單克隆抗體(每只小鼠100μg)治療小鼠。f 不同治療組KP和KPU小鼠的活體掃描肺部成像。Micro-CT掃描的三維圖像顯示肺部呈現(xiàn)灰色。g通過Avatar軟件的3D重建,使用算法提取每組小鼠的健康肺體積進(jìn)行量化。h–j不同處理組小鼠H&E染色肺組織的代表性圖像(h),通過測量所有腫瘤的橫截面積來量化腫瘤大小(i),并根據(jù)每只KP或KPU小鼠的三個非連續(xù)切片計算腫瘤面積占全肺面積的比例(%)(j)。
圖7|ML364或基因缺失抑制USP2克服了KrasLSL-G12D/+ Trp53fl/fl(KP)小鼠對抗PD-1抗體免疫療法的耐藥性。a KP鼠原發(fā)性肺腫瘤的治療方案示意圖。KP小鼠經(jīng)鼻注射Ad-Cre,劑量為2×106pfu/只。誘導(dǎo)后五周,分別用ML364(5mg/kg)、抗PD-1單克隆抗體(每只小鼠100μg)或聯(lián)合治療對小鼠進(jìn)行治療。b-d不同處理組小鼠肺組織的代表性H&E染色圖像(b),通過測量所有肺腫瘤的橫截面積來量化腫瘤大小(c),并根據(jù)每只KP小鼠的三個非連續(xù)切片計算腫瘤面積占全肺面積的比例(%)(d)。e KP和KPU小鼠原發(fā)性肺腫瘤的治療示意圖。KP和KPU小鼠經(jīng)鼻注射Ad-Cre,劑量為2×106pfu/只。誘導(dǎo)五周后,按照指示用對照載體或抗PD-1單克隆抗體(每只小鼠100μg)治療小鼠。f 不同治療組KP和KPU小鼠的活體掃描肺部成像。Micro-CT掃描的三維圖像顯示肺部呈現(xiàn)灰色。g通過Avatar軟件的3D重建,使用算法提取每組小鼠的健康肺體積進(jìn)行量化。h–j不同處理組小鼠H&E染色肺組織的代表性圖像(h),通過測量所有腫瘤的橫截面積來量化腫瘤大小(i),并根據(jù)每只KP或KPU小鼠的三個非連續(xù)切片計算腫瘤面積占全肺面積的比例(%)(j)。
使用結(jié)論
先前的研究表明,USP2對多種癌癥的腫瘤發(fā)生和轉(zhuǎn)移有促進(jìn)作用,這表明靶向USP2可能是人類癌癥的一種潛在治療策略。此外,Usp2 KO小鼠是不影響小鼠穩(wěn)態(tài)的,并且用Usp2抑制劑ML364治療小鼠沒有顯示出明顯的毒性跡象,這進(jìn)一步支持了USP2可能是癌癥治療的理想靶點的觀點。值得注意的是,在多個臨床前肺癌模型中,USP2抑制劑與抗PD-1抗體聯(lián)合治療顯著抑制肺腫瘤生長(圖4和圖7)。此外,安全性評估表明,聯(lián)合治療不會引起明顯的血液和器官系統(tǒng)毒性。這些結(jié)果與最近的文章報道結(jié)果是一致的,在同基因小鼠乳腺腫瘤模型中,USP2抑制使腫瘤對PD-1阻斷抗體更敏感,而沒有明顯的毒性,這一抗腫瘤作用主要是通過USP2-VPRBP間接上調(diào)p53和PD-L1水平來實現(xiàn)的。p53通路的激活和USP2抑制介導(dǎo)的PD-L1表達(dá)的上調(diào)也有助于形成炎癥性TME,這與作者的主要結(jié)論一致。結(jié)合作者發(fā)現(xiàn)的去泛素化酶USP2調(diào)節(jié)CD47蛋白穩(wěn)定性和腫瘤免疫微環(huán)境,這些研究為USP2抑制劑與PD-1/PD-L1阻斷抗體聯(lián)合治療改善腫瘤治療效果提供了充分的分子基礎(chǔ)。
使用設(shè)備

Micro CT (型號:NEMO) (平生醫(yī)療科技)
影像軟件:Avatar(平生醫(yī)療科技)
- LASER系列活體成像系統(tǒng)助力軟棗獼猴桃花青素調(diào)控機制解析
- 熱點速遞:近紅外納米探針合成技術(shù)顯著提升其近紅外發(fā)光強度與穩(wěn)定性
- 負(fù)載BMSC源性凋亡囊泡的纖維支架通過誘導(dǎo)巨噬細(xì)胞極化促進(jìn)傷口愈合
- 具有半乳糖靶向的NIR-II納米探針實現(xiàn)原位肝癌手術(shù)切緣及深度精準(zhǔn)成像
- 論文解讀:功能超聲成像(fUS)用于超早期卒中階段監(jiān)測的研究案例
- 文獻(xiàn)速遞:頂刊CNS神經(jīng)領(lǐng)域研究新進(jìn)展11月(下)
- 利用1880-2080納米窗口進(jìn)行高對比度活體熒光成像的新方法
- 供體平面性誘導(dǎo)分子扭曲構(gòu)建D-A-D型AIE實現(xiàn)高效NIR-II熒光與光熱治療
- Iconeus與法國醫(yī)學(xué)物理研究所榮獲突破性創(chuàng)新獎
- 博鷺騰閃耀亮相美國實驗動物科學(xué)協(xié)會AALAS全國會議
- 耀速科技與瑞孚迪達(dá)成戰(zhàn)略合作,共推藥物研發(fā)創(chuàng)新
- 勤翔IVScope動物活體成像助力開發(fā)mRNA-LNP系統(tǒng)
- 博鷺騰與UCLA CRUMP分子影像研究所設(shè)立活體影像中心
- 開幕在即,ICONEUS等即將亮相美國神經(jīng)科學(xué)學(xué)會年會
- 勤翔將攜活體成像等參展第十七屆全國免疫學(xué)學(xué)術(shù)大會
- ICONEUS與您相約美國神經(jīng)科學(xué)學(xué)會年會SfN2025






