REPS2通過自噬介導的β-catenin蛋白的降解抑制腫瘤細胞的干性
文獻信息
暨南大學生命科學與技術(shù)學院生命與健康工程研究所廣東省高校功能蛋白研究重點實驗室和教育部腫瘤分子生物學重點實驗室等單位的研究成果“REPS2 attenuates cancer stemness through inhibiting Wnt signaling by autophagy mediated degradation of β-catenin(REPS2通過自噬介導的β-catenin蛋白的降解來抑制Wnt信號通路從而抑制腫瘤細胞的干性)在雜志《Oncogene》(IF:7.3)上發(fā)表。平生公司的活體CT(Super nova)在論文中提供了重要的小鼠肺部腫瘤圖像。
該研究的通訊作者陳良教授,第一作者為劉鷺老師。

文獻背景
調(diào)節(jié)肺癌細胞干性的腫瘤抑癌基因(TSG)仍有待確定。作者利用CRISPR/Cas9介導的全基因組規(guī)模的關(guān)于肺癌干性基因的篩選,并確定REPS2是一種有效的TSG,對肺癌細胞的干性進行負調(diào)控。其抑癌作用在體外和體內(nèi)都得到了證實。從機制上講,P62同時與β-catenin和REPS2相互作用,導致自噬溶酶體介導的β-catenin的降解從而抑制Wnt信號傳導。β-catenin的抑制劑與驅(qū)動突變抑制劑協(xié)同誘導免疫原性細胞死亡,可用于提高腫瘤免疫治療的療效。
實驗方法
動物實驗
對于異種移植瘤模型,在6-8周齡的雌性裸鼠皮下植入2×106個A549細胞系,這些細胞系具有通過CRISPR篩選敲除的前10個候選基因。將小鼠隨機分為幾組,每組三只。4周后,處死小鼠并解剖腫瘤負荷。對于LLC異種移植瘤模型,在6-8周齡的雌性WT小鼠上皮下接種2×106 LLC(Vehicle或OE REPS2)。將小鼠隨機分組,每組4只。腫瘤體積達到100mm3時進行測量。2周后,處死小鼠并解剖腫瘤負荷。
將過表達REPS2(KC+R)或Vehicle的逆轉(zhuǎn)錄病毒通過鼻孔吸入6-8周齡的TetO-KrasG12D/CC10rtTA(指定為KC)雙轉(zhuǎn)基因雌性小鼠的肺部。將小鼠隨機分組,每組4只。所有小鼠均喂食含有Dox的食物3個月。計算機斷層掃描(Super nova CT,平生醫(yī)療科技有限公司)用于量化腫瘤負荷。
將含有Cre和Cas9的慢病毒注入6-8周齡的LSLKRASG12D雌性小鼠的肺部。感染后6個月,通過CT監(jiān)測REPS2基因敲除小鼠(K-sgREPS2小鼠)和TdTomato基因敲除鼠(K-sgTD小鼠作為對照)的腫瘤負荷。對于K-sgREPS2小鼠治療,將小鼠隨機分為幾組,每組4只。用ICG001(腹膜內(nèi)注射,25mg/kg/天)、曲美替尼(強飼,1mg/kg/天)和PD-1抗體(腹膜內(nèi)注入,5mg/kg/天)治療小鼠2周。通過計算機斷層掃描監(jiān)測腫瘤負荷。
實驗結(jié)果
REPS2在體內(nèi)肺癌小鼠模型中是一種有效的腫瘤抑制因子
將REPS2過表達LLC細胞的同種異體移植腫瘤(LLC-REPS2oe)的生長速度明顯慢于對照細胞(圖4A)。此外,作者發(fā)現(xiàn)REPS2的過表達顯著抑制了CD44的表達(圖S4A)。小鼠原位肺癌模型更好地再現(xiàn)了患者腫瘤發(fā)展的臨床過程。前期,作者報道了一種肺癌小鼠模型TetO-KrasG12D;CC10rtTA(指定為KC小鼠),在四環(huán)素飲食誘導(Dox)3個月之后,由KrasG12D驅(qū)動發(fā)展為肺癌。然后,作者通過鼻內(nèi)滴注(指定為KC+R)用含有Teton-REPS2的慢病毒感染這些小鼠。WB分析證實了Dox誘導3個月后KC+R小鼠肺組織中REPS2的表達(圖S4B)。作者發(fā)現(xiàn)REPS2的過度表達顯著抑制了肺癌的形成(圖4B–F)。蘇木精和伊紅(H&E)染色檢查顯示,REPS2的過度表達顯著抑制了KC+R小鼠肺癌的形成(圖4B)。此外,作者發(fā)現(xiàn)REPS2的過表達顯著抑制了對CD44的表達(圖S4C)。相反,按照先前報道的通過CRISPR/Cas9系統(tǒng)在Lsl-KrasG12D轉(zhuǎn)基因小鼠的肺癌小鼠模型中敲除腫瘤抑制基因的程序,作者將靶向Td-tomato(作為陰性對照,K-sgTD)或REPS2(K-sgREPS2)的慢病毒鼻內(nèi)遞送到Lsl-KrasG12D小鼠中。與對照組相比,經(jīng)鼻吸入慢病毒6個月后,作者檢測到REPS2敲除小鼠的腫瘤負荷、腫瘤數(shù)量、最大腫瘤直徑和III期腫瘤數(shù)量顯著增加(圖4G-K)。此外,作者通過免疫組織化學檢測到REPS2敲除的腫瘤中CD44的表達顯著升高(圖S4D,E)。
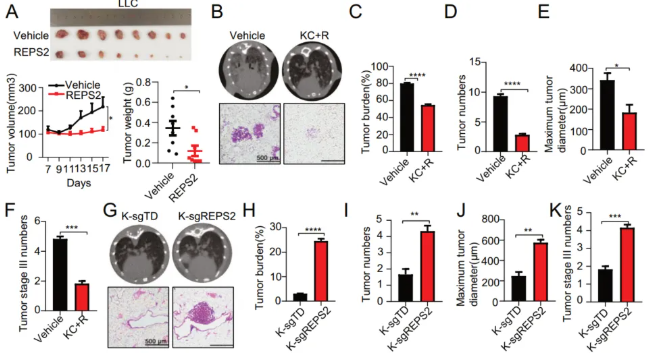 圖4 REPS2在體內(nèi)肺癌小鼠模型中是一種有效的腫瘤抑制因子。A. REPS2過表達對LLC異種移植物腫瘤的影響。腫瘤體積和腫瘤重量統(tǒng)計如下。B.REPS2過表達對轉(zhuǎn)基因小鼠原位肺腫瘤形成的影響。相應(yīng)的HE分析圖像如下所示。C-F.腫瘤負荷、腫瘤數(shù)量、最大腫瘤大小和腫瘤III期數(shù)量的統(tǒng)計數(shù)據(jù)。G.敲除REPS2對Lsl-KrasG12D小鼠腫瘤形成的影響。相應(yīng)的HE分析圖像如下所示。H-K腫瘤負荷、腫瘤數(shù)量、最大腫瘤大小和腫瘤III期數(shù)量的統(tǒng)計數(shù)據(jù)。
圖4 REPS2在體內(nèi)肺癌小鼠模型中是一種有效的腫瘤抑制因子。A. REPS2過表達對LLC異種移植物腫瘤的影響。腫瘤體積和腫瘤重量統(tǒng)計如下。B.REPS2過表達對轉(zhuǎn)基因小鼠原位肺腫瘤形成的影響。相應(yīng)的HE分析圖像如下所示。C-F.腫瘤負荷、腫瘤數(shù)量、最大腫瘤大小和腫瘤III期數(shù)量的統(tǒng)計數(shù)據(jù)。G.敲除REPS2對Lsl-KrasG12D小鼠腫瘤形成的影響。相應(yīng)的HE分析圖像如下所示。H-K腫瘤負荷、腫瘤數(shù)量、最大腫瘤大小和腫瘤III期數(shù)量的統(tǒng)計數(shù)據(jù)。
聯(lián)合抑制WNT/β-catenin通路和MEK增強REPS2缺陷/Kras突變型肺癌免疫治療
作者生成了一批攜帶K-sgREPS2肺癌的小鼠,并用ICG001、曲美替尼和PD-1抗體治療這些小鼠2周。作者發(fā)現(xiàn),與ICG001和曲美替尼的組合相比,ICG001、曲美替尼和PD-1抗體治療顯著抑制了腫瘤生長(圖7E、F)。此外,F(xiàn)ACS分析顯示,聯(lián)合治療顯著增加了腫瘤浸潤CD8+T細胞中TNF-α的表達(圖7G,H)。綜上所述,這些數(shù)據(jù)表明,ICG001、曲美替尼和PD-1抗體的組合有效地抑制了KrasG12D/REPS2-/-肺癌。
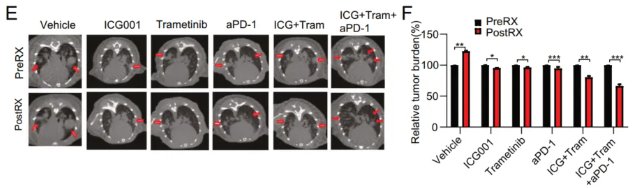 圖7 聯(lián)合抑制WNT/β-catenin通路和MEK增強REPS2缺陷/Kras突變肺癌免疫治療。E .ICG001、曲美替尼和PD-1抗體聯(lián)合治療可有效縮小K-sgREPS2小鼠的肺腫瘤。相關(guān)HE分析如下所示。F.用(E)的聯(lián)合療法治療的小鼠腫瘤負荷的定量。
圖7 聯(lián)合抑制WNT/β-catenin通路和MEK增強REPS2缺陷/Kras突變肺癌免疫治療。E .ICG001、曲美替尼和PD-1抗體聯(lián)合治療可有效縮小K-sgREPS2小鼠的肺腫瘤。相關(guān)HE分析如下所示。F.用(E)的聯(lián)合療法治療的小鼠腫瘤負荷的定量。
文獻結(jié)論
免疫療法改變了當前臨床腫瘤學實踐的范式。不幸的是,大多數(shù)患者未能從免疫療法中受益。典型免疫療法的組合,如PD-1抑制劑和CTLA4抑制劑之間、PD-1和LAG3之間以及PD-1和TIGIT之間,正在臨床試驗中積極測試。免疫療法也與化療和靶向治療相結(jié)合。然而,在上述所有組合中,耐藥性仍然是一個棘手的問題。作者目前的工作為一個研究不足的領(lǐng)域提供了新的思路:通過識別強效TSG的功能喪失并闡明隨之而來的異常信號,研究人員可以識別由這種異常信號產(chǎn)生的藥物靶點。因此,考慮到這些藥物與免疫療法的潛在聯(lián)合,可能會導致治療效果的增強。
使用設(shè)備

Micro CT(型號:Super Nova)(平生醫(yī)療科技)
影像軟件:Avatar(平生醫(yī)療科技)
- LASER系列活體成像系統(tǒng)助力軟棗獼猴桃花青素調(diào)控機制解析
- 熱點速遞:近紅外納米探針合成技術(shù)顯著提升其近紅外發(fā)光強度與穩(wěn)定性
- 負載BMSC源性凋亡囊泡的纖維支架通過誘導巨噬細胞極化促進傷口愈合
- 具有半乳糖靶向的NIR-II納米探針實現(xiàn)原位肝癌手術(shù)切緣及深度精準成像
- 論文解讀:功能超聲成像(fUS)用于超早期卒中階段監(jiān)測的研究案例
- 文獻速遞:頂刊CNS神經(jīng)領(lǐng)域研究新進展11月(下)
- 利用1880-2080納米窗口進行高對比度活體熒光成像的新方法
- 供體平面性誘導分子扭曲構(gòu)建D-A-D型AIE實現(xiàn)高效NIR-II熒光與光熱治療






