Neuron論文解讀:大鼠實驗驗證成癮存在性別差異
“三叔是個煙齡超四十年的老煙槍了,一笑就露出兩排大黃牙,整日煙不離手”
“村里老李是個酒鬼,每餐都要喝上一口,火車上吃泡面都必須整瓶二鍋頭”
“鄰居家的小孩叫阿強,在讀初一,沉溺于網絡游戲無法自拔,鄰居大姐為此一籌莫展”
說起成癮,你腦子里可能會立馬冒出老煙槍三叔、酒鬼老李、網癮少年阿強等一系列男性形象以及為此愁眉苦臉的三嬸、老李媳婦兒、阿強媽媽。在我們的印象中,無論抽煙喝酒吸毒還是賭博打游戲,男性似乎都比女性更容易成癮,這是偏見么,還是真實存在的呢?如果成癮的性別差異真的存在,背后的機制是什么?
2025年5月7日,華盛頓大學Jose A. Moron教授團隊在知名期刊Neuron(IF2024=14.7)發表了題名為“Estradiol protects against pain-facilitated fentanyl use via suppression of opioid-evoked dopamine activity in males”的研究論文。研究團隊通過在大鼠上進行實驗,驗證了成癮確實存在性別差異,而雌激素在這里面發揮著重要作用。

研究亮點
1、無線光纖記錄的長期動態監測
實現了在自由行為動物中長達數周的VTA鈣信號記錄,捕捉到疼痛誘導的多巴胺活動隨時間逐漸增強的動態過程。
2、性別特異性機制的揭示
首次明確炎癥疼痛僅增強雄性而非雌性大鼠的芬太尼使用,并發現其由VTA多巴胺神經元活動增強驅動。
3、激素-疼痛-神經可塑性的三重交互
發現雌二醇(E2)的保護作用依賴于疼痛背景,在疼痛雄性中抑制多巴胺活動,而在無疼痛雌性中反而增強,挑戰了E2單純促進獎賞的傳統觀點。
4、化學遺傳學驗證因果性
過DREADD技術證明VTA多巴胺神經元活動對芬太尼使用的必要性與充分性。
5、臨床轉化潛力
提示雌激素或ERβ激動劑可能作為疼痛患者中預防阿片濫用的潛在治療策略,尤其適用于男性或激素替代治療人群。
CFA炎癥雄鼠比雌鼠更傾向芬太尼上頭
咱們來看看實驗具體是怎么做的。研究團隊以阿片類藥物芬太尼為落腳點來研究成癮。阿片類藥物作為強效鎮痛藥,常用于治療中到重度疼痛。戰場上被炸得手腳橫飛的士兵,軍醫會為他們打上一針嗎啡來鎮痛,嗎啡就是一種阿片類藥物。阿片類藥物雖是鎮痛界扛把子,但代價卻是,患者可能因長期使用而產生生理依賴和耐受性,從而導致阿片成癮。臨床上觀察到,男性比女性更易濫用阿片。
研究團隊模擬臨床,首先建立了疼痛的大鼠模型,并配備了相應的對照組,形成4組不同條件下的大鼠:腳底板注射完全弗式佐劑(CFA)從而產生慢性炎癥疼痛的雄性大鼠(CFA炎癥雄鼠)和雌性大鼠(CFA炎癥雌鼠)以及腳底板注射生理鹽水的對照雄性大鼠(對照熊鼠)和雌性大鼠(對照雌鼠)。
然后給這4組大鼠都接上了一套裝置,訓練它們進行芬太尼自我給藥(self administration,SA,圖1)。裝置具體是這樣的,大鼠前面有兩個按鈕,按其中一個會啟動注射器的開關,通過靜脈留置針向大鼠體內注射100 μL芬太尼,并且伴隨5 s的提示燈亮,按另外一個按鈕不會有任何反應。訓練每天進行2小時,每周5天,持續3周,第1周注射器里芬太尼的濃度為5 μg/kg(根據大鼠的體重配置濃度),第2-3周為2 μg/kg。
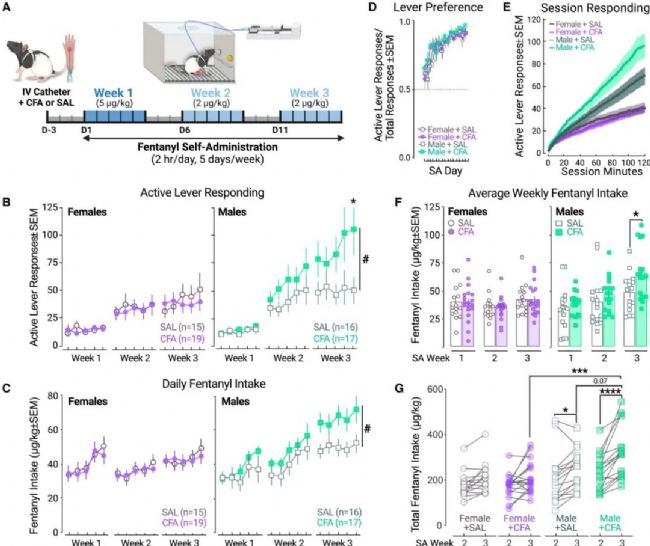
圖 1 炎癥性疼痛選擇性地促進雄性大鼠的芬太尼自我給藥
(A) 行為實驗時間線示意圖。
(B 和 C) CFA或SAL處理后雄性和雌性大鼠的 (B) 有效杠桿反應次數 和 (C) 經體重標準化的芬太尼攝入量。
(D) 有效與無效杠桿的區分(杠桿偏好 = 有效杠桿按壓次數 / 總杠桿按壓次數)。
(E) SA第3周期間平均有效杠桿反應速率。
(F 和 G) CFA或SAL處理后雄性和雌性大鼠 (F) 各SA周的平均芬太尼攝入量 (μg/kg) 以及 (G) SA第2周至第3周(2 μg/kg/次)總芬太尼攝入量的比較。
(F) 和 (G) 中的每個符號代表一個個體。
可以看到,在第1、2周,4組大鼠表現沒有差異,第3周,CFA炎癥雄鼠攝入了比CFA炎癥雌鼠更多的芬太尼。這得到了第一個結論:炎癥疼痛會隨著時間的推移,選擇性促進雄鼠的芬太尼攝入。
芬太尼上頭的性別差異的原因探索
為什么CFA炎癥雄鼠會攝入更多的芬太尼?難道雄鼠相比于雌鼠感受到了更強烈的痛感,或者同劑量的芬太尼在雄鼠中的效果不如雌鼠,所以需要攝入更多量的芬太尼來達到同樣的效果?研究團隊通過實驗排除了這兩個可能性(圖2),并把關注點投向了腹側被蓋區(VTA)的多巴胺(DA)神經元。
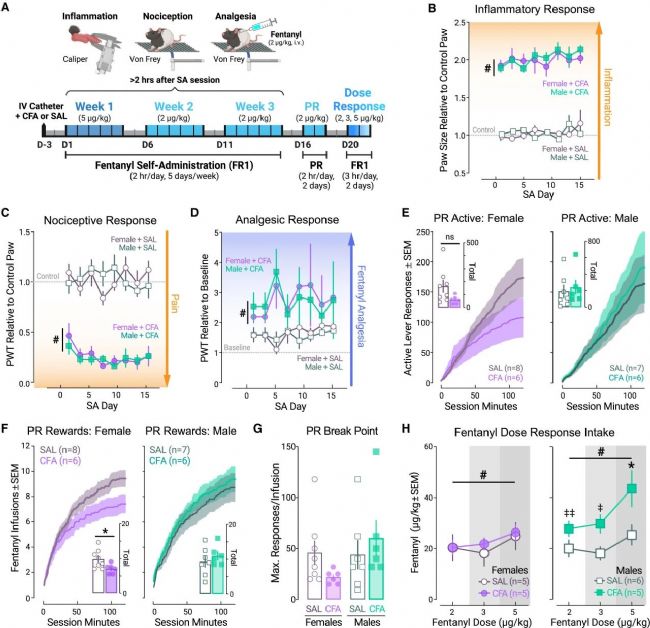
圖 2 CFA在雄性和雌性中產生可比水平的炎癥、傷害性感受和芬太尼鎮痛作用,但增強雄性的劑量反應
(A) 行為方法示意圖。
(B) 芬太尼SA三周期間用測徑器測量的相對爪厚度。
(C) 用電子Von Frey測得的相對爪縮足閾值 (PWT)。
(D) 芬太尼誘導(2 μg/kg, 靜脈注射)的鎮痛作用,通過輸注后相對于輸注前的PWT表示。
(E) 雌性(左)和雄性(右)在PR期間的平均有效杠桿反應次數以及平均總反應次數(插圖)。
(F) PR階段獲得的平均芬太尼輸注次數(獎賞)以及獲得的總獎賞數(插圖)。
(G) 平均PR中斷點,以為了一次輸注所作的最大反應次數表示。
(H) 雌性(左)和雄性(右)在芬太尼劑量反應測試中的平均攝入量。
阿片類藥物能夠刺激VTA的DA釋放,而研究團隊之前的體外研究發現,CFA會對VTA的DA釋放產生抑制作用。因此,阿片類藥物對于CFA后VTA的DA釋放能力改變變得難以預測。有沒有可能CFA對VTA的多巴胺神經元的影響導致了芬太尼使用中的性別差異?研究人員利用創新的無線體內光纖光度記錄技術,實時監測了芬太尼自我給藥過程中VTADA神經元的鈣瞬變活動,以探究疼痛和性別因素對其的影響(圖3A)。
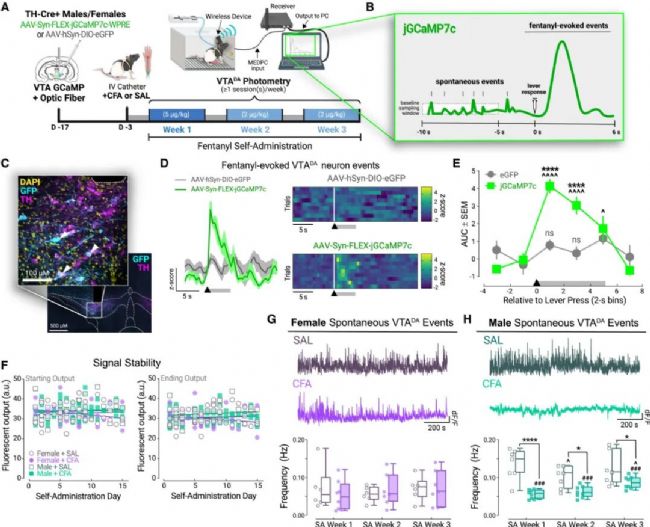
圖 3 芬太尼SA期間的無線體內光纖光度記錄檢測到對VTADA神經元活性的性別和疼痛特異性效應
(A) 實驗方法示意圖。
(B) 自發VTADA事件和與導致芬太尼輸注的杠桿按壓時間鎖定的芬太尼誘發事件的事件檢測。
(C) TH-Cre+大鼠VTA內光纖位置(虛線)和Cre依賴的jGCaMP7c (GFP) 表達與TH(白色箭頭)共定位的代表性圖像。
(D) 表達jGCaMP7c或對照病毒的大鼠中,芬太尼誘發的VTADA神經元熒光的Z值以及單個試驗的熱圖,這些試驗與有效杠桿按壓(黑色箭頭)和芬太尼輸注/線索呈現(灰色條)時間鎖定。比例尺:1 Z值(垂直)和 5秒(水平)。
(E) 表達jGCaMP7c或對照病毒的VTADA神經元中,芬太尼誘發事件以2秒間隔分組的曲線下面積 (AUC)。
(F) SA會話開始或結束時的熒光(任意單位, a.u.)之間的關系。數據點代表單個記錄會話。
(G 和 H) (G) CFA或SAL處理的雌性和 (H) 雄性的自發VTADA鈣瞬變活性代表性軌跡(上圖)和平均每周自發事件率頻率(下圖)。數據點代表來自單個大鼠的每周均值。
結果顯示,CFA炎癥疼痛對VTADA神經元的基礎自發活動產生性別特異的調控:它持續降低了雄性大鼠的自發活動頻率,而對雌性則無影響(圖3G,H)。研究人員成功區分了自發的神經活動與“芬太尼誘發”的活動(由杠桿按壓、線索提示和藥物輸注共同觸發)。芬太尼誘發活動的產生需要杠桿按壓反應 、線索呈現以及同時的芬太尼輸送,這些因素疊加,共同引起了VTADA神經元鈣瞬變活動的急劇增加(圖3B,視頻1、2)。
視頻1 記錄到一次“芬太尼誘發”的活動
視頻2 記錄到另一次“芬太尼誘發”的活動
研究人員進一步探索了SA期間VTADA神經元活動如何受到CFA的影響(圖4)。在芬太尼SA過程中,雌性大鼠的神經反應始終保持穩定,不受疼痛影響。而CFA雄性大鼠初期反應減弱,但隨著用藥時間推移,其芬太尼誘發的多巴胺神經元活動幅度和反應概率逐周顯著增強,在第三周達到最高水平,顯著超過所有其他組。這種神經活動的增強軌跡與CFA雄性大鼠行為上表現出芬太尼攝入量增加的模式完全平行,且神經反應的峰值大小與藥物攝入總量呈強正相關。
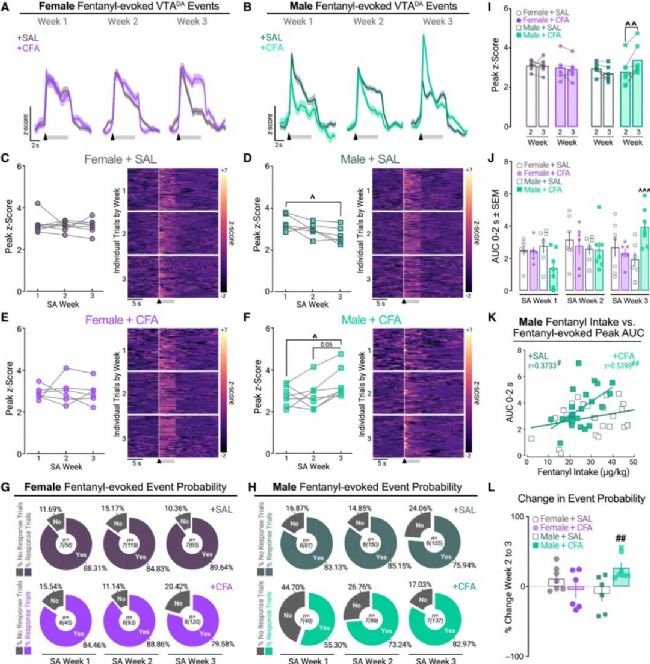
圖 4 疼痛隨時間增加雄性大鼠芬太尼誘發的VTADA神經元事件幅度和概率
(A 和 B) (A) 有疼痛(CFA; n=6)或無疼痛(SAL; n=7)的雌性和 (B) 有疼痛(CFA; n=7)或無疼痛(SAL; n=6)的雄性中,芬太尼誘發的VTADA事件 (Z值 ± SEM),與SA每周的有效杠桿反應(黑色箭頭)和芬太尼輸注(灰色條)對齊。比例尺:1 Z值(垂直)和 2秒(水平)。
(C–H) 各SA周的事件峰值Z值以及顯示單個試驗的熱圖,這些試驗與導致輸注/線索傳遞的杠桿按壓對齊,分別對應 (C) 無疼痛雌性、(D) 無疼痛雄性、(E) 有疼痛雌性 和 (F) 有疼痛雄性。(G) SAL或CFA處理后雌性和 (H) SAL或CFA處理后雄性中,每次芬太尼杠桿按壓引發可檢測峰值的概率。
(I) SA第2周和第3周之間的峰值Z值。
(J) SA每周的VTADA活性AUC。每個數據點代表單個大鼠/SA周的均值。
(K) SAL和CFA處理后雄性中,平均芬太尼誘發VTADA AUC與SA期間芬太尼攝入量之間的關聯。
(L) SA第2周至第3周VTADA峰值概率的百分比變化。
增強的VTADA神經元活動促使芬太尼上頭
為確定高強度VTA多巴胺神經元活動是否為CFA雄性大鼠增加芬太尼使用所必需,研究人員在SA第三周采用化學遺傳學方法抑制VTADA神經元,并檢測其對芬太尼誘發的VTADA活動及芬太尼攝入量的影響(圖5)。實驗發現,使用Gi-DREADD抑制神經元后,原本在第三周會出現的芬太尼攝入量增長被完全阻斷,其攝入水平維持在第二周的程度,且在動機測試中的反應也減少。同時,芬太尼誘發的DA神經活動也相應下降。結果表明,疼痛背景下雄性大鼠芬太尼使用量的增加,依賴于VTADA神經元對藥物反應性隨時間推移而增強的這一特定神經活動變化,證明了該神經機制的行為必要性。
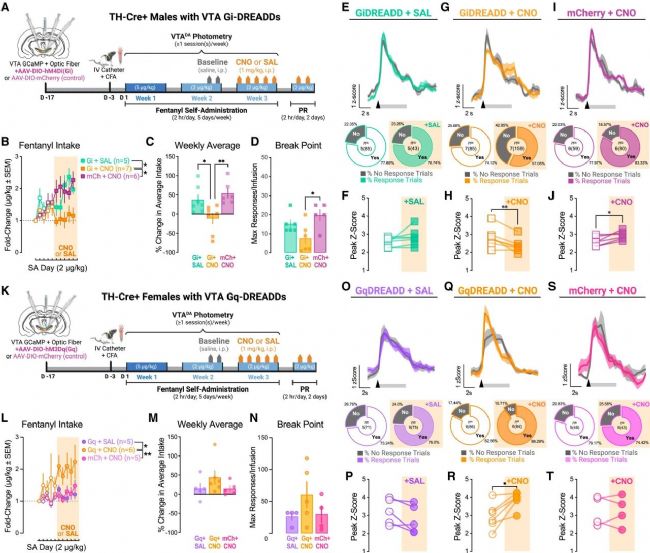
圖 5 SA第3周期間高強度芬太尼誘發VTADA活性是CFA后促進芬太尼使用的必要和充分條件
(A) 雄性實驗方法示意圖。SA第3周期間,表達Gi-DREADD的雄性在SA會話開始前20分鐘接受SAL (Gi+SAL) 或CNO (Gi+CNO),表達mCherry的雄性接受CNO (mCh+CNO)。
(B) CNO或SAL處理后,雄性在芬太尼SA(2 μg/kg/次)期間每日芬太尼攝入量的變化。
(C) 與基線相比,雄性在CNO或SAL后的平均攝入量變化。
(D) CNO或SAL后雄性的PR中斷點。(E 和 F) Gi+SAL、(G 和 H) Gi+CNO 和 (I 和 J) mCh+CNO 雄性中,與杠桿按壓(箭頭)和輸注(灰色條)對齊的芬太尼誘發VTADA鈣瞬變、峰值概率和峰值Z值(基線時)。
(K) 雌性實驗方法示意圖。SA第3周期間,表達Gq-DREADD的雌性在SA會話開始前20分鐘接受SAL (Gq+SAL) 或CNO (Gq+CNO),表達mCherry的雌性接受CNO (mCh+CNO)。
(L) CNO或SAL處理后,雌性在芬太尼SA(2 μg/kg/次)期間每日芬太尼攝入量的變化。
(M) 與基線相比,雌性在CNO或SAL后的平均攝入量變化。
(N) CNO或SAL后雌性的PR中斷點。(O 和 P) Gq + SAL、(Q 和 R) Gq + CNO 和 (S 和 T) mCh + CNO 雌性中,與杠桿按壓和輸注對齊的芬太尼誘發VTADA鈣瞬變、峰值概率和峰值Z值。
研究人員進一步通過化學遺傳學技術激活CFA雌性大鼠的VTA多巴胺神經元,發現這種人為的興奮性干預足以模擬雄性表型,導致其芬太尼攝入量及藥物誘發的DA神經元反應顯著增加(圖5)。該結果與抑制實驗相結合,共同證明了增強的VTADA神經元活動是驅動疼痛背景下芬太尼使用量增加的充分必要條件,揭示了多巴胺獎賞系統過度興奮在成癮行為中的核心因果作用。
雌二醇(E2)導致的性別差異
由于疼痛會促進芬太尼誘發的VTADA神經元反應,從而選擇性地驅動雄性增加芬太尼使用,研究人員推測先天的性別差異保護了雌性。通過進一步探索,研究人員發現雌性大鼠對芬太尼的天然抵抗力并非由動情周期調節,而是依賴于卵巢激素的保護作用(圖6)。去除卵巢(OVX)后,雌性大鼠的芬太尼攝入量及其誘發的VTA至伏隔核的多巴胺神經通路活動均顯著增強,其表現與疼痛狀態下的雄性大鼠相似。這表明卵巢分泌的激素(如雌激素)能有效抑制多巴胺獎賞系統對阿片藥物的反應性,從而在生理狀態下抑制雌性的藥物尋求行為,構成了性別差異的關鍵內在保護機制。
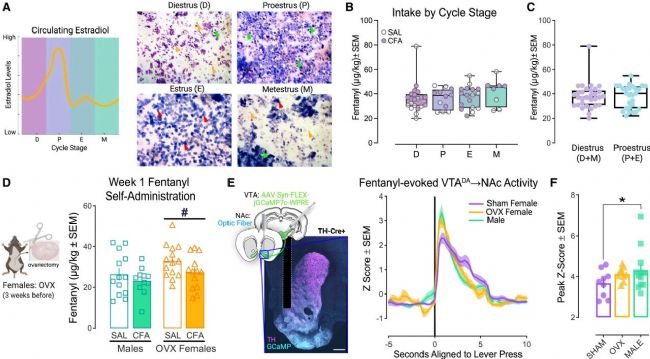
圖 6 卵巢激素的耗竭促進芬太尼自我給藥并易化芬太尼誘發的VTADA→NAc活性
(A) 四個周期階段——動情間期 (D)、動情前期 (P)、動情期 (E)、動情后期 (M)——相對雌激素水平示意圖(左)以及包含白細胞(黃色箭頭)、有核上皮細胞(綠色箭頭)和角質化上皮細胞(紅色箭頭)的代表性陰道細胞學涂片。
(B) SA第2-3周(2 μg/kg/次)各階段的平均芬太尼攝入量。
(C) 雌二醇水平低 (D+M) 或高 (P+E) 時的平均芬太尼攝入量。
(D) 卵巢切除術 (OVX) 程序示意圖和芬太尼自我給藥第1周期間的平均芬太尼攝入量。
(E) 病毒靶向策略示意圖以及jGCaMP與TH共定位和光纖位置的代表性圖像(左;比例尺:500 μm);雄性(藍綠色)、OVX雌性(金色)或假手術OVX (SHAM; 紫色) 的性腺完整雌性中芬太尼誘發的VTADA→NAc瞬變。
(F) 疼痛狀態下,SHAM或OVX處理的雌性及完整雄性中,芬太尼誘發的VTADA→NAc瞬變的峰值Z值。
雌二醇(E2)在雌性體內濃度較高,并可調節多巴胺(DA)活性和獎賞相關行為。為確定E2是否抑制疼痛促進的芬太尼使用和VTADA活性,在SA第三周向OVX雌性和完整雄性全身性給予E2(圖7)。研究發現雌二醇(E2)對芬太尼使用及其誘發VTA多巴胺神經元活動的調節作用具有顯著的“情境依賴性”,即同時取決于性別和疼痛狀態。在疼痛背景下的雄性大鼠中,E2發揮了保護性作用,顯著抑制了芬太尼誘發的DA神經元活動及藥物攝入量。然而,在OVX的雌性中,E2的效果截然相反:在無疼痛狀態下,它反而增強了多巴胺反應和藥物攝入;而在疼痛存在時,E2則失去調節作用。這表明E2的神經藥理學效應并非固定不變,其方向(抑制或促進)嚴重依賴于機體內在的激素背景和外在的疼痛狀態,揭示了激素-環境互作在調控成癮易感性中的復雜性。

圖 7 雌二醇對芬太尼SA和VTADA活性的效應取決于疼痛的存在
(A) 實驗方法示意圖。OVX雌性和雄性在開始SA前接受CFA或SAL及靜脈導管。第3周會話前30分鐘,皮下注射雌二醇 (E2; 20 μg/kg) 或載體 (VEH; 芝麻油)。
(B 和 C) CFA雄性在E2或VEH處理后,SA第3周期間 (B) 與杠桿按壓(箭頭)和芬太尼輸注(灰色條)對齊的芬太尼誘發VTADA鈣瞬變活性 以及 (C) 峰值Z值。
(D 和 E) SAL雄性在 (D) E2或VEH處理后的VTADA鈣瞬變活性 以及 (E) 峰值Z值。
(F 和 G) CFA OVX雌性在 (F) E2或VEH處理后的VTADA活性 以及 (G) 峰值Z值。
(H–M) SAL OVX雌性在 (H) E2或VEH處理后的VTADA活性 以及 (I) 峰值Z值。芬太尼攝入量的變化:(J) CFA雄性在E2或VEH后,(K) CFA OVX雌性在E2或VEH后,(L) SAL雄性,(M) SAL OVX雌性。
(N 和 P) CFA和E2或VEH處理后雄性和OVX雌性的 (N) 平均芬太尼攝入量(2 μg/kg/次)、(O) SA第3周期間平均攝入量 和 (P) PR中斷點。
(Q–S) SAL和E2或VEH處理后雄性和OVX雌性的 (Q) 平均芬太尼攝入量(2 μg/kg/次)、(R) SA第3周期間平均攝入量 和 (S) PR中斷點。
研究人員進一步探究了E2抑制疼痛背景下芬太尼使用的分子機制,發現其通過作用于VTA內的雌激素受體β(ERβ)亞型發揮保護作用(圖8)。在性腺完整的CFA雄性大鼠中,無論是全身還是VTA局部給予E2,均能顯著抑制芬太尼誘發的VTA至NAc多巴胺通路活動。關鍵的是,這種抑制效應可被VTA內注射ERβ特異性拮抗劑(PHTPP)所逆轉,恢復高強度的神經反應,而ERα拮抗劑(MPP)則無效,表明E2的保護作用特異性由ERβ介導。這種ERβ的調控具有嚴格的背景依賴性:它僅在性腺完整、存在內源性或外源性較高水平E2的個體中起作用。在卵巢切除(OVX)的雌性中,E2失去了調節作用,ER拮抗劑也無效,說明完整的卵巢激素環境是ERβ功能的基礎。而在假手術(SHAM)的完整雌性中,ERβ拮抗則能像在雄性中一樣增強神經反應。這些結果揭示了疼痛通過激活VTA ERβ信號通路,性別特異性地增強多巴胺系統對阿片藥物的反應性,從而促進成癮行為,為開發靶向ERβ的性別特異性成癮干預策略提供了關鍵理論依據。
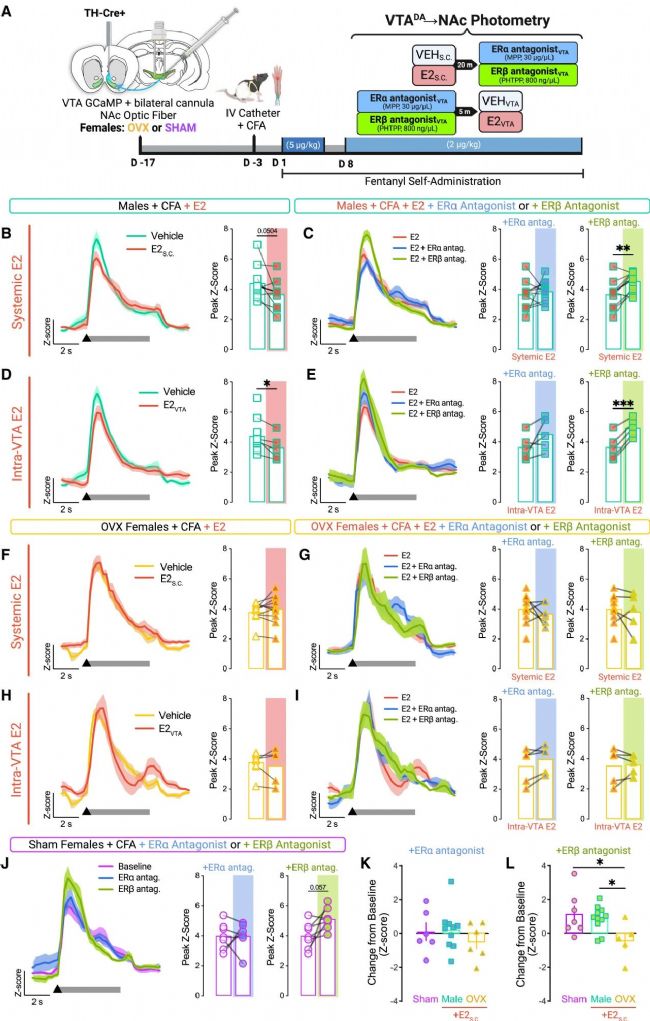
圖 8 雌二醇通過VTA雌激素受體β信號抑制芬太尼誘發的VTADA→NAc活性
(A) 實驗程序示意圖。TH-Cre+雄性和雌性大鼠在VTA接受jGCaMP7c并植入雙側套管,同時在NAc植入單側光纖。雌性接受OVX或SHAM手術。大鼠在芬太尼SA前接受靜脈導管和CFA。在全身性注射E2s.c. (20 μg/kg) 或VEHs.c. (芝麻油;1 mL/kg)20分鐘后,大鼠接受VTA內ER拮抗劑的微量注射。或者,大鼠在VTA內注射E2VTA (40 ng/μL) 或VEHVTA (10% EtOH生理鹽水)前5分鐘接受VTA內ER拮抗劑注射。
(B 和 C) CFA雄性在 (B) 全身性E2s.c. 或VEHs.c. 后 以及 (C) E2s.c. 和MPPVTA 或PHTPPVTA 后的芬太尼誘發VTADA→NAc活性和峰值Z值。
(D 和 E) CFA雄性在 (D) E2VTA 或VEHVTA 后 以及 (E) E2VTA 前預處理MPPVTA 或PHTPPVTA 后的芬太尼誘發VTADA→NAc活性。
(F 和 G) CFA OVX雌性在 (F) 全身性E2s.c. 或VEHs.c. 后 以及 (G) E2s.c. 和MPPVTA 或PHTPPVTA 后的芬太尼誘發VTADA→NAc活性和峰值Z值。
(H 和 I) CFA OVX雌性在 (H) E2VTA 或VEHVTA 后 以及 (I) E2VTA 前預處理MPPVTA 或PHTPPVTA 后的芬太尼誘發VTADA→NAc活性。
(J–L) CFA SHAM雌性在 (J) MPPVTA 或PHTPPVTA 后的芬太尼誘發VTADA→NAc活性。VTA內ER拮抗劑 (K) MPPVTA 或 (L) PHTPPVTA 處理后峰值Z值變化的比較。
研究結論
研究首次揭示慢性疼痛通過性別特異性機制驅動阿片成癮:在雄性中,疼痛依賴性地增強VTA多巴胺神經元對芬太尼的反應性,直接導致用藥量增加;而雌性在卵巢激素(主要通過VTA ERβ受體)保護下免受此效應。
該發現不僅闡明了疼痛-成癮共病的神經生物學基礎,更為開發性別特異性的精準鎮痛與防復吸策略提供了革命性靶點。
參考文獻:
Higginbotham JA, Abt JG, Teich RH, et al. Estradiol protects against pain-facilitated fentanyl use via suppression of opioid-evoked dopamine activity in males. Neuron. 2025 May 7;113(9):1413-1429.e5. doi: 10.1016/j.neuron.2025.02.013.
想要獲取本篇文獻的老師同學們,可以拉到文末掃碼添加禮智小客服哦!