關于治療型細胞從研發到生產的質量管理的思考
在早期進行質量管理的優點,包括:
1 提供證據、支持可追蹤性以及推動持續改進方法;
2 在比較實驗或調查問題時,賦予更強的溯源與解析能力;
3 通過減少不必要重復節省時間與資源;
4 向投資者與監管人員展示產品的可控性;
5 高效運營的優質策略。
1 從研發管線階段到一期臨床所涉及的環節;

2 進一步展示從 Proof of Principle 到 GMP 的關鍵環節。
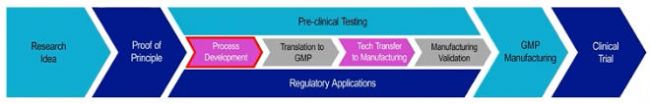
其中,Pre-clinical Testing 與 Regulation Applications 是同時進行的,工藝開發是基礎,決定了是否成功。首先對產品/工藝相關風險進行關鍵評估,涉及產品產量、產品活率、試劑及耗材、監管要求、如何評價結果以及實際可行性(成本、規模以及時間)。
在工藝開發前需要確定一些關鍵事項,例如數據記錄的重要性,數據記錄應符合如良好文件管理規范原則,手動記錄數據非常必要,同時還要考慮數據遇到風險時,是否可以被恢復,如何證明數據的真實和公正性等。相對于實驗結果,數據更加重要,例如數據有可追溯性、提供風險評估及決策過程的基礎等。另外,在研發階段復核審查數據并作出的決定,直接影響了最終是否成功。
那么,好的數據記錄管理包括哪些關鍵點呢?Dr. Zoe Hewitt 基于自己和公司的經驗向大家展示以下幾點:
1 規范化數據記錄過程,無論是基于紙質的還是電子的記錄;
2 對于新進員工,要告訴他們哪些證據必須記錄;
3 提供實驗的標準化模板。
這里有一條黃金原則叫做“如果不記錄,等于沒發生”,ALCOA 原則也同樣適用于早期開發階段。那什么是 ALCOA 原則呢?從工藝開發轉移到 GMP,技術轉移至生產及生產系統驗證都要注意什么要點呢?讓我們跟隨 Dr. Zoe Hewitt 學習后面的精彩內容。
Solentim 系列產品具有單細胞的柔性高效分離、單克隆成像和追蹤,以及單克隆質量分析檢測等功能。其中,新一代機器符合 GMP 應用,例如 VIPS PRO 單細胞鋪板成像儀,使用一次性耗材,機器內部無流路,在生物安全柜中使用,支持 GMP 環境使用。此外,STUDIUS 軟件的數據溯源、數據安全存儲、多級用戶權限、審計追蹤等特點,符合 CFR 21 Part 11 要求。因此,我們的 Solentim 生態系統助力客戶工藝開發過程中的質量控制。