Beacon單細胞光導(dǎo)系統(tǒng)在雙特異性抗體細胞株篩選和開發(fā)中的應(yīng)用
雙特異性抗體的細胞株開發(fā)
雙特異性抗體(簡稱 “雙抗”)是治療性抗體領(lǐng)域極具創(chuàng)新性的分支,通過基因工程改造,可同時靶向兩個不同抗原表位。相較于傳統(tǒng)單克隆抗體(簡稱 “單抗”),雙抗能實現(xiàn)天然抗體難以達成的功能,如免疫細胞重定向、雙信號通路協(xié)同阻斷等。憑借更強的靶向性與治療效能,雙抗在腫瘤免疫治療領(lǐng)域表現(xiàn)突出。目前全球已有多款雙抗藥物獲批用于血液腫瘤及實體瘤治療,另有超百個候選藥物處于臨床研究階段,應(yīng)用前景廣闊。
然而,雙抗分子的復(fù)雜結(jié)構(gòu),使其生產(chǎn)用細胞株開發(fā)面臨顯著挑戰(zhàn):
- 分子結(jié)構(gòu)復(fù)雜性導(dǎo)致的表達與組裝難題;
- 產(chǎn)量與質(zhì)量的協(xié)同調(diào)控難度大;
- 細胞株穩(wěn)定性風(fēng)險更高。
這就對細胞株篩選的通量和篩選的效率提出了更高的要求:
- 需要篩選更多的mini-pool,才能獲得 “高表達+高正確配對率”的候選cell pool用于后續(xù)的單克隆篩選;
- 進入單克隆篩選階段后,盡早地開展“產(chǎn)量+質(zhì)量”的同步檢測,排除“高產(chǎn)量但錯配率高” 的細胞克隆進入后續(xù)流程,將篩選資源聚焦在更有開發(fā)價值的細胞株上。
Beacon®平臺結(jié)合產(chǎn)量檢測(DiGr Assay)、雙抗正配率檢測(Bispecific Heterodimer Assay)以及聚集體檢測(Aggregation Assay),可以在細胞株篩選早期實現(xiàn)細胞株產(chǎn)量與產(chǎn)物質(zhì)量的多維度評估,將大幅提升細胞株開發(fā)的效率和最終產(chǎn)物的品質(zhì)。最后,Beacon®平臺的細胞株穩(wěn)定性預(yù)測功能(Population Dynamics),可以減少RCB建庫成本和穩(wěn)定性試驗的工作量,進一步助力雙抗細胞株的開發(fā)。以下,將展開介紹Beacon®平臺的Bispecific Heterodimer Assay的原理和應(yīng)用案例。
Part.01 Beacon®單細胞光導(dǎo)系統(tǒng)
Bispecific Heterodimer Assay
雙抗正確配對比例的檢測已成為細胞株開發(fā)過程中的關(guān)鍵一環(huán)。Beacon®單細胞光導(dǎo)平臺,依托納米流體芯片技術(shù)和光電定位技術(shù),可以實現(xiàn)自動化、高通量的細胞株開發(fā)流程。除了單細胞分離、單克隆性驗證以及高表達細胞株篩選外,Beacon®平臺的bispecific heterodimer assay可以在細胞株開發(fā)的早期檢測非對稱雙抗的正確配對比例,從而盡早地排除劣質(zhì)克隆,節(jié)省后續(xù)驗證的資源和人力,提高細胞株開發(fā)的效率和項目的成功率。
Beacon®的bispecific assay是在納升流體芯片上開展的,NanoPen®微型化的體積(1.7nl)使得在細胞株開發(fā)早期開展質(zhì)量檢測成為可能。通過兩次自定義的定量檢測,如分別使用熒光標記的抗原-1和抗原-2開展兩次連續(xù)檢測,分別測得兩個抗原的結(jié)合信號強度(Calibrated Pen Score),然后根據(jù)兩個抗原Calibrated Pen Score的比值,比值越接近1:1意味著正確配對的雙抗比例就越高,就可以篩選出產(chǎn)物正確配對比例高的優(yōu)質(zhì)細胞株。
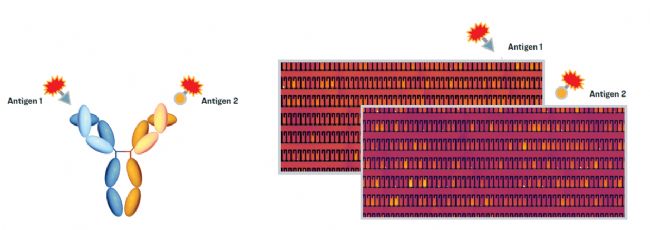
圖1:Bispecific assay的檢測原理。
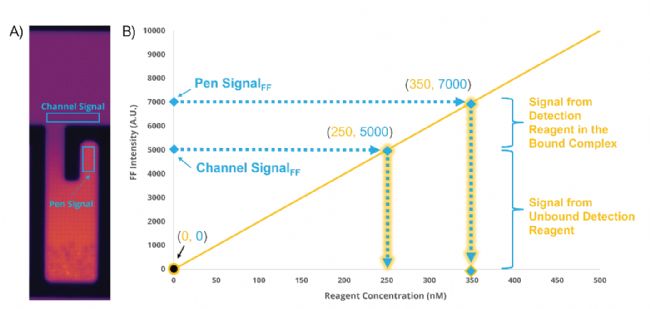
圖2:Bispecific assay中Calibrated Pen Score的計算過程。A)Bispecific assay下的NanoPen,其中Channel Signal與Pen Signal的采集區(qū)域由藍框標記。B)通過兩點標準曲線計算Calibrated Pen Score,其中第一個點來自參比圖像,經(jīng)過背景扣除和平場校正后,該值坐標為(0,0),第二個點來自檢測圖像的Channel Signal,同樣經(jīng)過背景扣除和平場校正,其中試劑濃度已事先測定。然后根據(jù)Pen Signal(信號來自游離態(tài)檢測試劑和結(jié)合態(tài)檢測試劑),就可以計算出Pen內(nèi)積累的產(chǎn)物濃度,即為Calibrated Pen Score。
Part.02 來自Incyte的案例分享
來自美國Incyte公司的專家Wang Shu分享了他們對Beacon®平臺bispecific assay的方法學(xué)驗證工作和細胞株篩選的實例。在建立bispecific assay之前,他們已經(jīng)利用Beacon®平臺開展單細胞克隆和表達量篩選,回收的細胞克隆經(jīng)擴增后用Octet開展雙抗產(chǎn)物正配比例的檢測。雖然這個技術(shù)路線可以排除掉雙抗正配比例低的細胞株,但回收細胞克隆的擴增已經(jīng)浪費了不少的時間和成本。因此,他們在Beacon®平臺上驗證和實測了bispecific assay,結(jié)果顯示bispecific assay能夠高效地篩選出優(yōu)質(zhì)細胞株,進一步提高了細胞株篩選的效率。
他們選取了一系列已知正確配對比例的細胞克隆、mini pool和bulk pool用于驗證。在實驗摸索階段他們發(fā)現(xiàn)A594-Ligand B會導(dǎo)致抗體聚集而無法準確檢測表達量,因此最終選擇了SpotLight Fc和A594-Ligand A開展bispecific assay。測試結(jié)果表明,Beacon®的bispecific assay測定的Arm-A:Fc比值與HPLC測定的比值具有非常高的相關(guān)性,R2達到0.89(圖3)。
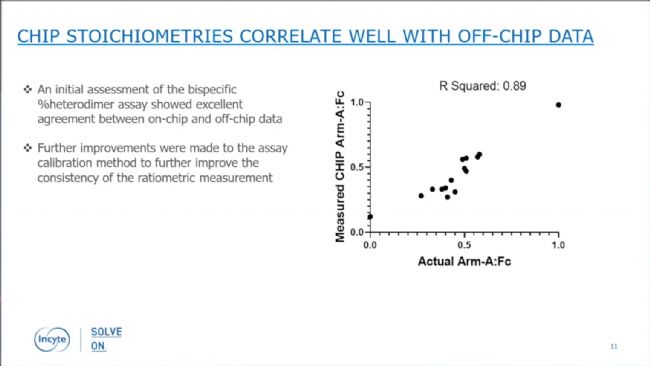 圖3:Beacon®芯片上開展的bispecific assay檢測結(jié)果與CEX-HPLC結(jié)果具有很好的相關(guān)性。
圖3:Beacon®芯片上開展的bispecific assay檢測結(jié)果與CEX-HPLC結(jié)果具有很好的相關(guān)性。接著他們選取了一個bulk pool作為起始細胞樣品,開展了正式的單細胞克隆和bispecific assay檢測。如下圖中的綠框所示,Arm-A/Fc比值在0.4-0.6,且Calibrated Pen Score數(shù)值較大(意味著產(chǎn)物表達量較高)的克隆被認為是“好克隆”。紅框圈出的克隆,比值偏離0.5較多,被認為是“差克隆”而被挑取出來。此外,還有一些表達量低的克隆(紫色框)也被挑取出來用于比較和驗證。
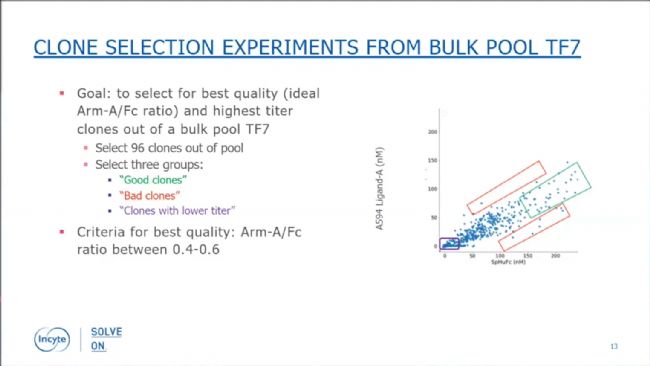 圖4:根據(jù)bispecific assay從bulk pool中挑取三組克隆。
圖4:根據(jù)bispecific assay從bulk pool中挑取三組克隆。初步驗證結(jié)果表明,按比值0.4-0.6去篩選克隆,可以覆蓋絕大部分的真優(yōu)質(zhì)克隆。該標準下被篩選出來的21個克隆中,19個克隆具有最高的產(chǎn)物質(zhì)量(異源二聚體比例>80%)。
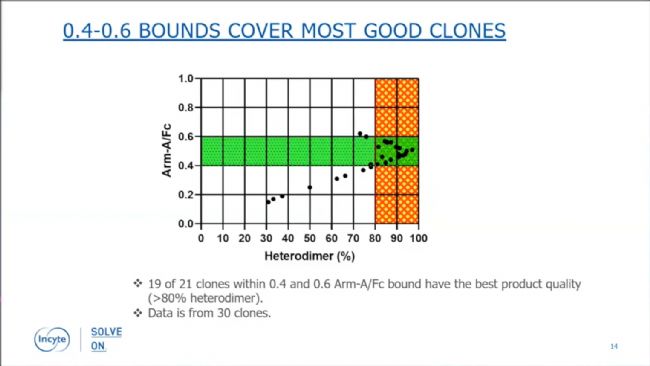 圖5:根據(jù)bispecific assay設(shè)定0.4-0.6的篩選范圍可以覆蓋絕大多數(shù)優(yōu)質(zhì)克隆。
圖5:根據(jù)bispecific assay設(shè)定0.4-0.6的篩選范圍可以覆蓋絕大多數(shù)優(yōu)質(zhì)克隆。接著他們選取了42個克隆進入Fed-batch評估,其中7個克隆通過TubeSpin Bioreactor (TPP)評估,其余35個克隆用Ambr15進行評估。然后,研究人員對36個克隆的產(chǎn)物開展了CEX-HPLC分析以測定正配比例,剩余6個克隆因產(chǎn)量不夠沒有被分析。
用Ambr15開展fed-batch分析的35個克隆中,32個克隆的產(chǎn)量都高于pool的平均產(chǎn)量,最高的克隆產(chǎn)量是pool均值的4倍以上,由此可見Beacon®的產(chǎn)量檢測可以有效地篩選出高產(chǎn)細胞株。
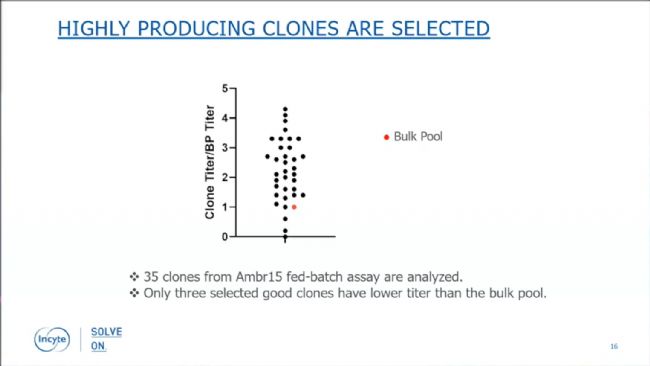 圖6:Bispecific assay篩選出高產(chǎn)細胞株。
圖6:Bispecific assay篩選出高產(chǎn)細胞株。最后研究人員關(guān)聯(lián)分析了36個克隆的CEX數(shù)據(jù)和Beacon®上測定的比值。結(jié)果顯示來自Good Ratio組的9個克隆都具有好的正配比例(即True Positive),真陽性率為100%。來自Bad Ratio組的26個克隆,9個具有好的正配比例(即False Negative),17個具有差的正配比例(即True Negative),因此假陽性率為34.6%。為了進一步降低假陽性率,他們重新分析數(shù)據(jù),最后確定將bispecific assay的篩選閾值設(shè)定為0.3-0.7時,真陽性率維持100%,而假陰性率可以顯著降低到15%。因此,適當放寬篩選標準,是一種降低假陰性率的可選策略。實際操作中,可以優(yōu)先導(dǎo)出比值接近理論值的克隆,然后再適當收集比值在兩側(cè)延伸區(qū)的克隆,從而既能夠保證真陽性率,又能降低假陰性率,保證篩選的效率和克隆的品質(zhì)。
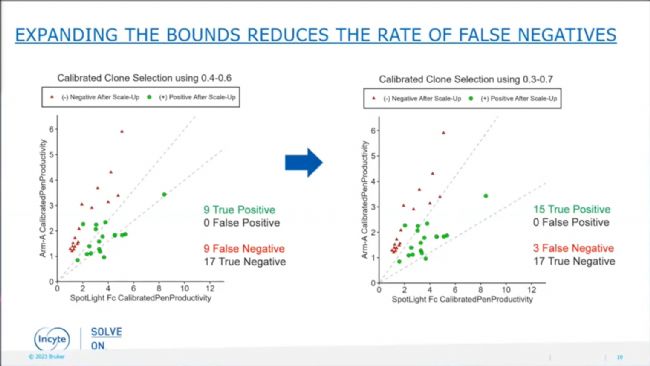 圖7:Bispecific assay實現(xiàn)100%的真陽性率,通過調(diào)整篩選閾值可進一步降低假陰性率。(注:圖中虛線兩側(cè)外的綠色圓點標記的是False Negative,而紅色三角形標記的是True Negative)
圖7:Bispecific assay實現(xiàn)100%的真陽性率,通過調(diào)整篩選閾值可進一步降低假陰性率。(注:圖中虛線兩側(cè)外的綠色圓點標記的是False Negative,而紅色三角形標記的是True Negative)結(jié) 語
Incyte的案例分享,豐富地展示了Beacon®細胞株開發(fā)解決方案強大的篩選能力,通過bispecific assay可以幫助研究人員在篩選早期就能夠識別出高產(chǎn)且優(yōu)質(zhì)的細胞株,從而節(jié)省后續(xù)驗證的成本和時間,并確保了項目交付的成果。
- 單細胞懸液制備儀在解離睪丸、肝臟、腫瘤等組織中的應(yīng)用及操作步驟
- 細胞聚焦技術(shù)賦能UP.SIGHT 2.0實現(xiàn)單細胞分選全維升級
- 關(guān)于治療型細胞從研發(fā)到生產(chǎn)的質(zhì)量管理的思考
- isoPick單細胞可視化分選技術(shù)助力單卵母細胞脂質(zhì)分析獲關(guān)鍵成果
- Beacon單細胞光導(dǎo)系統(tǒng)在雙特異性抗體細胞株篩選和開發(fā)中的應(yīng)用
- 單細胞打印加速In Vivo CAR-T抗癌新療法
- 實現(xiàn)巨噬細胞標準化量產(chǎn)的CERO 3D細胞培養(yǎng)儀培養(yǎng)流程全解析及應(yīng)用
- Beacon單細胞光導(dǎo)平臺助力自身免疫性疾病MOGAD研究中的應(yīng)用






