生物3D打印模型在先天性心臟病TOF-MAPCAs治療中的應用
在兒科心血管領域,有一種罕見卻棘手的疾病 —— 法洛四聯癥合并主肺動脈側支循環(TOF-MAPCAs)。它屬于先天性肺動脈狹窄的特殊類型,患者血管解剖結構復雜且個體差異極大,手術干預難度高,術后還常面臨遠端血管狹窄、閉鎖等問題,嚴重威脅患兒生命健康。而傳統治療中,缺乏能精準模擬患者血管情況的體外模型,給手術培訓、治療方案優化帶來諸多限制。不過,一項發表在《Journal of the American Heart Association》的研究,通過 3D 生物打印技術為這一困境帶來了突破性解決方案。

一、疾病困境:復雜解剖 + 個體差異,治療難題待解
TOF-MAPCAs 的核心挑戰在于其 “異質性”。患者體內的主肺動脈側支動脈(MAPCAs),其起源、數量、大小和走行各不相同,就像每個人的指紋一樣獨特。目前主流的治療方式是通過手術將側支動脈吻合,建立集中的肺動脈連接,再植入右心室到肺動脈的管道。但即便手術操作精準,仍有不少患者術后出現遠端肺動脈狹窄,且需維持肺部各區域壓力均衡,否則可能引發右心室高血壓等嚴重并發癥。
更關鍵的是,傳統研究工具存在明顯短板:2D 或普通 3D 血管模型無法模擬真實的血流動態環境;動物模型的遺傳和生理特征與人類差異大,研究結果難以直接轉化到臨床;而直接在患者身上測試新手術技術或器械,風險又過高。因此,構建能貼合患者個體情況的體外模型,成為突破治療瓶頸的關鍵。
二、創新方案:從患者影像到 3D 模型,復刻 “專屬血管”
研究團隊另辟蹊徑,以患者自身的血管影像數據為基礎,結合 3D 打印與生物打印技術,打造出可用于治療研究的 “個性化血管模型”,整個過程分為三大核心步驟:
1. 精準獲取患者血管數據
研究選取了兩類典型患者:一名 3 天大的新生兒和一名 14 歲的青少年。通過計算機斷層掃描(CT)或 3D 旋轉血管造影技術,捕捉患者肺動脈及側支動脈的詳細解剖信息。其中,針對青少年患者的 3D 旋轉血管造影,還特別采用了呼吸控制和心臟起搏技術,減少影像偽影,確保血管細節清晰可辨。
2. 構建數字模型與實體打印
利用專業建模軟件(如 Autodesk Meshmixer、Vitrea),將影像數據轉化為數字 3D 模型,并設計出 1 毫米厚的血管 “外殼”(便于后續灌注實驗)。隨后,通過兩種方式制作實體模型:
合成樹脂模型:使用立體光刻打印機,分別采用透明樹脂(Clear Resin,便于觀察內部血流)、柔性樹脂(Flexible Resin,模擬血管彈性)等材料打印,經過異丙醇清洗、紫外線固化等后處理,確保模型結構穩定。
生物混合模型:以 20% 濃度的明膠甲基丙烯酸酯(GelMA)為核心材料(這種水凝膠能模擬人體軟組織的剛度,且支持細胞附著生長),加入光引發劑后,通過CELLINK Bio X生物打印機打印或手動澆鑄成型,再搭配3D 打印的樹脂外殼固定,預留灌注接口,最終形成可模擬真實血管生理特性的生物模型。

3. 模擬手術干預與血流分析
為驗證模型的實用性,研究團隊在模型上模擬了臨床常用的血管再通手術:通過熒光透視引導,將導管、導絲和支架(3×15 毫米)精準植入,建立閉鎖肺動脈與側支動脈的連接。術后,向模型內灌注造影劑(如 Omnipaque),觀察血流是否通暢;同時,利用計算流體動力學(CFD)技術,模擬真實血流狀態,分析流速、壓力分布等關鍵參數,評估手術效果。
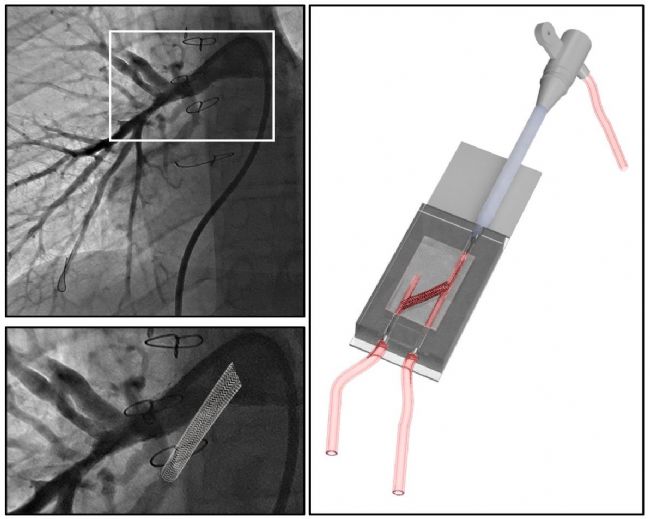
1. 精準復刻血管解剖,貼合臨床實際
無論是合成樹脂模型還是生物混合模型,其血管結構都與患者原始造影圖像高度吻合。透明樹脂模型能清晰觀察到血管內的血流情況;生物模型則能模擬真實血管的力學特性,支架植入后可穩定維持血流通道,與臨床手術效果一致。例如,在青少年患者的模型中,成功還原了此前手術遺留的 “近閉鎖血管” 結構,為后續測試再通技術提供了精準的 “實戰場景”。
2. 成功驗證新干預技術,降低手術風險
研究團隊在模型上測試了一種針對閉鎖血管的導管介入方案:通過特殊導絲突破閉鎖段,再植入支架建立血流通道。結果顯示,優化后的操作流程能有效避免血管損傷,術后造影劑可順暢流過吻合處,證明該技術具備可行性。這意味著,未來醫生可先在模型上反復演練復雜手術,優化操作細節,再應用到患者身上,大幅降低手術風險。
3. 助力血流機制研究,優化治療方案
借助 CFD 分析,研究團隊還發現了手術中的關鍵血流特征:例如,支架植入后血管內的峰值流速約為 41 毫米 / 秒,分支處血流分配均勻,但在收縮期減速階段,血管連接入口會出現輕微血流再循環(可能增加后續狹窄風險)。這些發現為進一步調整支架位置、優化血管連接角度提供了數據支持,有助于制定更精準的個性化治療方案。
四、臨床意義與未來方向:從模型到患者,改善治療結局
這項研究的價值不僅在于構建了一種新模型,更在于為復雜心血管疾病的治療開辟了新路徑:
手術培訓:模型可作為 “模擬器”,讓年輕醫生在無風險環境下練習復雜血管吻合、支架植入等操作,提升臨床技能。
術前規劃:針對每一位患者的模型,醫生可提前模擬多種手術方案,選擇最優路徑,減少術中決策時間。
新藥與器械研發:模型可用于測試新型支架、導管或藥物的效果,加速研發進程,降低臨床試驗成本。
不過,研究也指出當前的局限性:例如,構建數字模型需要心外科、放射科等多學科專業技能,技術門檻較高;生物模型的長期細胞存活、大規模細胞化等問題仍需進一步解決;CFD 分析目前未納入血管壁彈性等復雜生理參數,模擬結果仍需完善。
未來,研究團隊計劃進一步優化模型:結合患者干細胞衍生的心肌細胞或內皮細胞,讓生物模型更接近真實血管的生理狀態;完善 CFD 模型,納入更多臨床參數;同時開發更簡便的建模工具,降低技術門檻,讓這種 “個性化模型” 能更廣泛地應用于臨床,最終為 TOF-MAPCAs 等復雜先天性心臟病患者帶來更好的治療結局。
關注我們了解更多內容
CELLINK認證的中國授權經銷商:

上海跡亞國際商貿有限公司
Gaia China Co.,Ltd.

一、疾病困境:復雜解剖 + 個體差異,治療難題待解
更關鍵的是,傳統研究工具存在明顯短板:2D 或普通 3D 血管模型無法模擬真實的血流動態環境;動物模型的遺傳和生理特征與人類差異大,研究結果難以直接轉化到臨床;而直接在患者身上測試新手術技術或器械,風險又過高。因此,構建能貼合患者個體情況的體外模型,成為突破治療瓶頸的關鍵。
二、創新方案:從患者影像到 3D 模型,復刻 “專屬血管”
研究團隊另辟蹊徑,以患者自身的血管影像數據為基礎,結合 3D 打印與生物打印技術,打造出可用于治療研究的 “個性化血管模型”,整個過程分為三大核心步驟:
1. 精準獲取患者血管數據
研究選取了兩類典型患者:一名 3 天大的新生兒和一名 14 歲的青少年。通過計算機斷層掃描(CT)或 3D 旋轉血管造影技術,捕捉患者肺動脈及側支動脈的詳細解剖信息。其中,針對青少年患者的 3D 旋轉血管造影,還特別采用了呼吸控制和心臟起搏技術,減少影像偽影,確保血管細節清晰可辨。
2. 構建數字模型與實體打印
利用專業建模軟件(如 Autodesk Meshmixer、Vitrea),將影像數據轉化為數字 3D 模型,并設計出 1 毫米厚的血管 “外殼”(便于后續灌注實驗)。隨后,通過兩種方式制作實體模型:
合成樹脂模型:使用立體光刻打印機,分別采用透明樹脂(Clear Resin,便于觀察內部血流)、柔性樹脂(Flexible Resin,模擬血管彈性)等材料打印,經過異丙醇清洗、紫外線固化等后處理,確保模型結構穩定。
生物混合模型:以 20% 濃度的明膠甲基丙烯酸酯(GelMA)為核心材料(這種水凝膠能模擬人體軟組織的剛度,且支持細胞附著生長),加入光引發劑后,通過CELLINK Bio X生物打印機打印或手動澆鑄成型,再搭配3D 打印的樹脂外殼固定,預留灌注接口,最終形成可模擬真實血管生理特性的生物模型。

3. 模擬手術干預與血流分析
為驗證模型的實用性,研究團隊在模型上模擬了臨床常用的血管再通手術:通過熒光透視引導,將導管、導絲和支架(3×15 毫米)精準植入,建立閉鎖肺動脈與側支動脈的連接。術后,向模型內灌注造影劑(如 Omnipaque),觀察血流是否通暢;同時,利用計算流體動力學(CFD)技術,模擬真實血流狀態,分析流速、壓力分布等關鍵參數,評估手術效果。

三、研究成果:模型可 “實戰”,為治療帶來多重價值
經過反復測試,這種 3D 生物打印模型展現出優異的臨床應用潛力,主要體現在三個方面:1. 精準復刻血管解剖,貼合臨床實際
無論是合成樹脂模型還是生物混合模型,其血管結構都與患者原始造影圖像高度吻合。透明樹脂模型能清晰觀察到血管內的血流情況;生物模型則能模擬真實血管的力學特性,支架植入后可穩定維持血流通道,與臨床手術效果一致。例如,在青少年患者的模型中,成功還原了此前手術遺留的 “近閉鎖血管” 結構,為后續測試再通技術提供了精準的 “實戰場景”。
2. 成功驗證新干預技術,降低手術風險
研究團隊在模型上測試了一種針對閉鎖血管的導管介入方案:通過特殊導絲突破閉鎖段,再植入支架建立血流通道。結果顯示,優化后的操作流程能有效避免血管損傷,術后造影劑可順暢流過吻合處,證明該技術具備可行性。這意味著,未來醫生可先在模型上反復演練復雜手術,優化操作細節,再應用到患者身上,大幅降低手術風險。
3. 助力血流機制研究,優化治療方案
借助 CFD 分析,研究團隊還發現了手術中的關鍵血流特征:例如,支架植入后血管內的峰值流速約為 41 毫米 / 秒,分支處血流分配均勻,但在收縮期減速階段,血管連接入口會出現輕微血流再循環(可能增加后續狹窄風險)。這些發現為進一步調整支架位置、優化血管連接角度提供了數據支持,有助于制定更精準的個性化治療方案。
四、臨床意義與未來方向:從模型到患者,改善治療結局
這項研究的價值不僅在于構建了一種新模型,更在于為復雜心血管疾病的治療開辟了新路徑:
手術培訓:模型可作為 “模擬器”,讓年輕醫生在無風險環境下練習復雜血管吻合、支架植入等操作,提升臨床技能。
術前規劃:針對每一位患者的模型,醫生可提前模擬多種手術方案,選擇最優路徑,減少術中決策時間。
新藥與器械研發:模型可用于測試新型支架、導管或藥物的效果,加速研發進程,降低臨床試驗成本。
不過,研究也指出當前的局限性:例如,構建數字模型需要心外科、放射科等多學科專業技能,技術門檻較高;生物模型的長期細胞存活、大規模細胞化等問題仍需進一步解決;CFD 分析目前未納入血管壁彈性等復雜生理參數,模擬結果仍需完善。
未來,研究團隊計劃進一步優化模型:結合患者干細胞衍生的心肌細胞或內皮細胞,讓生物模型更接近真實血管的生理狀態;完善 CFD 模型,納入更多臨床參數;同時開發更簡便的建模工具,降低技術門檻,讓這種 “個性化模型” 能更廣泛地應用于臨床,最終為 TOF-MAPCAs 等復雜先天性心臟病患者帶來更好的治療結局。
關注我們了解更多內容

CELLINK認證的中國授權經銷商:

上海跡亞國際商貿有限公司
Gaia China Co.,Ltd.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






