單細胞擬時序分析技術的核心特征、原理、分析步驟及應用場景
在生命科學研究的微觀世界中,細胞分化是一個動態、連續且復雜的過程,涉及大量基因的精密調控和細胞狀態的逐步轉變。傳統 bulk 測序技術因掩蓋了單細胞層面的異質性,無法捕捉細胞分化過程中的中間過渡狀態,難以完整還原細胞從起始到終末的發育路徑。而單細胞擬時序分析(Pseudotime Analysis)技術的問世,打破了這一局限。它以單細胞轉錄組數據為基礎,通過挖掘基因表達的動態變化規律,構建細胞分化的虛擬時間軸,精準模擬細胞分化軌跡,成為解碼細胞命運決定機制的核心工具,為發育生物學、腫瘤學、免疫學等領域的研究帶來了突破性進展。
一、技術核心:理論基礎與核心特征
(一)核心理論支撐
單細胞擬時序分析的核心理論源于對細胞群體異質性的深刻認知:細胞發育并非簡單地劃分為少數幾個離散階段,而是存在大量連續且漸進的中間過渡狀態。這些過渡狀態是細胞分化過程中基因表達逐步重構的關鍵階段,承載著細胞命運轉變的核心信息。通過單細胞測序技術獲得的單細胞表達譜,能夠真實反映每個細胞的基因表達特征,進而為評估細胞間的親緣關系、推斷細胞分化順序提供了數據基礎。
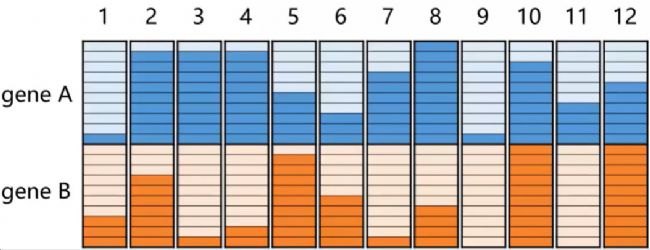
與傳統的時間序列實驗不同,擬時序分析無需對細胞進行連續的時間點采樣,而是通過 “橫斷面” 式的單次樣本檢測,利用單細胞表達譜的差異信息,反向推測細胞群體的完整發育進程,因此被稱為 “擬時序”—— 即通過計算模擬出的細胞發育時間,而非真實的物理時間。
(二)基因表達的核心規律
細胞分化過程中,基因表達的動態變化是擬時序分析的關鍵依據,其核心規律主要體現在兩方面:
特征基因的時相特異性:不同發育時相的細胞會表達一套特定的特征基因,這些基因通常以轉錄因子(TF)為核心,構成調控細胞分化的分子網絡。例如,在胚胎干細胞向神經元分化的過程中,Oct4、Sox2 等多能性轉錄因子的表達逐漸下調,而 NeuroD1、Map2 等神經元特異性基因的表達逐步上調。
表達變化的平穩性:在細胞分化的連續過程中,特征基因的表達并非劇烈波動,而是呈現出平穩上升或平穩下降的趨勢。擬時序分析的核心目標就是捕捉這種平穩變化的基因表達模式,通過對細胞進行合理排序,讓大部分基因的表達在虛擬時間軸上實現平滑過渡,從而真實還原細胞分化的分子動態過程。
二、關鍵原理:算法邏輯與軌跡構建
單細胞擬時序分析的核心是通過算法構建能夠反映細胞分化關系的軌跡圖,其底層邏輯與關鍵步驟如下:
(一)核心算法:最小生成樹(Minimum Spanning Tree, MST)
擬時序分析中最常用的軌跡構建算法基于最小生成樹原理。最小生成樹是指在一個包含多個節點的無向圖中,找到一棵連接所有節點且邊的權重之和最小的樹。在單細胞數據中,每個細胞被視為一個節點,節點間的權重由細胞表達譜的相似性(如歐氏距離、皮爾遜相關系數等)決定 —— 表達譜越相似的細胞,節點間的權重越小。通過構建最小生成樹,能夠找到連接所有細胞的最短路徑之和,從而建立起細胞之間的 “親緣關系” 網絡,為后續的細胞排序提供基礎。
(二)細胞排序與軌跡優化
在最小生成樹的基礎上,結合基因表達的平穩性規律,對所有細胞進行時間排序:
首先識別出具有顯著時相特異性的特征基因(即表達隨分化過程平穩變化的基因);
以這些特征基因為依據,對最小生成樹中的細胞節點進行順序調整,使特征基因的表達在節點序列上呈現連續的上升或下降趨勢;
最終形成的細胞序列即為擬時序軸,軸上的每個位置代表細胞在分化過程中的一個特定狀態,而整個序列構成的分支結構則對應細胞分化的不同路徑(如單向分化、分支分化等)。
此外,軌跡構建后還可根據研究需求進行優化,例如重新選擇時序方向(reverse)—— 當初始排序的分化方向與已知生物學事實不符時,可反轉擬時序軸;或指定起始狀態(root_state)—— 通過已知的干細胞或前體細胞標記基因,確定擬時序軸的起點,提升軌跡的生物學合理性。
(三)不同軌跡類型的適配
根據細胞分化的實際情況,擬時序分析可構建多種類型的軌跡,以適配不同的生物學場景:
線性軌跡:適用于細胞向單一方向分化的場景(如造血干細胞向紅細胞分化);
分支軌跡:適用于細胞分化過程中出現命運分支的場景(如神經嵴細胞分化為神經元、膠質細胞或平滑肌細胞);
循環軌跡:適用于細胞存在周期性狀態變化的場景(如細胞周期、干細胞自我更新與分化的循環)。
三、標準化分析步驟
(一)特征選擇
特征基因的篩選是擬時序分析的基礎,直接影響后續軌跡構建的準確性,主要通過三種方式實現:
高表達基因篩選:選取所有平均表達量(mean_expr)>0.1 的高表達基因,這類基因能夠為細胞狀態區分提供穩定的表達信號;
亞群特異基因篩選:可導入 Seurat 軟件計算得到的特征基因,或利用 Monocle 軟件分析獲得的差異表達基因(DEG),這類基因具有細胞亞群特異性,能精準反映不同細胞群體的分化特征;
手動輸入基因:基于已有的先驗知識,手動輸入與目標發育過程相關的已知基因集,進一步提升分析的針對性與有效性。
(二)數據降維與批次效應去除
在特征選擇之后,需要進行數據降維處理。數據降維能夠剔除冗余信息,讓細胞軌跡更加簡潔清晰,同時減少后續計算的復雜度。此外,若數據存在批次效應,需通過相應的技術手段去除,以避免批次差異對軌跡構建的干擾,確保分析結果的可靠性。
(三)細胞時間排序
這是擬時序分析的核心環節,需要對所有細胞進行順序調換,以匹配模擬的分化軌跡。該過程往往需要消耗大量的計算資源和時間,且在分析過程中可根據實際研究需求,重新選擇時序方向(reverse)和起始狀態(root_state),從而更靈活地探索細胞分化的潛在路徑。
四、技術應用核心場景
單細胞擬時序分析憑借其強大的軌跡構建與動態解析能力,已廣泛應用于多個生命科學研究領域:
發育生物學:解析胚胎與器官發育中細胞分化路徑及調控機制,如還原小鼠胚胎干細胞向三胚層分化軌跡,識別關鍵調控因子;
腫瘤學:揭示腫瘤細胞異質性與分化層級,探索腫瘤干細胞起源擴散,如發現肺癌細胞多表型分化分支,為靶向治療提供依據;
免疫學:追蹤免疫細胞發育成熟與活化軌跡,如T細胞胸腺到外周的分化、B細胞免疫應答中的增殖分化路徑;
再生醫學:評估干細胞移植后分化命運,優化治療方案,如分析間充質干細胞向功能細胞分化軌跡,驗證移植效果。
五、LabEx單細胞測序服務
單細胞擬時序分析作為單細胞測序技術體系中的核心分析模塊,廣泛應用于發育生物學、腫瘤學、免疫學等多個研究領域,為解析細胞分化機制、腫瘤異質性、免疫細胞發育成熟等關鍵科學問題提供了重要的技術支撐。 為助力相關研究的開展,LabEx提供全面的單細胞測序配套服務,涵蓋三大核心服務類型:
1. 單細胞轉錄組測序(ScRNA-seq):在單細胞水平對全mRNA表達譜進行精準檢測,為擬時序分析提供核心數據基礎;
2. 單細胞蛋白檢測(Ab-seq):實現單細胞水平蛋白與基因表達的聯合檢測,屬于多組學研究范疇,可提供人蛋白249個+小鼠蛋白219個的抗體組合,更大panel支持定制化服務;
3. 單細胞免疫組庫測序:通過富集TCR/BCR基因并測序,全面解析免疫組庫多樣性,支持多種屬檢測,為免疫細胞相關的擬時序分析提供專屬解決方案。
同時,LabEx搭建了完整的單細胞研究工作流程,從樣本制備、單細胞分離、基因捕獲、文庫構建、測序到數據分析,配備專業的實驗設備(如美天旎MACS八通道全自動組織處理器、SEOGEO上樣工作站等)和數據分析軟件,提供一站式的技術支持,確保從實驗數據到擬時序分析結果的高效轉化,為科研工作者提供可靠的技術保障。
樂備實是國內專注于提供高質量蛋白檢測以及組學分析服務的實驗服務專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務技術平臺已擴展到單細胞測序、空間多組學、流式檢測、超敏電化學發光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學等30多個,建立起了一套涵蓋基因、蛋白、細胞以及組織水平實驗的完整檢測體系。






