微量WGBS揭示DNA甲基化調控斑馬魚造血干細胞發育的表觀遺傳機制
2025年11月19日,山東大學基礎醫學院艾康博士為第一作者,山東大學基礎醫學院李雷教授和中國醫學科學院血液病醫院王璐研究員為共同通訊作者, 合作研究了脊椎動物胚胎發育中造血干細胞和祖細胞(HSPCs)的表觀遺傳調控機制。具體而言,研究團隊以斑馬魚為模型,結合微量全基因組亞硫酸鹽測序(WGBS)和轉錄組測序(RNA-seq)技術,系統解析了DNA甲基轉移酶Dnmt3ba在造血內皮細胞(HECs)向HSPCs轉化(EHT)過程中的核心作用。
研究發現,Dnmt3ba通過調控整聯蛋白(integrin)(itga3b和itga7)的DNA甲基化水平,影響下游Akt/Mdm2/P53信號通路,從而維持造血內皮細胞(HEC)存活,保障HSPC正常發育。研究團隊進一步在誘導多能干細胞(iPSC)來源的人造血分化體系中驗證了DNMT3B功能的高度保守性,揭示了"Dnmt3ba-Integrin-Akt-Mdm2-P53"軸作為調控EHT的關鍵表觀遺傳-信號轉導耦合機制。該研究不僅深化了對HSPC發育調控網絡的理解,也為體外功能性HSC的生成提供了新的靶點和策略。相關研究成果以“DNA methyltransferase Dnmt3ba-mediated epigenetic modulation of Integrin signaling is essential for hematopoietic stem and progenitor cell development”為題發表于《Communications Biology》期刊。易基因科技為本研究提供微量WGBS技術服務助力揭示DNA甲基轉移酶Dnmt3ba在斑馬魚造血干細胞和祖細胞發育中的關鍵作用。

(DOI:10.1038/S42003-025-09003-W)
本研究證明了在造血內皮細胞(HECs)中高表達DNA甲基轉移酶3ba(Dnmt3ba)在斑馬魚中對調控HEC存活具有關鍵作用。Dnmt3ba缺失導致itgα3b和itgα7位點發生低甲基化,降低了整聯蛋白表達以及下游Akt信號傳導和Mdm2磷酸化,同時通過上調P53活性觸發HEC凋亡。同時,研究者在iPSC來源的人造血分化系統中進行DNMT3B處理發現功能保守性。總體而言,本研究揭示了由Dnmt3ba通過表觀遺傳調控整聯蛋白(integrin)信號來協調HEC存活。
研究方法
1、模型構建:
- 斑馬魚胚胎:CRISPR/Cas9構建dnmt3ba、itga3b、itga7突變體,Morpholino(MO)敲低基因表達,雙熒光標記系特異性標記內皮細胞(ECs)和HECs。
- 人iPSC造血分化模型:模擬人確定性造血過程,驗證基因功能保守性。
2、功能挽救實驗:
- 熱激誘導表達:構建全長和缺失DNA甲基轉移酶結構域質粒,通過Tol2轉座酶系統整合至基因組。24 hpf熱激1小時誘導表達,評估36 hpf時HSPC標記cmyb恢復情況。
- 內皮特異性挽救:使用fli1a啟動子驅動dnmt3ba在ECs中特異性表達,驗證細胞自主性。
3、多組學分析:
- 微量WGBS:對分選的HEC(約5000細胞)進行全基因組甲基化測序,識別差異甲基化區域(DMRs)。 重點分析啟動子(轉錄起始位點上游2 kb)和基因體(gene body)區域的DMRs。
- RNA-seq:Smart-seq2方法分析HEC轉錄組,整合WGBS數據挖掘甲基化-表達關聯基因。
4、功能驗證:
- 體外激活Akt信號(AKT2 CA mRNA)或抑制P53(p53 MO),挽救HEC凋亡表型。
- TUNEL染色、Western blot、qRT-PCR驗證細胞凋亡和信號通路變化。
- 人源驗證:在iPSC分化體系中敲低DNMT3B,通過流式細胞術評估iHSPC生成效率。
研究結果
(1)Dnmt3ba在斑馬魚造血內皮細胞中特異性富集
通過全胚胎原位雜交(WISH)和熒光激活細胞分選(FACS)結合qRT-PCR,發現dnmt3ba在斑馬魚胚胎25-48 hpf階段特異性表達于背主動脈(VDA)的造血內皮細胞(HEC),72 hpf時在尾側造血組織(CHT)富集。FACS分選kdrl+runx1+ HEC證實其表達顯著高于普通內皮細胞,提示Dnmt3ba在HEC發育中的潛在特異性功能。值得注意的是,dnmt3ba在原始紅細胞、動脈發育及神經元中無明顯表達,表明其功能具有細胞類型特異性。該結果為后續功能研究提供了精確的時空定位基礎,也引出了核心科學問題:Dnmt3ba如何通過表觀遺傳重編程決定HEC的命運抉擇。
(2)Dnmt3ba對斑馬魚HSPC發育至關重要
使用MO敲低或CRISPR/Cas9突變dnmt3ba后,HEC(runx1+cmyb+)和HSPC(kdrl+CD41*+)數量在VDA區域顯著減少,但原始紅細胞生成、血管發育未受影響。實時成像顯示突變體EHT過程中HEC轉化效率降低,證實Dnmt3ba特異性調控HEC存活而非早期定向。這一系列實驗確立了Dnmt3ba作為EHT關鍵調控因子的地位,且其作用窗口特異于HEC向HSPC轉化的關鍵階段。
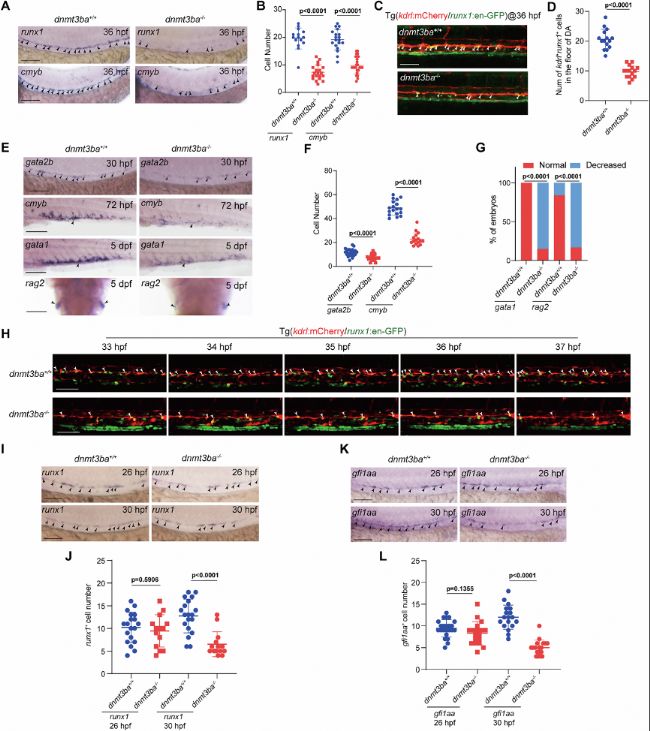
圖1:Dnmt3ba對EHT和HSPC發育至關重要
(3)Dnmt3ba的DNA甲基轉移酶活性是HSPC發育的關鍵
使用DNMT3B抑制劑Nanaomycin A處理胚胎或構建甲基轉移酶結構域缺失突變體(dnmt3baΔDCM),均導致HSPC標志物cmyb表達下降(圖2)。挽救實驗中,僅全長Dnmt3ba可恢復突變體表型,證明其功能依賴甲基化活性。內皮特異性挽救部分恢復HSPC生成,表明Dnmt3ba在ECs中自主發揮作用。這些發現共同確立了Dnmt3ba通過其催化活性調控HSPC發育的分子基礎,為后續探索其下游靶基因提供了因果鏈。
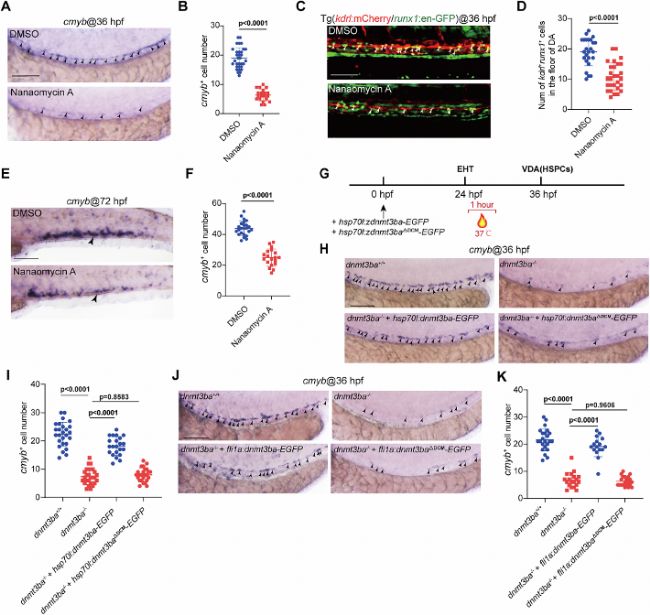
圖2:Dnmt3ba的DNA甲基轉移酶活性參與HSPC發育
(4)dnmt3ba缺失型造血內皮細胞(HECs)的轉錄組分析
為解析Dnmt3ba調控的分子網絡,研究對約5000個分選的HECs進行RNA-seq。差異表達分析鑒定出790個差異表達基因(DEGs)(321個上調,469個下調),提示Dnmt3ba主要作為轉錄激活因子。KEGG富集分析揭示下調基因顯著富集于"ECM-受體互作"和"黏著斑"通路,而上調基因富集于"P53信號通路"和"細胞凋亡"通路,提示Dnmt3ba缺失導致HEC黏附能力受損并觸發凋亡程序。qRT-PCR驗證促凋亡基因cdkn1a、gadd45bb和casp8的上調,TUNEL實驗揭示dnmt3ba-/-胚胎中HEC凋亡率顯著升高,證實P53介導的凋亡是表型核心機制,表明Dnmt3ba通過抑制凋亡維持HEC存活。該轉錄組分析為WGBS靶基因篩選提供了功能線索,特別是將Integrin信號與細胞凋亡關聯起來,為后續機制研究指明了方向。
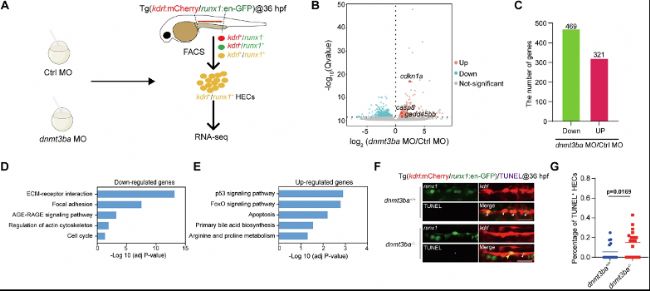
圖3:dnmt3ba缺失的HEC轉錄組分析
(5)整聯蛋白(Integrin)相關基因受Dnmt3ba介導的DNA甲基化調控
對約5000個HECs進行WGBS后,差異甲基化分析顯示dnmt3ba突變體中hypo-DMRs數量遠超hyper-DMRs,且主要富集于基因體區域,這與DNMT3B在哺乳細胞中偏好活躍轉錄基因體的特性一致。整合WGBS與RNA-seq數據,篩選出38個基因體低甲基化且表達下調的候選基因,其中itgα3b、itgα7和lamb2顯著富集于ECM-受體互作通路。qRT-PCR證實itgα3b和itgα7在dnmt3ba缺失HECs中表達顯著降低。為驗證甲基化變化,研究使用靶基因甲基化測序對WGBS鑒定的DMRs進行驗證:在itgα3b和itgα7基因體CpG島,dnmt3ba突變體甲基化率較對照組顯著下降。更關鍵的是,對比ECs與HECs發現,野生型HECs中這兩個位點的甲基化水平顯著高于ECs,表明Dnmt3ba介導的基因體甲基化具有HEC特異性,參與維持itgα3b/itgα7高表達。研究進一步在dnmt3ba-/-胚胎中過表達itgα3b+itgα7雙基因,成功挽救HSPC缺失,確立二者為Dnmt3ba下游功能性效應分子。至此,研究建立起"Dnmt3ba→基因體甲基化→itgα3b/itgα7表達→Integrin信號→HSPC發育"的完整因果鏈。
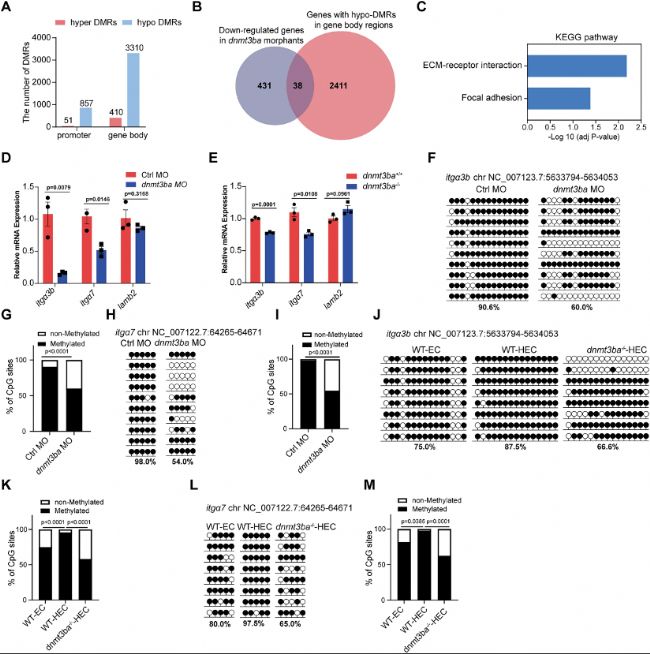
圖4:dnmt3ba缺失降低Integrin信號基因的甲基化和表達水平。
(6)Itga3b和Itga7參與Dnmt3ba調控的HSPC發育
敲低或突變itga3b/itga7后,HEC和HSPC數量減少(圖5),雙敲低呈現協同效應,表明二者功能互補。CRISPR/Cas9構建的itgα3b-/-和itgα7-/-突變體進一步驗證了這一結論。挽救實驗表明外源表達itga3b/itga7 mRNA可恢復HEC數量和HSPC生成,表明Dnmt3ba通過協同調控兩個Integrin α亞基來維持HEC命運。
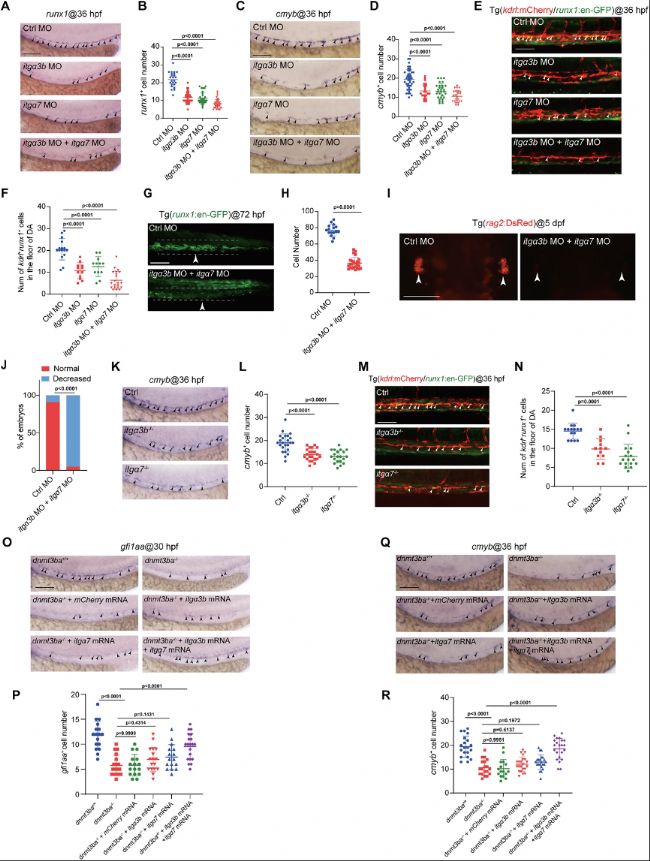
圖5:itgα3b/itgα7缺失介導胚胎中HSPC發育障礙。
(7)Dnmtα3b/Integrin/Akt/Mdm2/P53軸調控HEC存活和HSPC發育
機制上,itga3b/itga7缺失抑制Akt磷酸化和Mdm2活化,導致P53積累并引發HEC凋亡(圖6A-H)。激活Akt或抑制P53均可挽救dnmt3ba突變體的HSPC缺陷(圖6I-M),證實該信號軸是Dnmt3ba調控HEC存活的核心通路。值得注意的是,RNA-seq中FoxO信號通路和細胞骨架調控基因也發生改變,提示可能存在其他平行通路,但Akt-Mdm2-P53軸是核心存活機制。該發現將表觀遺傳調控與經典信號整合,揭示了EHT過程中"表觀-信號-存活"的級聯反應,為理解HSPC發育失敗提供了完整邏輯鏈。
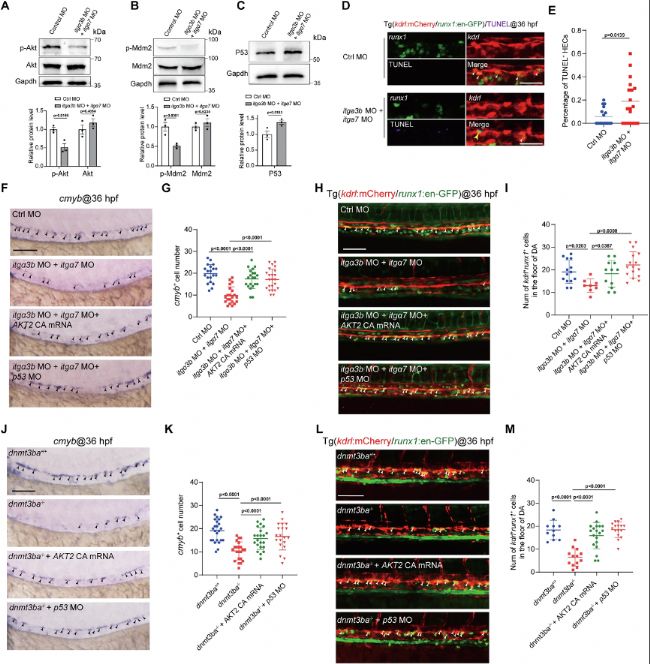
圖6:Integrin信號通過調控Akt和P53通路,調控HSPC發育
(8)DNMT3B在人確定性造血發育中的功能保守
跨物種保守性驗證是機制研究向臨床轉化的關鍵。在人iPSC造血分化體系中,DNMT3B在iHE細胞和iHSPCs中高表達。siRNA敲低DNMT3B后,iHE細胞中ITGA3和ITGA7表達下降,而促凋亡基因CDKN1A、GADD45B、CASP8上調,與斑馬魚表型高度一致。流式分析顯示,DNMT3B敲低導致iHSPCs(CD34+CD90+CD49f+CD38-CD45RA-)比例顯著降低,表明其功能從斑馬魚到人均保守。這一驗證不僅強化了研究結論的普適性,也確立了人EHT過程中"DNMT3B-Integrin-存活信號"軸的存在,為體外HSC生成提供了潛在分子靶點。
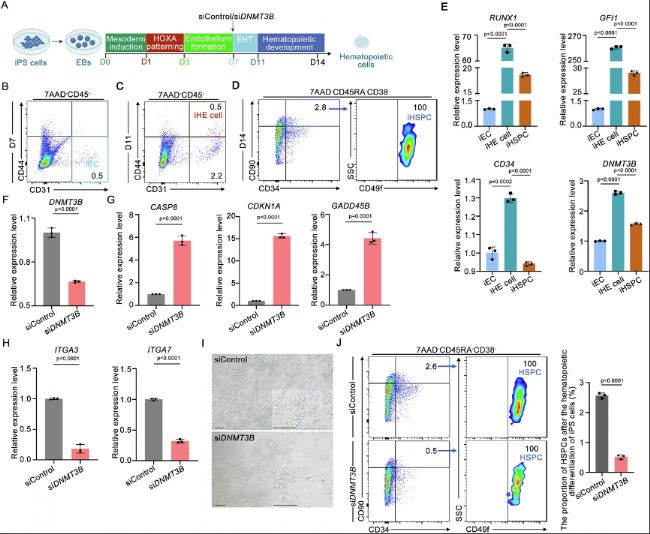
圖7:DNMT3B敲低在體外人體iPS細胞造血分化過程中破壞iHSPC生成
結論和啟示
本研究系統闡釋了Dnmt3ba通過基因體甲基化激活整聯蛋白(integrin)信號、維持HEC存活的新機制,強調了不同DNA甲基轉移酶(如Dnmt1、Dnmt3bb.1)在HSPC發育中的功能特異性。且DNMT3B-Integrin軸在斑馬魚、小鼠和人中功能保守,是造血譜系的古老調控模塊。
參考文獻:
Ai K, Wu Y, Liang G, Kong H, Yang X, Li N, Liu Z, Dong Y, Xu J, Zhang L, Chen X, Fu Y, Wang L, Li L. DNA methyltransferase Dnmt3ba-mediated epigenetic modulation of Integrin signaling is essential for hematopoietic stem and progenitor cell development. Commun Biol. 2025 Nov 19;8(1):1612. doi: 10.1038/s42003-025-09003-w.






