二甲雙胍通過DNA甲基化和羥甲基化雙向調控減輕肝損傷的保護機制
近日,鄭州大學附屬第一醫院重癥醫學科劉峰宇博士和仝然博士為共同第一作者,孫同文教授為通訊作者,首次系統探討了經典降糖藥物二甲雙胍(Metformin)對膿毒癥相關肝損傷(Sepsis-associated liver injury, SLI)的保護作用及其表觀遺傳學機制。研究采用盲腸結扎穿孔術(CLP)誘導的SD膿毒癥大鼠模型,結合RRBS(Reduced Representation Bisulfite Sequencing)與oxRRBS(oxidative RRBS)甲基化測序技術,從全基因組層面揭示CLP誘導的SLI狀態下肝臟組織DNA甲基化(5mC)和羥甲基化(5hmC)圖譜的異常變化,并利用RNA-seq轉錄組分析驗證二甲雙胍通過雙向調控DNMTs/TET2酶活性系統,逆轉異常甲基化修飾,最終改善肝臟炎癥與代謝功能障礙的分子機制。本研究鑒定出受甲基化修飾調控的A1cf和Atxn7l1兩個關鍵差異表達基因,為膿毒癥相關肝損傷的精準治療提供了新的分子靶點和理論依據。相關研究成果以“Metformin attenuated sepsis-related liver injury by modulating the DNA methylation and hydroxymethylation landscape”為題發表于《International Immunopharmacology》期刊。

本研究通過RRBS和oxRRBS全面評估了肝組織中的全基因組DNA甲基化和羥甲基化模式。結果顯示,盲腸結扎穿孔術(CLP)誘導的膿毒癥相關肝損傷(SLI)與全基因組DNA低甲基化和高羥甲基化相關,二甲雙胍干預后可以部分逆轉上述表觀遺傳修飾改變。CLP組中DNA甲基轉移酶(DNMTs)和TET2蛋白的表達水平上調,且受二甲雙胍調控。另外,差異甲基化和羥甲基化基因的功能富集分析顯示其主要參與氧化磷酸化和代謝通路。有趣的是,整合轉錄組數據成功鑒定出兩個關鍵基因A1cf和Atxn7l1,其在CLP中表現為甲基化增加和表達下調,而這些改變可在二甲雙胍干預后逆轉。這些發現為SLI的表觀遺傳機制提供了新見解,并表明二甲雙胍通過調控DNA甲基化和羥甲基化發揮肝臟保護作用。
研究要點

研究方法
動物模型構建:40只成年雄性SD大鼠,分為4組:假手術組(SC)、假手術+二甲雙胍組(SC-MET)、CLP模型組(CLP)、CLP+二甲雙胍組(CLP-MET)。CLP模型通過盲腸結扎穿孔術模擬膿毒癥,二甲雙胍(100 mg/kg)在術后1小時腹腔注射。
肝損傷與炎癥指標檢測:檢測血清中ALT、AST、TNF-α、IL-6、IL-1β水平;肝組織H&E染色評估病理變化(如炎癥浸潤、出血)。
DNA甲基化與羥甲基化分析(RRBS+oxRRBS):肝組織基因組DNA經MspI酶切后,分別進行RRBS和oxRRBS建庫測序,鑒定差異甲基化區域(DMRs)和差異羥甲基化區域(DhMRs)。
功能注釋:通過KEGG富集分析D(h)MRs相關基因的生物學通路。
轉錄組分析(RNA-seq):提取肝組織總RNA,構建cDNA文庫并測序,鑒定差異表達基因(DEGs),并進行KEGG通路富集。
多組學整合分析:交叉比對D(h)MRs與DEGs,篩選受甲基化/羥甲基化調控的關鍵基因(如A1CF、ATXN7L1),并通過Western blot驗證蛋白表達。
結果圖形
(1)二甲雙胍進一步調控CLP引起的全局DNA甲基化/羥甲基化變化
通過RRBS和oxRRBS技術分析發現,CLP組大鼠肝組織表現出全局DNA高甲基化和高羥甲基化,而二甲雙胍干預(CLP-MET組)顯著降低甲基化水平并進一步升高羥甲基化。Western blot結果顯示CLP組DNMT1、DNMT3A、DNMT3B和TET2表達上調,二甲雙胍逆轉了DNMTs表達并進一步促進TET2表達。這表明二甲雙胍通過調控甲基化酶和去甲基化酶活性,重建了SLI中的表觀遺傳譜。

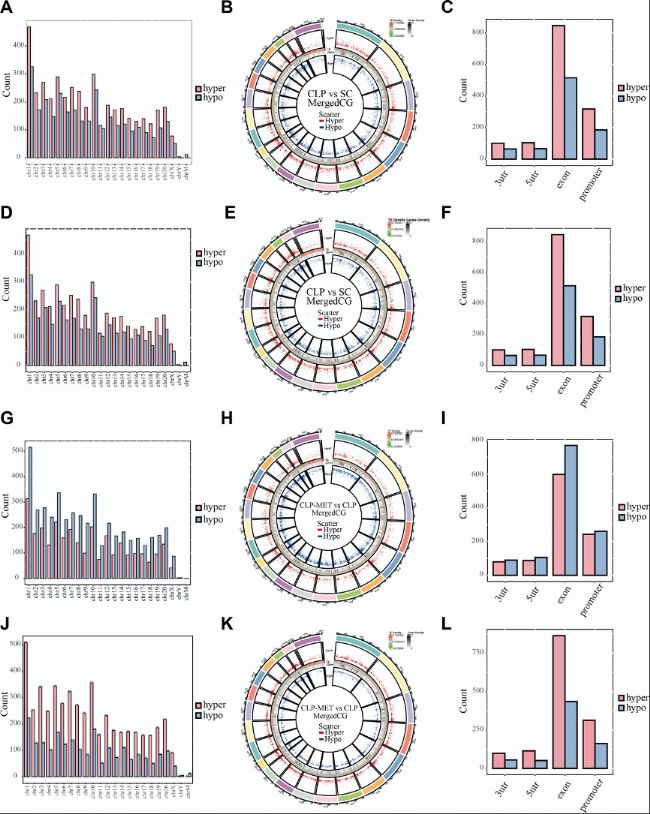
(2)CLP與二甲雙胍作用下差異(羥)甲基化修飾區域的基因注釋
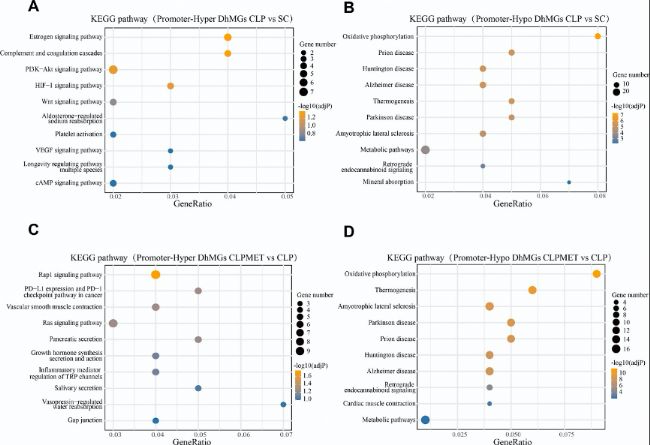
對啟動子區域的D(h)MRs進行KEGG富集分析發現,CLP組的高甲基化DMRs主要富集于氧化磷酸化和代謝通路,而二甲雙胍干預后,高甲基化DMRs轉向富集于腎酸分泌和糖胺聚糖降解等通路。羥甲基化分析顯示類似趨勢,提示二甲雙胍通過調節代謝相關基因的表觀狀態緩解肝損傷。
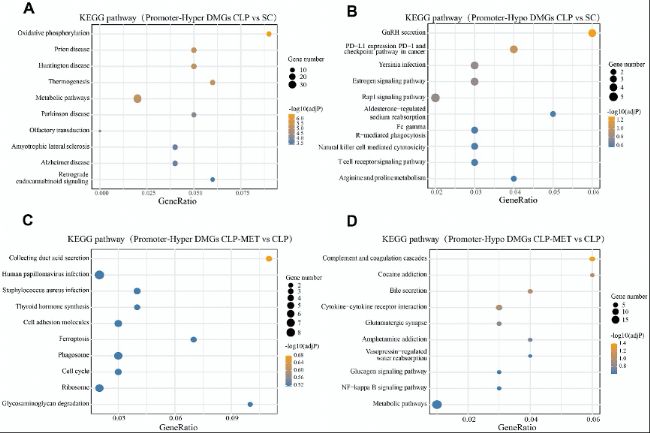
圖3:DMR相關基因的KEGG通路分析。
(3)轉錄組分析揭示二甲雙胍調控的表觀遺傳相關基因表達變化
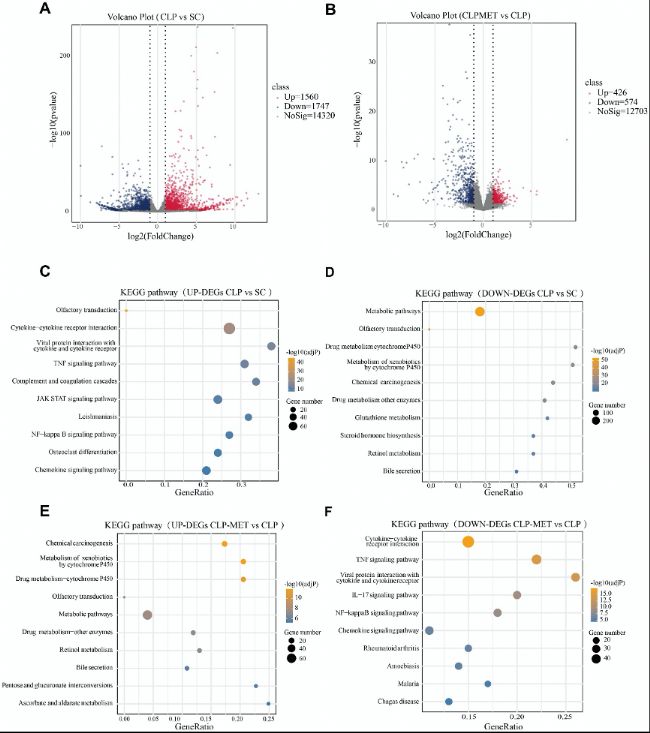
RNA-seq結果顯示,CLP組共有3307個DEGs,其中上調基因富集于TNF、NF-κB等炎癥通路,下調基因富集于代謝通路。二甲雙胍干預后,629個DEGs被逆轉,上調基因轉向代謝通路,下調基因涉及炎癥通路,表明二甲雙胍通過抑制炎癥、促進代謝修復發揮保護作用。
(4)多組學整合鑒定膿毒癥中受甲基化/羥甲基化異常調控的DEGs
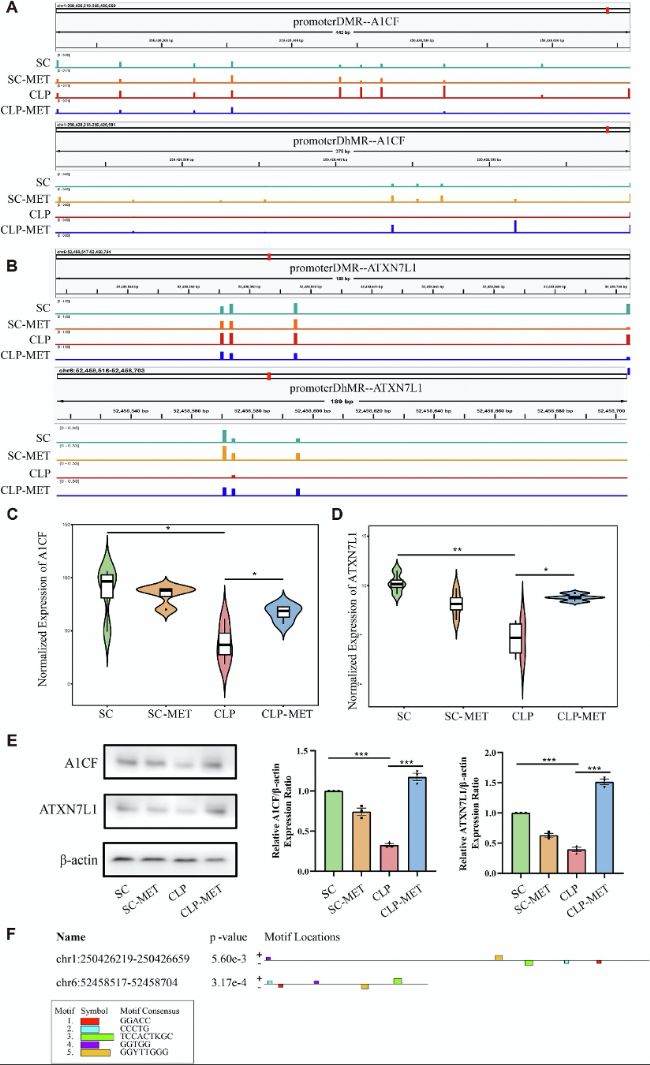
通過交叉分析甲基化、羥甲基化和轉錄組數據,篩選出兩個關鍵基因A1CF和ATXN7L1。CLP組中這兩個基因啟動子甲基化升高、表達下調,而二甲雙胍逆轉了這一趨勢。Western blot驗證其蛋白水平變化一致,提示A1CF和ATXN7L1兩個關鍵基因可能是二甲雙胍表觀遺傳調控的核心靶點。
結論和啟示
本研究首次系統闡明了二甲雙胍通過調節DNA甲基化/羥甲基化平衡緩解SLI的機制,其中主要聚焦其表觀遺傳調控功能,揭示其對DNMTs和TET2的雙向調控作用。具體而言,二甲雙胍通過逆轉CLP誘導的DNA高甲基化、促進羥甲基化,調控關鍵基因(如A1CF、ATXN7L1)表達,最終減輕肝損傷。本研究局限性在于篩選的候選基因(A1CF、ATXN7L1)功能需進一步驗證,且樣本量較小。未來可擴大樣本并開展功能實驗,深化機制研究。
RRBS+oxRRBS技術在本研究中的核心作用
RRBS覆蓋CpG富集區域,oxRRBS特異性識別5hmC,兩者結合實現了全基因組范圍內5mC和5hmC的精準定量,為甲基化/羥甲基化與轉錄組數據的整合提供關鍵數據,直接揭示表觀遺傳修飾與基因表達變化相關性。同時通過D(h)MRs富集分析揭示二甲雙胍調控代謝和炎癥通路的具體靶點,凸顯其在表觀遺傳研究中的不可替代性。
RRBS+oxRRBS組合適用于疾病模型中的表觀機制探索,尤其在代謝性疾病、炎癥和藥物干預研究中,可高效揭示環境-表觀-基因互作網絡。
參考文獻:
Liu F, Tong R, Song H, Gong L, Ding X, Liu H, Li H, Liu L, Wang Y, Zhang R, Sun T. Metformin attenuated sepsis-related liver injury by modulating the DNA methylation and hydroxymethylation landscape. Int Immunopharmacol. 2025 May 7;157:114748.doi: 10.1016/j.intimp.2025.114748.

本研究通過RRBS和oxRRBS全面評估了肝組織中的全基因組DNA甲基化和羥甲基化模式。結果顯示,盲腸結扎穿孔術(CLP)誘導的膿毒癥相關肝損傷(SLI)與全基因組DNA低甲基化和高羥甲基化相關,二甲雙胍干預后可以部分逆轉上述表觀遺傳修飾改變。CLP組中DNA甲基轉移酶(DNMTs)和TET2蛋白的表達水平上調,且受二甲雙胍調控。另外,差異甲基化和羥甲基化基因的功能富集分析顯示其主要參與氧化磷酸化和代謝通路。有趣的是,整合轉錄組數據成功鑒定出兩個關鍵基因A1cf和Atxn7l1,其在CLP中表現為甲基化增加和表達下調,而這些改變可在二甲雙胍干預后逆轉。這些發現為SLI的表觀遺傳機制提供了新見解,并表明二甲雙胍通過調控DNA甲基化和羥甲基化發揮肝臟保護作用。
研究要點
- 二甲雙胍可能通過調控DNA甲基化和羥甲基化圖譜在SLI中發揮肝臟保護作用。
- CLP誘導的SLI與全基因組DNA低甲基化和高羥甲基化相關。
- 二甲雙胍治療可部分逆轉SLI中全基因組DNA甲基化和羥甲基化的變化。
- 差異甲基化和羥甲基化基因參與氧化磷酸化和代謝通路。
- 整合DNA甲基化、羥甲基化和轉錄組數據鑒定出A1CF和ATXN7L1為關鍵基因。

研究方法
動物模型構建:40只成年雄性SD大鼠,分為4組:假手術組(SC)、假手術+二甲雙胍組(SC-MET)、CLP模型組(CLP)、CLP+二甲雙胍組(CLP-MET)。CLP模型通過盲腸結扎穿孔術模擬膿毒癥,二甲雙胍(100 mg/kg)在術后1小時腹腔注射。
肝損傷與炎癥指標檢測:檢測血清中ALT、AST、TNF-α、IL-6、IL-1β水平;肝組織H&E染色評估病理變化(如炎癥浸潤、出血)。
DNA甲基化與羥甲基化分析(RRBS+oxRRBS):肝組織基因組DNA經MspI酶切后,分別進行RRBS和oxRRBS建庫測序,鑒定差異甲基化區域(DMRs)和差異羥甲基化區域(DhMRs)。
功能注釋:通過KEGG富集分析D(h)MRs相關基因的生物學通路。
轉錄組分析(RNA-seq):提取肝組織總RNA,構建cDNA文庫并測序,鑒定差異表達基因(DEGs),并進行KEGG通路富集。
多組學整合分析:交叉比對D(h)MRs與DEGs,篩選受甲基化/羥甲基化調控的關鍵基因(如A1CF、ATXN7L1),并通過Western blot驗證蛋白表達。
結果圖形
(1)二甲雙胍進一步調控CLP引起的全局DNA甲基化/羥甲基化變化
通過RRBS和oxRRBS技術分析發現,CLP組大鼠肝組織表現出全局DNA高甲基化和高羥甲基化,而二甲雙胍干預(CLP-MET組)顯著降低甲基化水平并進一步升高羥甲基化。Western blot結果顯示CLP組DNMT1、DNMT3A、DNMT3B和TET2表達上調,二甲雙胍逆轉了DNMTs表達并進一步促進TET2表達。這表明二甲雙胍通過調控甲基化酶和去甲基化酶活性,重建了SLI中的表觀遺傳譜。

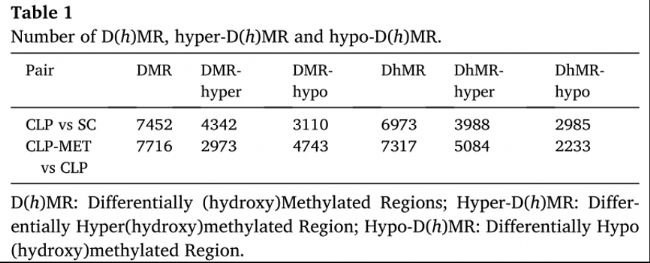
表1:D(h)MR、hyper-D(h)MR 和 hypo-D(h)MR 數量

圖1:二甲雙胍在CLP相關SLI下調控DNA甲基化和羥甲基化譜。

圖2:組間D(h)MR。
(2)CLP與二甲雙胍作用下差異(羥)甲基化修飾區域的基因注釋
對啟動子區域的D(h)MRs進行KEGG富集分析發現,CLP組的高甲基化DMRs主要富集于氧化磷酸化和代謝通路,而二甲雙胍干預后,高甲基化DMRs轉向富集于腎酸分泌和糖胺聚糖降解等通路。羥甲基化分析顯示類似趨勢,提示二甲雙胍通過調節代謝相關基因的表觀狀態緩解肝損傷。

圖3:DMR相關基因的KEGG通路分析。

圖4:DhMRs相關基因的KEGG通路分析。
(3)轉錄組分析揭示二甲雙胍調控的表觀遺傳相關基因表達變化
RNA-seq結果顯示,CLP組共有3307個DEGs,其中上調基因富集于TNF、NF-κB等炎癥通路,下調基因富集于代謝通路。二甲雙胍干預后,629個DEGs被逆轉,上調基因轉向代謝通路,下調基因涉及炎癥通路,表明二甲雙胍通過抑制炎癥、促進代謝修復發揮保護作用。

圖5:在RNA表達中檢測到的基因。
(4)多組學整合鑒定膿毒癥中受甲基化/羥甲基化異常調控的DEGs
通過交叉分析甲基化、羥甲基化和轉錄組數據,篩選出兩個關鍵基因A1CF和ATXN7L1。CLP組中這兩個基因啟動子甲基化升高、表達下調,而二甲雙胍逆轉了這一趨勢。Western blot驗證其蛋白水平變化一致,提示A1CF和ATXN7L1兩個關鍵基因可能是二甲雙胍表觀遺傳調控的核心靶點。

圖6:A1CF和ATXN7L1的表達。
結論和啟示
本研究首次系統闡明了二甲雙胍通過調節DNA甲基化/羥甲基化平衡緩解SLI的機制,其中主要聚焦其表觀遺傳調控功能,揭示其對DNMTs和TET2的雙向調控作用。具體而言,二甲雙胍通過逆轉CLP誘導的DNA高甲基化、促進羥甲基化,調控關鍵基因(如A1CF、ATXN7L1)表達,最終減輕肝損傷。本研究局限性在于篩選的候選基因(A1CF、ATXN7L1)功能需進一步驗證,且樣本量較小。未來可擴大樣本并開展功能實驗,深化機制研究。
RRBS+oxRRBS技術在本研究中的核心作用
RRBS覆蓋CpG富集區域,oxRRBS特異性識別5hmC,兩者結合實現了全基因組范圍內5mC和5hmC的精準定量,為甲基化/羥甲基化與轉錄組數據的整合提供關鍵數據,直接揭示表觀遺傳修飾與基因表達變化相關性。同時通過D(h)MRs富集分析揭示二甲雙胍調控代謝和炎癥通路的具體靶點,凸顯其在表觀遺傳研究中的不可替代性。
RRBS+oxRRBS組合適用于疾病模型中的表觀機制探索,尤其在代謝性疾病、炎癥和藥物干預研究中,可高效揭示環境-表觀-基因互作網絡。
參考文獻:
Liu F, Tong R, Song H, Gong L, Ding X, Liu H, Li H, Liu L, Wang Y, Zhang R, Sun T. Metformin attenuated sepsis-related liver injury by modulating the DNA methylation and hydroxymethylation landscape. Int Immunopharmacol. 2025 May 7;157:114748.doi: 10.1016/j.intimp.2025.114748.
標簽:
DNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






