文獻解讀:產前重金屬暴露通過改變表觀遺傳修飾調控胎盤血管生成機制
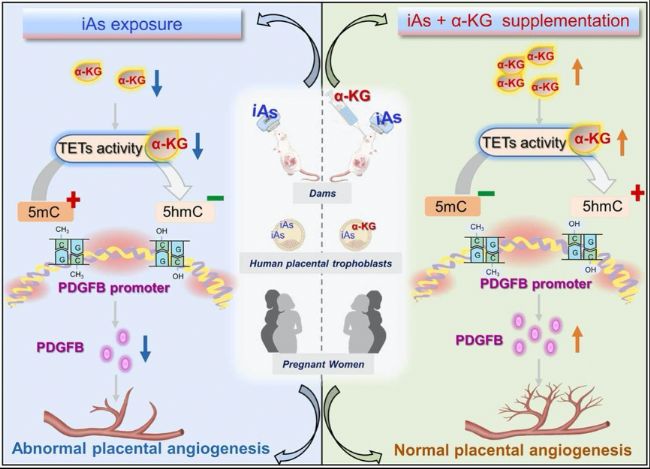
近日,安徽醫科大學公共衛生學院衛生毒理學系徐德祥教授團隊在環境科學領域國際權威期刊《Journal of Hazardous Materials》發表題為“Prenatal arsenic exposure disrupts placental angiogenesis by altering Pdgfb promoter epigenetic modification”的科研成果。本研究系統闡明了產前砷(Arsenic,As)暴露通過抑制胎盤血管生成關鍵因子PDGFB的表達致使胎盤血管發育異常及胎兒生長受限的機制。具體而言,砷暴露通過降低TCA循環代謝物 α-酮戊二酸(α-KG) 含量和抑制 TET酶活性,改變Pdgfb基因啟動子區域的DNA甲基化(5mC)和羥甲基化(5hmC)修飾,從而下調PDGFB表達,最終破壞胎盤血管生成功能。此外,研究還發現α-KG補充可以恢復砷誘導的Pdgfb表觀遺傳修飾異常,并改善胎盤血管生成和胎兒生長受限。本研究結合細胞實驗、動物模型和人群隊列驗證,首次提出“α-KG/TET/Pdgfb”軸的表觀遺傳重編程是砷致胎盤毒性的關鍵。

標題:Prenatal arsenic exposure disrupts placental angiogenesis by altering Pdgfb promoter epigenetic modification(產前砷暴露通過改變 Pdgfb 啟動子表觀遺傳修飾來破壞胎盤血管生成)
發表時間:2025年8月15日
發表期刊:Journal of Hazardous Materials
影響因子:IF11.3/Q1
技術平臺:代謝組學分析、RNA-seq、DNA羥甲基化測序(ACE-seq)等(易基因金牌技術)
作者單位:安徽醫科大學衛生毒理學系
DOI:10.1016/j.jhazmat.2025.138736
本研究旨在探討產前砷(As)暴露對胎盤血管生成及其關鍵機制的影響。研究者在大鼠妊娠期間通過口飼亞砷酸鈉(NaAsO2)進行砷暴露處理,且利用HTR8/SVneo細胞系建立體外模型,并通過RNA-seq測序以鑒定關鍵調控因子。同時,使用多組學方法檢測關鍵調控因子的DNA甲基化和DNA羥甲基化水平,并采用代謝組學方法尋找潛在機制。結果顯示,砷暴露減少了小鼠胎盤血管的直徑和數量,并削弱了HTR8/SVneo細胞系的內皮樣管狀形成能力。此外,RNA-seq鑒定出血小板衍生生長因子b(Pdgfb)為此過程中的關鍵調控因子。具體而言,砷暴露通過抑制TET活性改變Pdgfb的甲基化和羥甲基化,從而下調PDGFB表達。代謝組學分析表明,砷暴露下調了TCA循環代謝物α-KG,可能介導TET活性抑制。對小鼠和細胞進行α-KG補充可改善砷誘導的Pdgfb甲基化和羥甲基化變化,改善砷誘導的血管生成能力減弱,并防止小鼠胎兒生長受限。有趣的是,在病例對照研究中,母體血清α-KG含量和胎盤PDGFB含量與尿液砷濃度呈負相關,而胎盤PDGFB含量與出生體重呈正相關。總體而言,產前砷暴露通過改變Pdgfb的表觀遺傳編程損害胎盤血管生成。
- 砷暴露因PDGFB表達下調而減弱小鼠胎盤和人類滋養層細胞的血管生成。
- 砷暴露通過抑制TET活性誘導Pdgfb表觀遺傳修飾改變。
- 砷暴露下調TCA循環代謝物α-KG,從而抑制TET活性。
- α-KG補充改善砷誘導的Pdgfb表觀遺傳修飾改變和血管生成能力。
本研究采用了一系列實驗方法來探討產前砷暴露對胎盤血管生成的影響及其機制。
動物實驗:使用CD-1小鼠,通過在飲用水中添加NaAsO2(15mg/L)模擬產前砷暴露,觀察其對胎盤血管生成的影響。實驗組小鼠從妊娠第0.5天(GD0.5)開始飲用含NaAsO2的水,直至妊娠第18.5天(GD18.5)。
細胞實驗:使用HTR8/SVneo細胞系(一種人胎盤滋養層細胞系)建立體外模型,研究砷暴露對細胞血管生成能力的影響。細胞分別暴露于不同濃度的NaAsO2(0.02 μM、0.2 μM、2 μM)和不同時間(4天、8天、12天)。
RNA-seq:對砷處理的HTR8/SVneo細胞系進行RNA-seq測序,篩選出與血管生成相關的差異表達基因。通過GO分析和KEGG分析,進一步探討這些基因的功能和信號通路。
表觀遺傳修飾檢測:檢測Pdgfb基因啟動子區域的DNA甲基化水平,使用ACE-seq技術檢測DNA羥甲基化水平,分析砷暴露對Pdgfb基因啟動子表觀遺傳修飾的影響。
代謝組學分析:通過UPLC-MS/MS檢測細胞和胎盤中的代謝物含量,特別是α-KG TCA循環相關代謝物,揭示砷暴露對細胞代謝的影響,以及這些代謝變化如何影響表觀遺傳修飾。
TET活性檢測:評估砷暴露對TET活性的影響。
α-KG補充實驗:在砷暴露的HTR8/SVneo細胞系和小鼠中添加二甲基-α-KG(Dm-αKG)或α-KG,觀察其對Pdgfb表觀遺傳修飾和血管生成能力的改善效果。
病例對照研究:從TIMFEM出生隊列中選取樣本,分析孕婦尿液中砷濃度與胎盤基因組甲基化和羥甲基化水平、胎盤PDGFB含量及出生體重之間的相關性。
結果圖形
(1)砷暴露下調小鼠胎盤和HTR8/SVneo細胞系中的PDGFB表達
RNA-seq發現砷處理組301個基因下調,144個上調,GO分析顯示PDGFB富集于血管生成相關通路。RT-PCR和免疫印跡驗證PDGFB在砷暴露的胎盤和細胞中表達均降低,提示PDGFB是砷抑制血管生成的核心靶點。

為揭示砷誘導的PDGFB下調的潛在原因,研究人員分析了Pdgfb啟動子的甲基化和羥甲基化模式。
在HTR8/SVneo細胞系中,Pdgfb啟動子有4個富含CpG片段。結果顯示,砷處理的HTR8/SVneo細胞系中第三個片段的甲基化水平增加。
接下來,研究人員分析了砷暴露對HTR8/SVneo細胞系Pdgfb羥甲基化的影響。檢測到Pdgfb啟動子的第二個、第三個和第四個片段的羥甲基化水平。其中,第二個和第三個片段的羥甲基化水平在砷處理的HTR8/SVneo細胞系中降低,其中6個位于CpG位點。
在小鼠胎盤中,Pdgfb啟動子有3個富含CpG的片段。結果顯示,砷暴露小鼠胎盤中Pdgfb基因的三個片段的甲基化水平無差異。火山圖顯示,砷暴露小鼠胎盤中59個CpG位點的甲基化水平未改變,但3個CpG位點甲基化水平降低,1個CpG位點甲基化水平增加。
接下來,研究人員分析了小鼠胎盤的Pdgfb羥甲基化。結果檢測到Pdgfb啟動子的第一個和第二個片段羥甲基化水平。其中,第二個片段的羥甲基化水平在砷暴露小鼠胎盤中降低。

二甲基-α-KG(Dm-αKG)是一種細胞可滲透的α-KG類似物。研究人員分析了Dm-αKG對砷處理的HTR8/SVneo細胞系中Pdgfb甲基化模式的影響。結果顯示,Dm-αKG緩解了砷誘導的Pdgfb基因第三個片段的甲基化上調。隨后,研究人員評估了Dm-αKG對Pdgfb羥甲基化的影響。結果顯示,砷處理的HTR8/SVneo細胞系中第二個和第三個片段的羥甲基化水平降低。Dm-αKG處理逆轉了砷誘導的Pdgfb基因第三個片段的羥甲基化降低。
接下來,研究人員觀察了Dm-αKG對Pdgfb mRNA和蛋白的影響。結果顯示,Dm-αKG緩解了砷誘導的Pdgfb mRNA和蛋白下調。最后,研究人員分析了Dm-αKG對管狀形成能力的影響。結果顯示,Dm-αKG處理改善了砷誘導的內皮樣管狀形成障礙。此外,Transwell遷移實驗和傷口愈合實驗顯示,Dm-αKG處理緩解了砷誘導的遷移抑制。
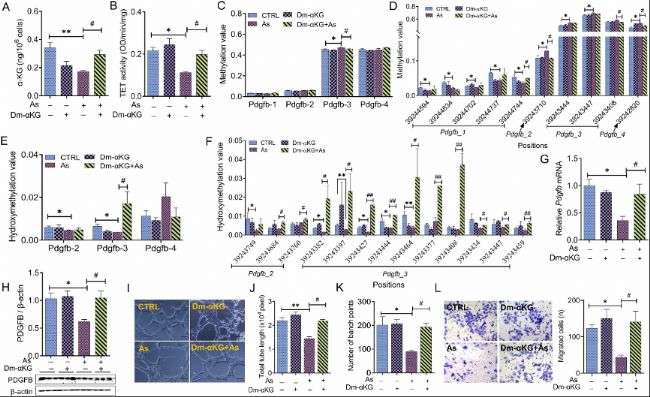
(4)母體α-KG補充可改善砷暴露小鼠胎盤中Pdgfb的甲基化和羥甲基化以及胎盤血管生成能力
研究人員分析了α-KG補充對砷暴露小鼠胎盤中Pdgfb啟動子甲基化水平的影響。結果顯示,不同組之間Pdgfb基因的三個片段的甲基化水平無差異。與砷暴露小鼠相比,α-KG補充小鼠胎盤中4個CpG位點甲基化水平下調。
接下來,研究人員分析了α-KG補充對Pdgfb羥甲基化水平的影響。結果顯示,砷誘導的Pdgfb基因第二個片段的羥甲基化水平降低在α-KG補充小鼠胎盤中得到逆轉。同時,研究人員檢測了α-KG補充對胎盤PDGFB蛋白的影響。免疫印跡和ELISA實驗顯示,α-KG補充緩解了砷誘導的PDGFB下調。
此外,研究人員評估了母體α-KG補充對胎盤發育和胎兒生長的影響。結果顯示,α-KG補充緩解了砷誘導的迷宮區面積減少,以及迷宮區與連接區厚度比降低。同時,α-KG補充緩解了砷誘導的迷宮區血竇面積減少。免疫組化實驗顯示,α-KG補充緩解了砷誘導的CD34+血管數量和血管直徑減少。免疫印跡實驗顯示,α-KG補充恢復了砷誘導的胎盤CD34、VEGF、MCT1和MCT4蛋白水平的下調。最后,研究人員評估了α-KG補充對胎兒發育的影響。結果顯示,砷暴露小鼠的胎兒體重和冠臀長顯著降低。而α-KG補充緩解了砷誘導的胎兒體重和冠臀長的減少。相關性分析顯示,胎盤重量與胎兒體重呈正相關。

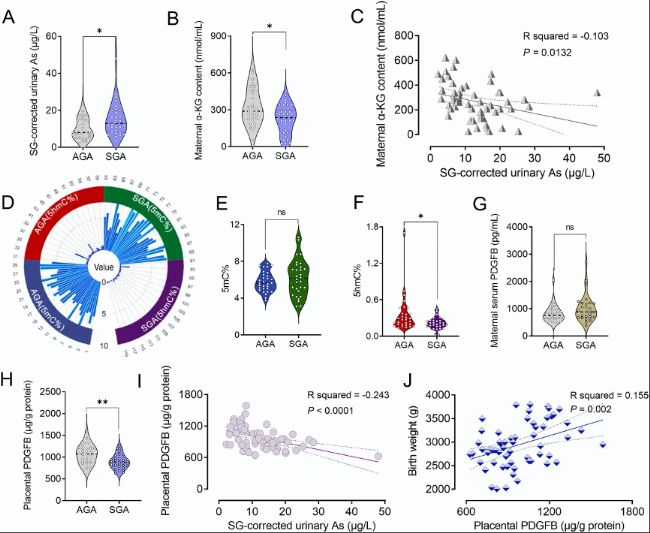
(5)病例對照研究:母體尿液砷濃度、胎盤基因組甲基化和羥甲基化水平、胎盤PDGFB含量與出生體重之間的關聯
研究人員分析了中國合肥“通過多點暴露監測改善母嬰健康(TIMFEM)”出生隊列中的樣本,評估了母體尿液砷濃度與胎盤基因組甲基化和羥甲基化水平、胎盤PDGFB含量及出生體重之間的關聯。結果顯示,小于胎齡兒(small for gestational age , SGA)嬰兒的母體尿液砷濃度高于適于胎齡兒(appropriate for gestational age,AGA)嬰兒。
SGA嬰兒的母體血清α-KG含量低于AGA嬰兒,母體尿液砷濃度與血清α-KG含量呈顯著負相關。胎盤基因組5mC在AGA和SGA嬰兒之間無差異,但SGA嬰兒的胎盤基因組5hmC顯著低于AGA嬰兒。此外,SGA嬰兒的胎盤PDGFB含量低于AGA嬰兒。進一步分析顯示,母體尿液砷濃度與胎盤PDGFB含量呈顯著負相關,胎盤PDGFB含量與胎兒出生體重呈正相關。
結論和啟示
研究揭示了砷暴露對胎盤血管生成的抑制作用,并闡明了其潛在的分子機制,即砷暴露通過抑制TET活性和α-KG含量,改變Pdgfb基因啟動子的甲基化和羥甲基化模式,作用PDGFB表達下調,最終抑制胎盤血管生成。
ACE-seq技術在本研究中發揮了關鍵作用,主要用于檢測Pdgfb基因啟動子區域的DNA羥甲基化水平。通過ACE-seq,研究人員能夠精準分析砷暴露對Pdgfb基因啟動子羥甲基化模式的影響。該技術的優勢在于能夠高通量、高精度地檢測DNA修飾狀態,尤其是在研究表觀遺傳修飾變化對基因表達調控的影響方面。在本研究中,ACE-seq技術幫助揭示了砷暴露如何通過改變Pdgfb基因啟動子的羥甲基化模式來影響PDGFB的表達,從而為理解砷暴露對胎盤血管生成的破壞性提供了重要分子機制。
參考文獻:
Zhang Y, Song YP, Wu HY, Zhong FJ, Xue H, Fan YJ, Zhang C, Xu DX. Prenatal arsenic exposure disrupts placental angiogenesis by altering Pdgfb promoter epigenetic modification. J Hazard Mater. 2025 May 26;494:138736. doi: 10.1016/j.jhazmat.2025.138736.






