文獻解讀:腸-肺軸介導的m6A修飾調控腫瘤抑制新機制
大家好,這里是專注表觀組學十余年,領跑多組學科研服務的易基因。
近日,山東第一醫科大學附屬腫瘤醫院(山東省腫瘤醫院)/山東省精準腫瘤學重點實驗室宋倩博士等為第一作者、陳大衛研究員和于金明院士共同通訊作者,在《Cell Reports》期刊上發表題為“Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid”的研究論文,研究揭示了非小細胞肺癌(NSCLC)患者腸道菌群的顯著變化,特別是動物雙歧桿菌(Bifidobacterium animalis,簡稱B. animalis)在NSCLC患者糞便中顯著減少。研究綜合多種實驗模型和分析方法,發現B. animalis及其代謝產物吲哚-3-乙酸(indole-3-acetic acid,簡稱IAA)通過腸-肺軸共同抑制NSCLC進展。具體而言,B. animalis來源的IAA激活宿主芳香烴受體(AHR),抑制METTL3介導的m6A甲基化修飾,進而抑制STAT3和IL-6表達,最終增強抗腫瘤免疫反應。該研究不僅為NSCLC的預防和治療提供了新視角,還強調了腸道菌群及其代謝產物在癌癥發生和發展中的重要作用。深圳易基因為本研究提供m6A甲基化測序(MeRIP-seq)技術服務,助力揭示B. animalis和IAA抑制NSCLC進展的表觀轉錄組調控機制。

發表期刊:Cell Reports
影響因子:IF6.9/Q1
技術平臺:宏基因組測序、代謝組學、MeRIP-seq、RNA-seq
作者單位:山東第一醫科大學附屬腫瘤醫院(山東省腫瘤醫院)/山東省精準腫瘤學重點實驗室
DOI:10.1016/j.celrep.2025.116132
近年相關研究表明,腸道菌群及其代謝產物在NSCLC發生發展中具有重要作用。本研究發現,NSCLC患者與健康對照者的腸道菌群組成存在顯著差異,尤其動物雙歧桿菌(B. animalis)在NSCLC患者中顯著減少。B. animalis在兩種NSCLC小鼠模型和NSCLC細胞系中均能抑制腫瘤進展,研究整合代謝組學進一步揭示,吲哚-3-乙酸(IAA) 是B. animalis的關鍵代謝物,存在顯著抗NSCLC活性。具體而言,B. animalis及其IAA通過激活肺部芳香烴受體(AHR),抑制METTL3介導的STAT3 m6A甲基化;同時通過抑制IL-6減少M2型巨噬細胞極化并增強CD8+ T細胞功能,從而通過腸-肺軸調節抗腫瘤免疫。B. animalis與IAA的補充為NSCLC預防提供了潛在策略。
核心發現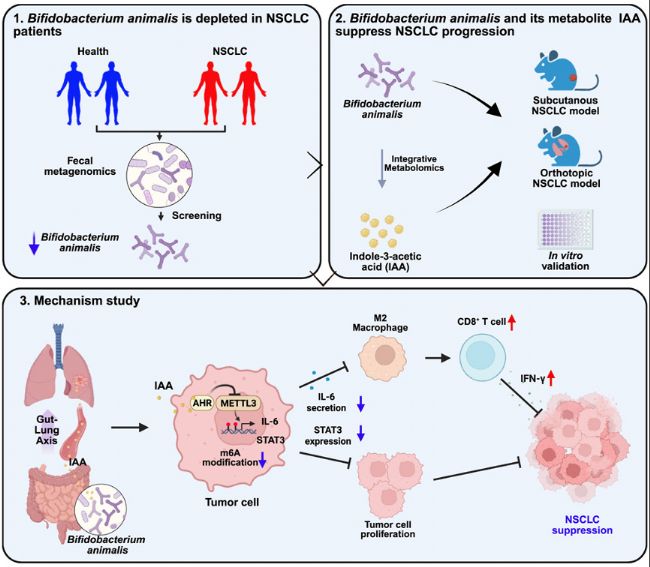
研究摘要
研究方法
研究方法部分涉及多項實驗技術,包括臨床樣本分析、動物模型構建、細胞實驗和分子生物學檢測。
微生物組學測序:收集27例NSCLC患者和29例健康對照的糞便樣本,進行宏基因組測序以比較腸道菌群組成;16S rRNA測序和PCR驗證B. animalis豐度變化。
動物模型實驗:皮下接種LLC細胞的異種移植模型和原位注射CMT167-Luc細胞的原位模型,通過灌胃給予B. animalis或其代謝產物IAA,評估腫瘤體積、重量和免疫細胞浸潤。
細胞實驗:在體外培養的NSCLC細胞中,測試B. animalis條件培養基(Ba-CM)和IAA對細胞增殖、凋亡、周期和蛋白表達的影響。
代謝組學:非靶向和靶向代謝物分析,鑒定B. animalis產生的關鍵代謝產物。
m6A測序(MeRIP-seq):分析B. animalis和IAA對NSCLC細胞中m6A修飾的影響。
此外還使用分子對接、表面等離子共振(SPR)結合實驗、RT-qPCR、Western blot和流式細胞術等技術驗證分子互作和免疫調節。
結果圖形
(1)B. animalis在NSCLC患者糞便樣本中減少
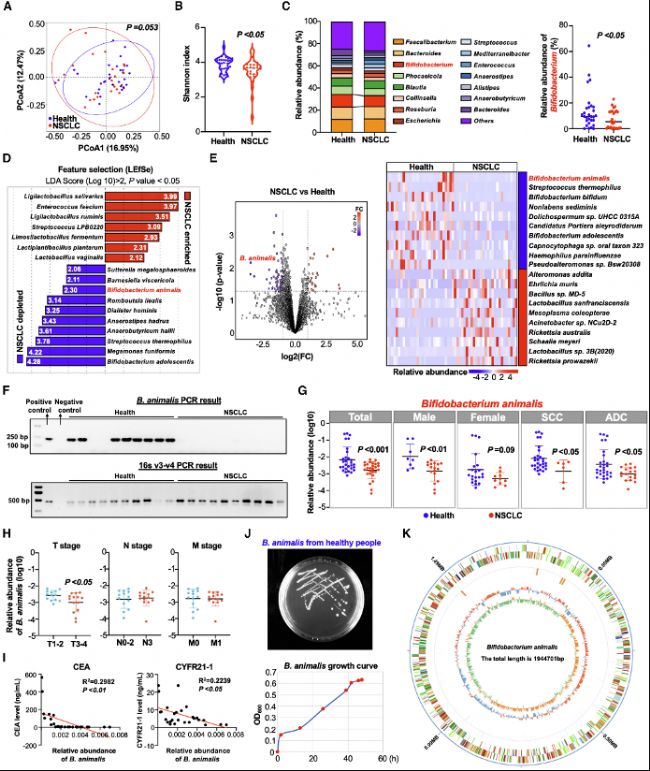
本研究通過宏基因組學分析發現,NSCLC患者腸道菌群多樣性降低,且B. animalis在患者組中顯著缺失。主坐標分析(PCoA)顯示患者與健康對照的微生物組成存在差異,而線性判別分析(LEfSe)進一步確認B. animalis是NSCLC相關的缺失菌種。通過PCR驗證,B. animalis在患者糞便中的豐度與腫瘤標志物(如CEA和CYFR21-1)呈負相關,提示其可能作為NSCLC的生物標志物。這一結果奠定了研究的基礎,表明腸道菌群失調與NSCLC發生相關。
(2)從健康人糞便中分離的B. animalis抑制NSCLC腫瘤發生
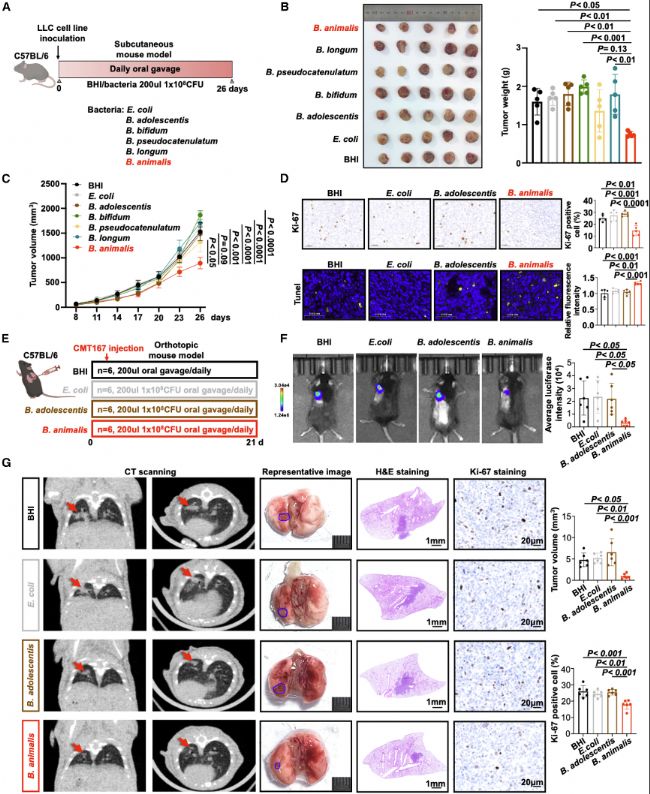
在小鼠模型中,通過口服給予B. animalis,研究發現其能顯著抑制NSCLC腫瘤的進展,表現為腫瘤體積和重量的減少。此外,B. animalis處理組小鼠腫瘤組織中細胞增殖標志物Ki-67表達降低,TUNEL陽性細胞增加,表明B. animalis抑制腫瘤細胞增殖并促進細胞凋亡。體外實驗顯示,Ba-CM處理抑制A549和PC9細胞生長,并誘導G1/S期阻滯和凋亡。這些數據表明B. animalis具有直接的抗腫瘤效應,且其作用優于其他細菌對照。
(3)B. animalis產生IAA作為其功能性腫瘤抑制代謝物
代謝組學分析發現,Ba-CM中吲哚類代謝物顯著富集,其中IAA是B. animalis的關鍵產物。在無菌小鼠模型中,灌胃B. animalis后,IAA在糞便、血清和肺組織中均升高,證實IAA能通過腸-肺軸轉運至肺部。體外實驗表明,IAA直接抑制NSCLC細胞增殖,其效應與Ba-CM相似,提示IAA是B. animalis發揮功能的主要介質。
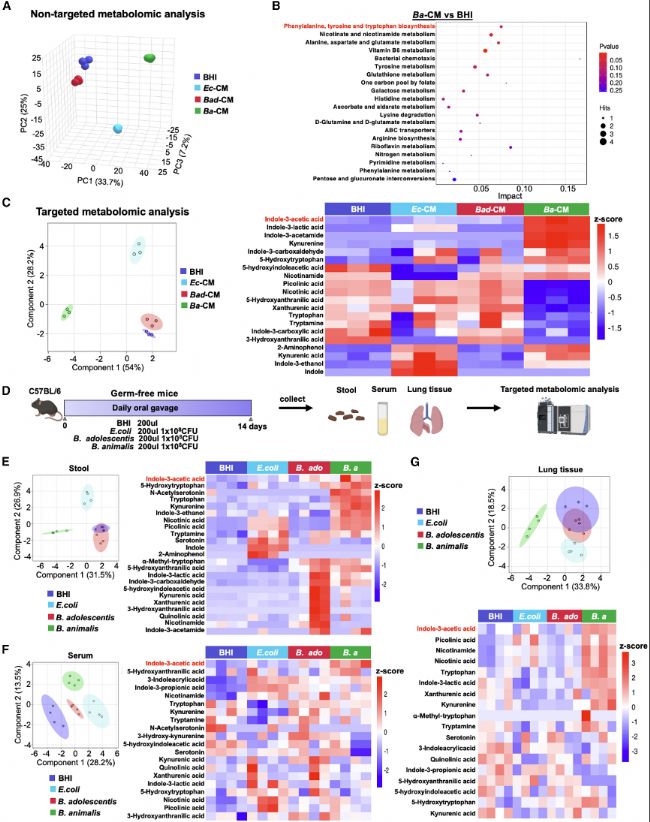
(4)IAA在體內外模擬B. animalis效應
在CMT167原位和和皮下NSCLC小鼠模型中,IAA處理顯著抑制腫瘤生長,表現為腫瘤熒光強度減弱和腫瘤體積縮小。體外實驗也證實IAA能抑制NSCLC細胞的增殖,促進細胞周期阻滯和凋亡,并下調增殖相關蛋白(如PCNA和cyclin D1)的表達。這些結果驗證了IAA能復制B. animalis的抗腫瘤作用,強調了代謝物在機制中的核心地位。
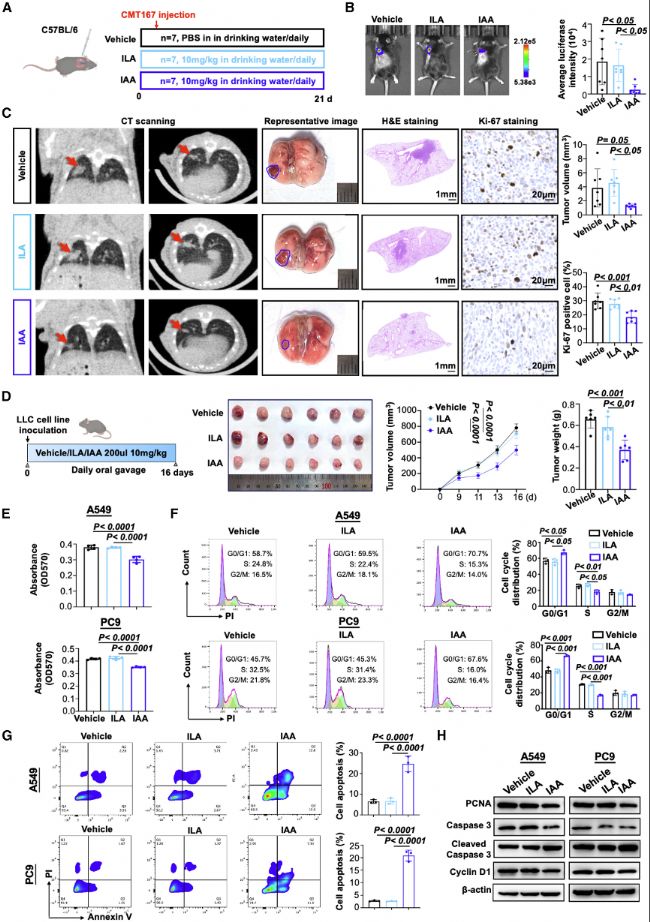
(5)B. animalis和IAA通過減少METTL3介導的m6A修飾以抑制STAT3表達
通過RNA-seq測序和m6A測序(MeRIP-seq),研究發現B. animalis和IAA處理的NSCLC細胞中METTL3表達下調,m6A修飾減少,特別是STAT3 mRNA的m6A修飾顯著降低。
RNA-seq分析顯示,B. animalis處理介導METTL3表達下調。而m6A MeRIP-seq進一步證實Ba-CM處理導致全基因組m6A peaks減少,尤其是在STAT3 mRNA中,表明METTL3介導的m6A甲基化被抑制,導致STAT3表達下降,從而抑制腫瘤細胞增殖。RNA-seq和MeRIP-seq整合分析表明B. animalis和IAA通過抑制METTL3介導的m6A修飾抑制STAT3表達。
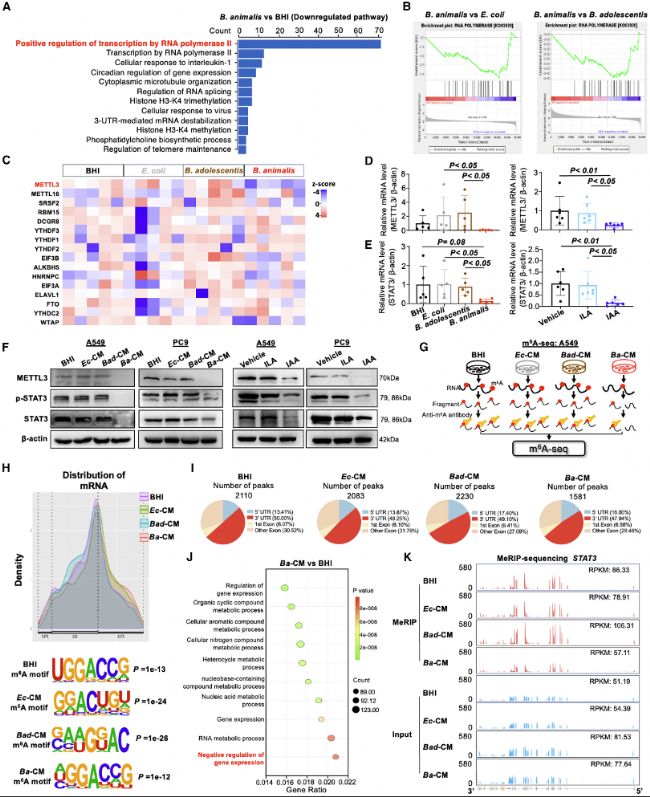
圖5:B.animalis及其代謝產物IAA通過減少METTL3介導的m6A修飾以抑制STAT3表達
(A-B) RNA-seq揭示B.animalis組中RNA聚合酶相關通路顯著減少(每組n=5)。
(C) RNA-seq顯示B.animalis處理組中METTL3下調。
(D) 在LLC皮下小鼠模型中,RT-qPCR發現B.animalis(n=5)和IAA(n=6)抑制METTL3。
(E) RT-qPCR發現LLC皮下小鼠模型中B.animalis和IAA抑制STAT3。
(F) Western blot證實A549和PC9細胞系中Ba-CM和IAA顯著抑制METTL3、STAT3和p-STAT3。
(G) m6A-seq流程圖。
(H) 在A549細胞中,經Ba-CM、Ec-CM、Bad-CM或BHI處理后,m6A peaks在mRNA的5'UTR、CDS和3'UTR的歸一化分布及特定的m6A motif(GGAC)。
(I) 經Ba-CM、Ec-CM、Bad-CM或BHI處理的A549細胞中m6A peaks數量。
(J) 與BHI處理細胞相比,Ba-CM處理細胞中差異m6A甲基化基因富集分析。
(K) 在BHI、Ec-CM、Bad-CM和Ba-CM中,STAT3的歸一化m6A reads密度水平。Ba-CM處理后STAT3 mRNA的m6A peaks顯著減少。
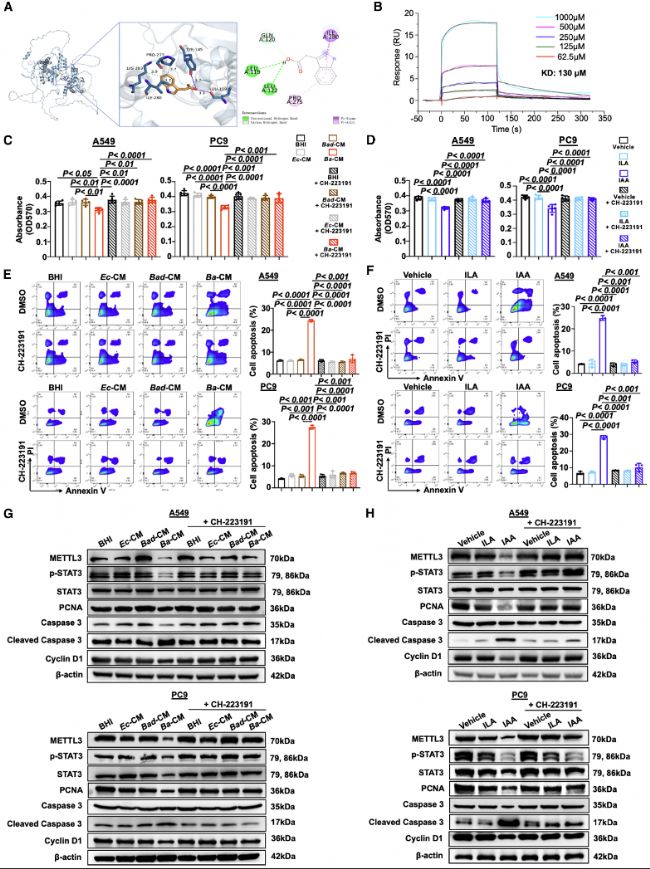
(6)IAA激活AHR以通過METTL3/STAT3軸抑制NSCLC進展
分子對接和SPR實驗證實IAA能與AHR受體結合。HR抑制劑CH-223191部分抵消了B. animalis和IAA的抗腫瘤效果。Western blot分析顯示,AHR抑制后,METTL3、STAT3和p-STAT3表達恢復,證實了AHR/METTL3/STAT3軸通路。這一結果將微生物信號與宿主表觀遺傳調控聯系起來,突出了IAA-AHR互作的中心角色。
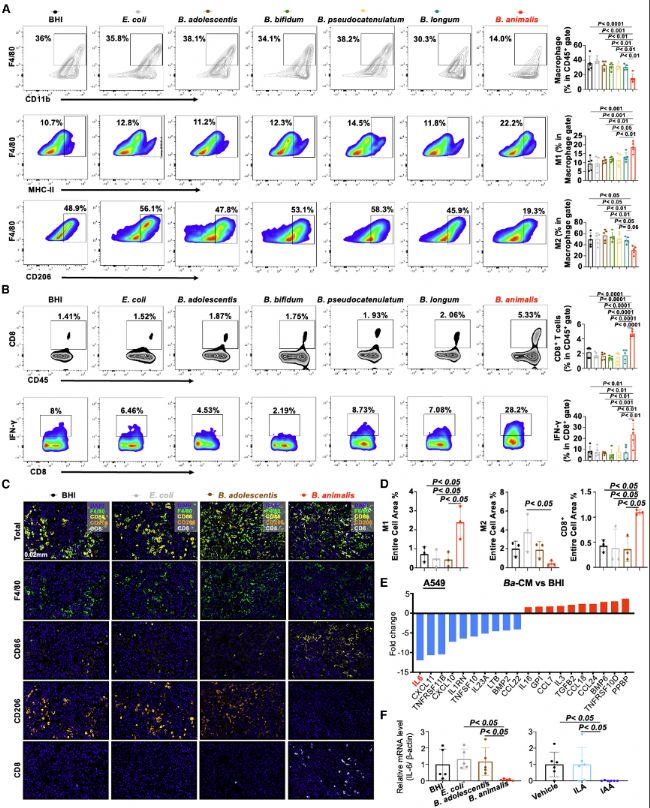
(7)B. animalis和IAA增強抗腫瘤免疫以抑制NSCLC進展
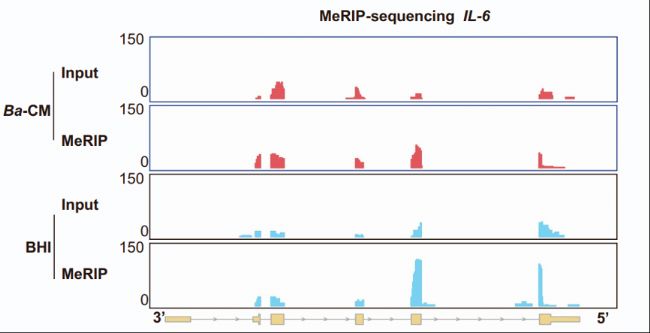
通過流式細胞術和多色免疫組化,研究發現B. animalis和IAA處理減少腫瘤相關巨噬細胞(TAMs)的M2極化,增加M1型TAMs和CD8+ T細胞浸潤。具體而言,Ba-CM抑制IL-6表達,而m6A-seq顯示IL-6 mRNA m6A修飾減少,表明B. animalis通過調節IL-6來改善免疫微環境。CD8+ T細胞耗竭實驗增強CD8+ T細胞的細胞毒性功能。這些結果表明B. animalis和IAA通過增強抗腫瘤免疫反應抑制NSCLC。
結論和啟示
本研究揭示了NSCLC患者中腸道菌群的顯著變化,特別是B. animalis的顯著減少。研究通過多種實驗模型和分析方法,證實了B. animalis及其代謝產物IAA通過腸-肺軸抑制NSCLC進展。具體而言,B. animalis代謝產物IAA激活宿主AHR受體,抑制METTL3介導的m6A修飾,進而抑制STAT3和IL-6表達,最終增強抗腫瘤免疫反應。
MeRIP-seq技術在本研究中的重要作用
通過m6A甲基化測序,研究者詳細分析了B. animalis和IAA對NSCLC細胞中m6A修飾的影響。研究發現,B. animalis和IAA處理的細胞中METTL3表達下調,m6A修飾減少,特別是STAT3 mRNA的m6A修飾顯著降低。這些結果不僅揭示了B. animalis和IAA抑制NSCLC進展的分子機制,還強調了m6A修飾在腫瘤發生中的重要作用。
參考文獻:
Song Q, Li X, Li Q, Shang S, Ma S, Zhai Z, Sun F, Mo Y, Wei L, Wu M, Ma Y, Yu J, Chen D. Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid. Cell Rep. 2025 Aug 12;44(8):116132.doi: 10.1016/j.celrep.2025.116132.
近日,山東第一醫科大學附屬腫瘤醫院(山東省腫瘤醫院)/山東省精準腫瘤學重點實驗室宋倩博士等為第一作者、陳大衛研究員和于金明院士共同通訊作者,在《Cell Reports》期刊上發表題為“Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid”的研究論文,研究揭示了非小細胞肺癌(NSCLC)患者腸道菌群的顯著變化,特別是動物雙歧桿菌(Bifidobacterium animalis,簡稱B. animalis)在NSCLC患者糞便中顯著減少。研究綜合多種實驗模型和分析方法,發現B. animalis及其代謝產物吲哚-3-乙酸(indole-3-acetic acid,簡稱IAA)通過腸-肺軸共同抑制NSCLC進展。具體而言,B. animalis來源的IAA激活宿主芳香烴受體(AHR),抑制METTL3介導的m6A甲基化修飾,進而抑制STAT3和IL-6表達,最終增強抗腫瘤免疫反應。該研究不僅為NSCLC的預防和治療提供了新視角,還強調了腸道菌群及其代謝產物在癌癥發生和發展中的重要作用。深圳易基因為本研究提供m6A甲基化測序(MeRIP-seq)技術服務,助力揭示B. animalis和IAA抑制NSCLC進展的表觀轉錄組調控機制。

標題:Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid(動物雙歧桿菌通過吲哚-3-乙酸抑制肺癌進展并調節腫瘤免疫)
發表時間:2025年8月26日發表期刊:Cell Reports
影響因子:IF6.9/Q1
技術平臺:宏基因組測序、代謝組學、MeRIP-seq、RNA-seq
作者單位:山東第一醫科大學附屬腫瘤醫院(山東省腫瘤醫院)/山東省精準腫瘤學重點實驗室
DOI:10.1016/j.celrep.2025.116132
近年相關研究表明,腸道菌群及其代謝產物在NSCLC發生發展中具有重要作用。本研究發現,NSCLC患者與健康對照者的腸道菌群組成存在顯著差異,尤其動物雙歧桿菌(B. animalis)在NSCLC患者中顯著減少。B. animalis在兩種NSCLC小鼠模型和NSCLC細胞系中均能抑制腫瘤進展,研究整合代謝組學進一步揭示,吲哚-3-乙酸(IAA) 是B. animalis的關鍵代謝物,存在顯著抗NSCLC活性。具體而言,B. animalis及其IAA通過激活肺部芳香烴受體(AHR),抑制METTL3介導的STAT3 m6A甲基化;同時通過抑制IL-6減少M2型巨噬細胞極化并增強CD8+ T細胞功能,從而通過腸-肺軸調節抗腫瘤免疫。B. animalis與IAA的補充為NSCLC預防提供了潛在策略。
核心發現
- B. animalis在非小細胞肺癌(NSCLC)患者的糞便中顯著減少。
- B. animalis通過其代謝產物IAA和腸-肺軸抑制NSCLC的進展。
- B. animalis代謝產物IAA通過AHR/METTL3/STAT3軸抑制NSCLC。
- B. animalis和IAA改善NSCLC中的腫瘤免疫。

研究摘要
研究方法
研究方法部分涉及多項實驗技術,包括臨床樣本分析、動物模型構建、細胞實驗和分子生物學檢測。
微生物組學測序:收集27例NSCLC患者和29例健康對照的糞便樣本,進行宏基因組測序以比較腸道菌群組成;16S rRNA測序和PCR驗證B. animalis豐度變化。
動物模型實驗:皮下接種LLC細胞的異種移植模型和原位注射CMT167-Luc細胞的原位模型,通過灌胃給予B. animalis或其代謝產物IAA,評估腫瘤體積、重量和免疫細胞浸潤。
細胞實驗:在體外培養的NSCLC細胞中,測試B. animalis條件培養基(Ba-CM)和IAA對細胞增殖、凋亡、周期和蛋白表達的影響。
代謝組學:非靶向和靶向代謝物分析,鑒定B. animalis產生的關鍵代謝產物。
m6A測序(MeRIP-seq):分析B. animalis和IAA對NSCLC細胞中m6A修飾的影響。
此外還使用分子對接、表面等離子共振(SPR)結合實驗、RT-qPCR、Western blot和流式細胞術等技術驗證分子互作和免疫調節。
結果圖形
(1)B. animalis在NSCLC患者糞便樣本中減少
本研究通過宏基因組學分析發現,NSCLC患者腸道菌群多樣性降低,且B. animalis在患者組中顯著缺失。主坐標分析(PCoA)顯示患者與健康對照的微生物組成存在差異,而線性判別分析(LEfSe)進一步確認B. animalis是NSCLC相關的缺失菌種。通過PCR驗證,B. animalis在患者糞便中的豐度與腫瘤標志物(如CEA和CYFR21-1)呈負相關,提示其可能作為NSCLC的生物標志物。這一結果奠定了研究的基礎,表明腸道菌群失調與NSCLC發生相關。

圖1:NSCLC患者與健康個體的微生物群落譜
(2)從健康人糞便中分離的B. animalis抑制NSCLC腫瘤發生
在小鼠模型中,通過口服給予B. animalis,研究發現其能顯著抑制NSCLC腫瘤的進展,表現為腫瘤體積和重量的減少。此外,B. animalis處理組小鼠腫瘤組織中細胞增殖標志物Ki-67表達降低,TUNEL陽性細胞增加,表明B. animalis抑制腫瘤細胞增殖并促進細胞凋亡。體外實驗顯示,Ba-CM處理抑制A549和PC9細胞生長,并誘導G1/S期阻滯和凋亡。這些數據表明B. animalis具有直接的抗腫瘤效應,且其作用優于其他細菌對照。

圖2:B. animalis在體內和體外抑制NSCLC腫瘤發生
(3)B. animalis產生IAA作為其功能性腫瘤抑制代謝物
代謝組學分析發現,Ba-CM中吲哚類代謝物顯著富集,其中IAA是B. animalis的關鍵產物。在無菌小鼠模型中,灌胃B. animalis后,IAA在糞便、血清和肺組織中均升高,證實IAA能通過腸-肺軸轉運至肺部。體外實驗表明,IAA直接抑制NSCLC細胞增殖,其效應與Ba-CM相似,提示IAA是B. animalis發揮功能的主要介質。

圖3:細菌上清液和無菌小鼠的代謝組分析鑒定出IAA是B.animalis的主要代謝物
(4)IAA在體內外模擬B. animalis效應
在CMT167原位和和皮下NSCLC小鼠模型中,IAA處理顯著抑制腫瘤生長,表現為腫瘤熒光強度減弱和腫瘤體積縮小。體外實驗也證實IAA能抑制NSCLC細胞的增殖,促進細胞周期阻滯和凋亡,并下調增殖相關蛋白(如PCNA和cyclin D1)的表達。這些結果驗證了IAA能復制B. animalis的抗腫瘤作用,強調了代謝物在機制中的核心地位。

圖4:IAA在原位和皮下NSCLC小鼠模型中均抑制腫瘤生長
(5)B. animalis和IAA通過減少METTL3介導的m6A修飾以抑制STAT3表達
通過RNA-seq測序和m6A測序(MeRIP-seq),研究發現B. animalis和IAA處理的NSCLC細胞中METTL3表達下調,m6A修飾減少,特別是STAT3 mRNA的m6A修飾顯著降低。
RNA-seq分析顯示,B. animalis處理介導METTL3表達下調。而m6A MeRIP-seq進一步證實Ba-CM處理導致全基因組m6A peaks減少,尤其是在STAT3 mRNA中,表明METTL3介導的m6A甲基化被抑制,導致STAT3表達下降,從而抑制腫瘤細胞增殖。RNA-seq和MeRIP-seq整合分析表明B. animalis和IAA通過抑制METTL3介導的m6A修飾抑制STAT3表達。

圖5:B.animalis及其代謝產物IAA通過減少METTL3介導的m6A修飾以抑制STAT3表達
(C) RNA-seq顯示B.animalis處理組中METTL3下調。
(D) 在LLC皮下小鼠模型中,RT-qPCR發現B.animalis(n=5)和IAA(n=6)抑制METTL3。
(E) RT-qPCR發現LLC皮下小鼠模型中B.animalis和IAA抑制STAT3。
(F) Western blot證實A549和PC9細胞系中Ba-CM和IAA顯著抑制METTL3、STAT3和p-STAT3。
(G) m6A-seq流程圖。
(H) 在A549細胞中,經Ba-CM、Ec-CM、Bad-CM或BHI處理后,m6A peaks在mRNA的5'UTR、CDS和3'UTR的歸一化分布及特定的m6A motif(GGAC)。
(I) 經Ba-CM、Ec-CM、Bad-CM或BHI處理的A549細胞中m6A peaks數量。
(J) 與BHI處理細胞相比,Ba-CM處理細胞中差異m6A甲基化基因富集分析。
(K) 在BHI、Ec-CM、Bad-CM和Ba-CM中,STAT3的歸一化m6A reads密度水平。Ba-CM處理后STAT3 mRNA的m6A peaks顯著減少。
(6)IAA激活AHR以通過METTL3/STAT3軸抑制NSCLC進展
分子對接和SPR實驗證實IAA能與AHR受體結合。HR抑制劑CH-223191部分抵消了B. animalis和IAA的抗腫瘤效果。Western blot分析顯示,AHR抑制后,METTL3、STAT3和p-STAT3表達恢復,證實了AHR/METTL3/STAT3軸通路。這一結果將微生物信號與宿主表觀遺傳調控聯系起來,突出了IAA-AHR互作的中心角色。

圖6:IAA通過激活AHR抑制METTL3/STAT3軸,進而抑制NSCLC進展
(7)B. animalis和IAA增強抗腫瘤免疫以抑制NSCLC進展
通過流式細胞術和多色免疫組化,研究發現B. animalis和IAA處理減少腫瘤相關巨噬細胞(TAMs)的M2極化,增加M1型TAMs和CD8+ T細胞浸潤。具體而言,Ba-CM抑制IL-6表達,而m6A-seq顯示IL-6 mRNA m6A修飾減少,表明B. animalis通過調節IL-6來改善免疫微環境。CD8+ T細胞耗竭實驗增強CD8+ T細胞的細胞毒性功能。這些結果表明B. animalis和IAA通過增強抗腫瘤免疫反應抑制NSCLC。

圖7:B. animalis通過抑制IL-6調節抗腫瘤免疫以抑制NSCLC進展

圖8:m6A MeRIP-seq測序分析顯示,Ba-CM顯著減少IL-6 mRNA的m6A peaks。
結論和啟示
本研究揭示了NSCLC患者中腸道菌群的顯著變化,特別是B. animalis的顯著減少。研究通過多種實驗模型和分析方法,證實了B. animalis及其代謝產物IAA通過腸-肺軸抑制NSCLC進展。具體而言,B. animalis代謝產物IAA激活宿主AHR受體,抑制METTL3介導的m6A修飾,進而抑制STAT3和IL-6表達,最終增強抗腫瘤免疫反應。
MeRIP-seq技術在本研究中的重要作用
通過m6A甲基化測序,研究者詳細分析了B. animalis和IAA對NSCLC細胞中m6A修飾的影響。研究發現,B. animalis和IAA處理的細胞中METTL3表達下調,m6A修飾減少,特別是STAT3 mRNA的m6A修飾顯著降低。這些結果不僅揭示了B. animalis和IAA抑制NSCLC進展的分子機制,還強調了m6A修飾在腫瘤發生中的重要作用。
參考文獻:
Song Q, Li X, Li Q, Shang S, Ma S, Zhai Z, Sun F, Mo Y, Wei L, Wu M, Ma Y, Yu J, Chen D. Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid. Cell Rep. 2025 Aug 12;44(8):116132.doi: 10.1016/j.celrep.2025.116132.
標簽:
RNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com