阿爾茨海默癥海馬體的單細胞空間轉錄組圖譜揭示分子通路及診斷新靶點

期刊:Neuron
影響因子:14.7
主要技術:Stereo-seq,snRNA-seq
摘要
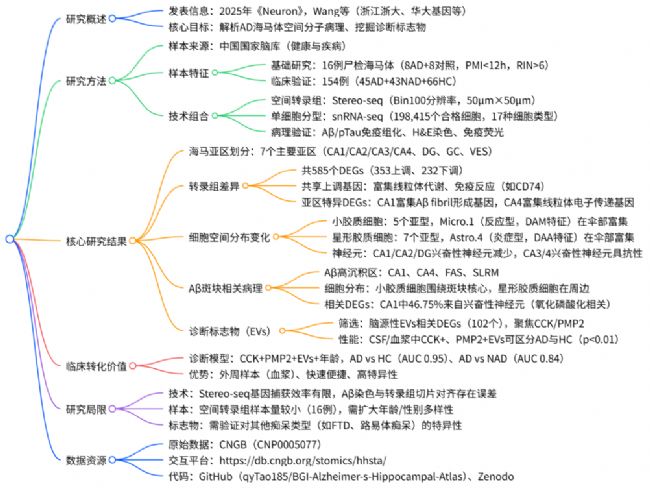
浙江大學醫學院附屬第一醫院章京教授和浙江大學醫學院段樹民院士團隊于2025年3月在Neuron上在線發表了文章Molecular Pathways and Diagnosis in Spatially Resolved Alzheimer’s Hippocampal Atlas,該研究通過空間轉錄組技術(Stereo-seq) 結合單核RNA測序(snRNA-seq),首次構建了人類海馬體的單細胞空間轉錄組圖譜,系統揭示了阿爾茨海默病(AD)中海馬體各亞區的基因表達、細胞分布及功能通路變化,并首次提出血漿中外泌體攜帶的CCK與PMP2蛋白可作為AD診斷新型生物標志物。
主要技術
Stereo-seq,snRNA-seq
背景
阿爾茨海默病(AD)作為最常見的癡呆類型,其核心病理特征 ——β 淀粉樣蛋白(Aβ)斑塊沉積與神經原纖維纏結(NFT)—— 已被研究數十年,但靶向這些病理蛋白的療法效果有限,甚至伴隨嚴重副作用。問題的關鍵在于,以往 AD 海馬體研究多依賴小鼠模型,且缺乏 “單細胞分辨率 + 空間位置 + 病理特征” 的多維度整合分析,難以揭示人類 AD 的真實病理機制。
研究方法
多模態技術構建 “空間 - 細胞 - 病理” 三維圖譜,技術路線圍繞 “空間解析 + 單細胞分型 + 病理關聯” 設計(圖 1A)。
基礎研究階段:16 例尸檢海馬體樣本,其中 8 例為中晚期 AD,8 例為年齡、性別匹配的健康對照(無癡呆、無海馬病理),所有樣本均滿足 “死后間隔(PMI)<12 小時 + RNA 完整性(RIN)>6”,確保數據可靠性;
臨床驗證階段:154 例受試者,包括 45 例 AD、43 例非 AD 癡呆(NAD,含血管性癡呆、路易體癡呆等)、66 例健康對照(HC),AD 與 NAD 均經腦脊液(CSF)或 PET-CT 驗證,確保診斷準確性。
核心技術:
Stereo-seq:提供 50μm×50μm(Bin100)的高空間分辨率與全轉錄組覆蓋,生成 32 張海馬體切片的空間基因表達數據,首次實現人類海馬體 7 個主要亞區的精準劃分;
snRNA-seq:解離 500μm 海馬切片獲取細胞核,最終得到 198,415 個合格細胞,聚類為 17 種細胞類型;
病理驗證:通過 Aβ/pTau 免疫組化確認 AD 病理,H&E 染色輔助亞區定位,免疫熒光驗證小膠質細胞 / 星形膠質細胞的空間分布,實現 “空間轉錄組 - 病理特征” 的精準對齊。
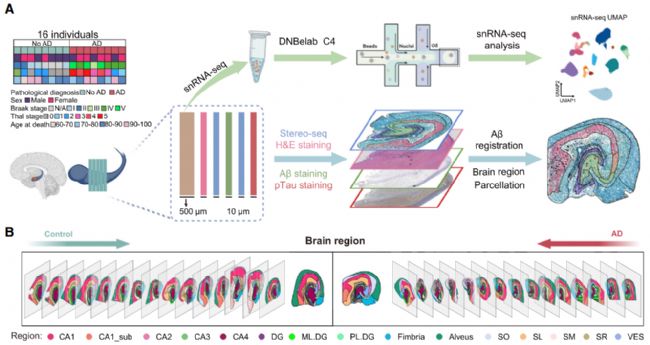
圖1
文章思維導圖
核心發現
1. AD相關的基因表達變化和細胞分布
差異分析得到585 個 AD 相關 DEGs:全海馬體紊亂與亞區特異損傷并存,對 Stereo-seq 數據進行亞區水平差異分析,共鑒定出 585 個 AD 相關差異表達基因(DEGs),其中 353 個上調、232 個下調,可分為 “共享 DEGs” 與 “亞區特異 DEGs”(圖 2A、2B):共享上調 DEGs(87 個):富集線粒體電子傳遞、氧化磷酸化、免疫反應通路,如炎癥基因 CD74 在全海馬體上調,提示 AD 存在全局能量代謝紊亂與神經炎癥;共享下調 DEGs(28 個):集中在細胞黏附(如 NRXN3)與線粒體功能(如 MT-RNR2),反映 AD 中細胞連接破壞與線粒體損傷。(圖2A,B)
CA1 亞區:作為 Aβ 沉積最嚴重的區域,富集 Aβ 纖維形成相關基因(如 SPON1、DYRK1A),且興奮性神經元(EX-CA1)數量顯著減少,其蛋白折疊通路下調、凋亡通路上調(如 DDIT3),直接導致神經元選擇性損傷;CA4 亞區:擁有最多特異 DEGs,且富集線粒體電子傳遞鏈基因(如 ATP1A3),提示 CA4 可能通過代謝代償抵抗 AD 病理,這也解釋了為何 CA4 神經元數量在 AD 中基本不受影響;傘部(FAS 亞區):突觸修剪通路顯著上調,補體系統基因(如 C3、C1QB)在該區域高表達(圖 2E、2F),且小膠質細胞與星形膠質細胞的異常互作(如 SPP1-ITGB1 配體 - 受體結合)強化了突觸修剪,導致突觸結構紊亂,而傘部是海馬體與其他腦區的纖維連接通路,其功能異常直接破壞記憶信號傳遞。
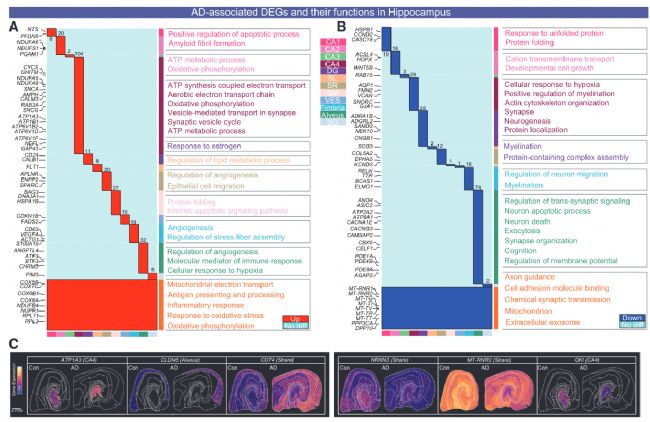
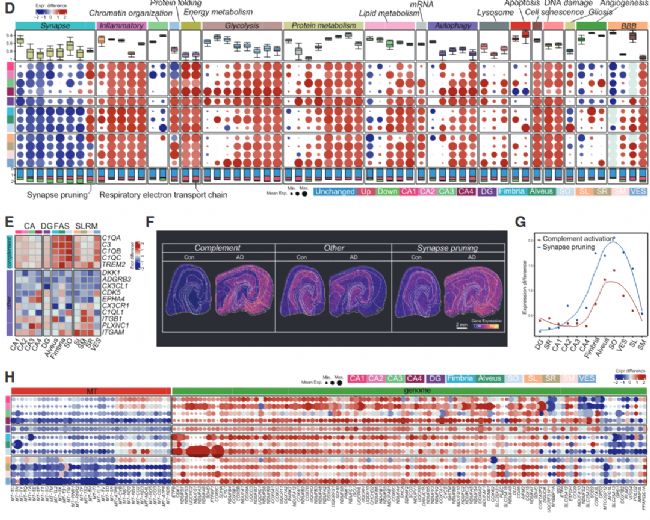
圖2
2. 細胞空間重構:膠質細胞 “抱團活化”,神經元 “選擇性死亡”
通過 Spatial-ID 算法將 snRNA-seq 的細胞類型映射到 Stereo-seq 的空間位置,研究發現 AD 中海馬體細胞的分布與互作存在顯著重構(圖 3A、3B):小膠質細胞的 “反應型富集”:聚類為 5 個亞型,其中 Micro.1(高表達補體基因 C3/C1QB)為疾病相關小膠質細胞(DAM),其在傘部的比例顯著升高(AD vs 對照,p<0.01),且圍繞 Aβ 斑塊核心分布(0-40μm 范圍內密度最高),主要參與免疫反應與細胞殺傷(圖 3G、3H、4L);星形膠質細胞的 “炎癥型聚集”:聚類為 7 個亞型,Astro.4(高表達炎癥基因 VIM、CCL2)為疾病相關星形膠質細胞(DAA),同樣在傘部富集,且與 Micro.1 的距離 <100μm 時,兩者的炎癥相關互作(如 MIF-CD44)顯著增強,形成 “膠質細胞炎癥灶”(圖 3M、3O),神經元的 “選擇性損失”:CA1、CA2、DG 的興奮性神經元(EX-CA1、EX-CA2、EX-DG)密度顯著降低,而 CA3/4 的興奮性神經元(EX-CA3/4)數量穩定,且其金屬離子穩態通路上調(如 QKI),提示 EX-CA3/4 具 AD 抗性 —— 這一差異可能是 AD 患者早期記憶損傷(依賴 CA1/DG)而非完全記憶喪失的原因。
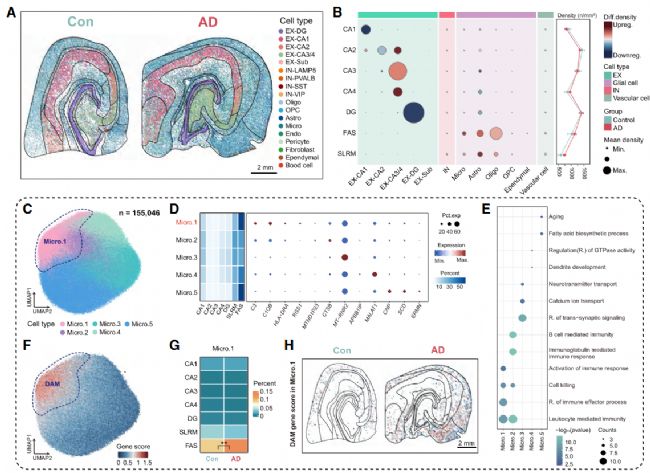
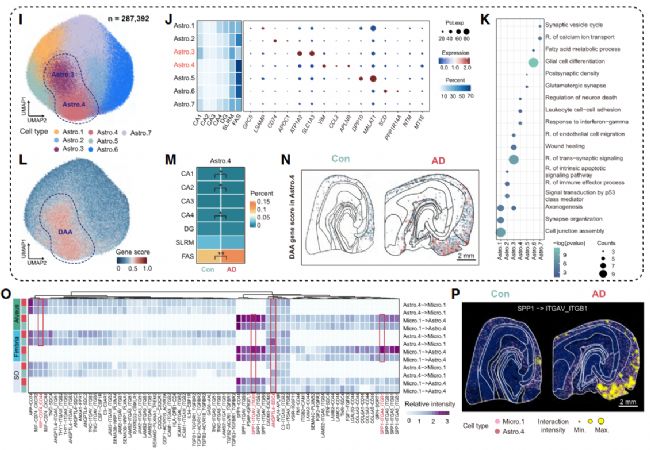
圖3
3.Aβ 斑塊微環境:“核心 - 外殼” 細胞分布,亞區響應各異
通過 Aβ 染色與 Stereo-seq 切片的精準對齊,研究首次解析了人類 AD 中 Aβ 斑塊周圍的分子與細胞動態(圖 4A、4B):Aβ 沉積的亞區差異:CA1、CA4、FAS、SLRM 為 Aβ 高沉積區,其中 CA1 和 SLRM 的 Aβ 負荷最高(圖 4C);細胞的 “梯度分布” 模式:以 Aβ 斑塊為中心,設置 5 個 20μm 間隔的同心圓,發現小膠質細胞在 0-40μm 范圍內密度最高(核心包圍),星形膠質細胞在 20-40μm 達峰值(外殼分布),興奮性神經元則隨距離斑塊越近密度越低(圖 4L);Aβ 相關 DEGs 的細胞來源:CA1 中 46.75% 的 Aβ 相關 DEGs 來自興奮性神經元(富集氧化磷酸化通路),SLRM 中 29.27% 來自星形膠質細胞(富集膠質生成與 Aβ 清除通路),反映不同亞區對 Aβ 沉積的響應存在細胞類型特異性。
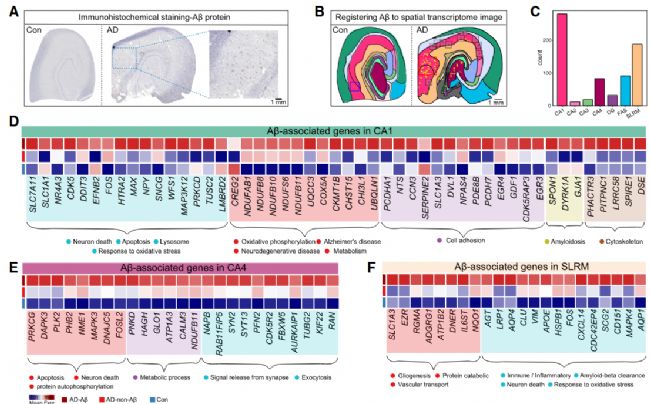
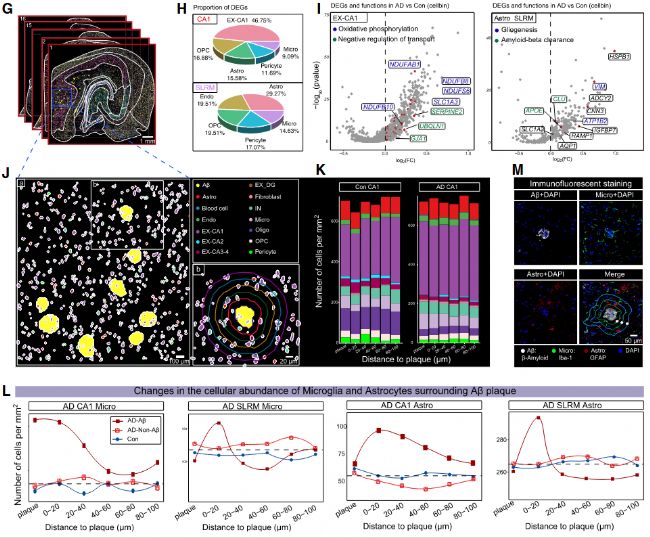
圖4
4. 腦源性 EVs 標志物:血漿 CCK/PMP2+EVs 為 AD 診斷破局
為將基礎研究轉化為臨床工具,研究聚焦 “腦源性細胞外囊泡(EVs)”——EVs 可攜帶腦內分子進入外周血,是理想的無創診斷標志物。通過交集分析(Stereo-seq DEGs、snRNA-seq DEGs、腦源性 EVs 基因庫),篩選出 102 個 EVs 相關 DEGs,最終鎖定CCK(膽囊收縮素) 與PMP2(外周髓鞘蛋白 2)(圖 5C、5D),臨床驗證性能:在 154 例樣本中,血漿 CCK+、PMP2+EVs 在 AD 患者中顯著降低(AD vs HC,p<0.01);單獨使用 CCK+EVs 區分 AD 與 HC 的 AUC 達 0.90(靈敏度 93%、特異性 74%),兩者聯合年齡構建的整合模型 AUC 進一步提升至 0.95(靈敏度 96%、特異性 85%),區分 AD 與 NAD 的 AUC 達 0.84(靈敏度 89%、特異性 67%)(圖 5J、5K);CSF 中 CCK+、PMP2+EVs 同樣能有效區分 AD 與 HC,且 EVs 檢測的批內 / 批間變異系數≤10%,無需侵入性腦脊液采集,適合大規模臨床篩查。
圖5
討論
該研究核心突破在于填補了技術空白,首次構建 “單細胞 + 空間 + 病理” 的人類 AD 海馬體多模態圖譜,揭示了傘部膠質細胞炎癥灶、CA1 神經元選擇性損失等以往小鼠模型未發現的病理特征;
提出新治療靶點:傘部 Micro.1 與 Astro.4 的異常互作(如 SPP1-ITGB1)可能是突觸修剪過度的關鍵,靶向該互作或可保護 AD 患者的突觸功能并開發新型診斷工具:血漿 CCK/PMP2+EVs 整合模型的診斷性能優于傳統標志物(如 CSF Aβ42/Aβ40),且無創便捷,為 AD 早期篩查提供新方案。
但研究局限主要在樣本量與代表性:基礎研究的尸檢樣本僅 16 例,需擴大年齡、性別及 AD 分期的多樣性;技術上Stereo-seq 的基因捕獲效率有限,且 Aβ 染色與轉錄組切片為相鄰切片,對齊存在輕微空間誤差;標志物特異性:尚未驗證 CCK/PMP2+EVs 對其他神經退行性疾病(如帕金森病癡呆)的特異性,需進一步擴大隊列。
參考文獻:
[1] Wang P , Han L , Wang L ,et al.Molecular pathways and diagnosis in spatially resolved Alzheimer's hippocampal atlas[J].Neuron, 2025, 113(13):2123-2140.e9.DOI:10.1016/j.neuron.2025.03.002.






