多組學分析在揭示綿羊早期胚胎發育的表觀遺傳調控機制中的應用
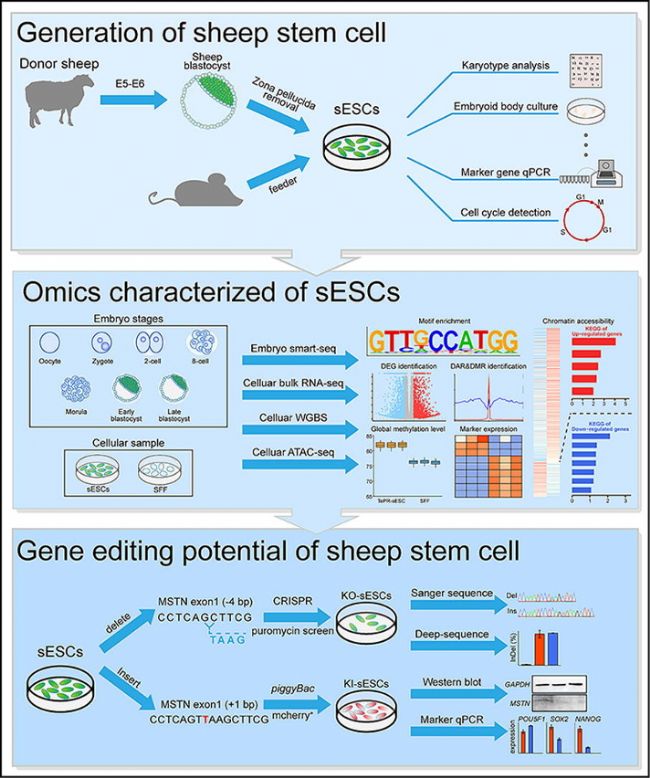
近日,西北農林科技大學博士后金妙函等為第一作者,陳玉林教授和王小龍教授為通訊作者,在國際知名期刊《Journal of Advanced Research》上發表題為“Efficient derivation of stable sheep embryonic stem cells opens a new avenue for agricultural and biomedical application”的研究論文。研究團隊建立了一種名為TePR(mTeSR PLUS培養基聯合WNT/β-catenin通路抑制劑IWR-1)的新型培養系統,首次實現綿羊胚胎干細胞系(Embryonic Stem Cells, ESCs)的長期穩定培養。具體而言,通過整合綿羊胚胎發育各階段的多組學數據(包括Smart-seq2、ATAC-seq和WGBS),系統描繪了綿羊早期胚胎發育和ESCs多能性狀態的轉錄組與表觀遺傳特征。本研究提供的Smart-seq2、ATAC-seq和WGBS技術,助力揭示綿羊ESCs獨特的轉錄特征、染色質開放狀態和甲基化模式,為理解反芻動物早期發育和干細胞多能性調控機制提供重要見解。

標題:Efficient derivation of stable sheep embryonic stem cells opens a new avenue for agricultural and biomedical application(構建高效穩定的綿羊胚胎干細胞系,開啟農業和生物醫學應用新途徑)
發表時間:2025年7月23日
發表期刊:Journal of Advanced Research(J Adv Res)
影響因子:IF13/Q1
技術平臺:Smart-seq2、ATAC-seq和WGBS
作者單位:西北農林科技大學
DOI:10.1016/j.jare.2025.07.036

易小結
本研究不僅在綿羊胚胎干細胞領域取得了重要突破,還通過應用和拓展表觀基因組學和單細胞轉錄組學測序技術,為反芻動物干細胞研究、農業和生物醫學應用以及表觀遺傳學研究提供了新的工具和方法。這些成果不僅具有重要的科學價值,還為未來相關領域的研究提供了重要的參考和啟示。
易基因提供的Smart-seq2、ATAC-seq和WGBS等多組學整合技術支撐,不僅能夠獲得更全面的生物學信息,還能揭示不同組學層面之間的相互作用和調控機制。這一研究為未來多組學整合研究提供成功思路,展示了其在復雜生物系統研究中的巨大潛力。
研究方法
胚胎收集與培養:從雌性綿羊體內收集胚胎,并在體外培養至不同發育階段。
ESC的分離與培養:TePR條件下從囊胚內細胞團中分離綿羊ESC,并進行長期培養。
轉錄組分析(Smart-seq2):對綿羊植入前胚胎(卵母細胞至囊胚共7個階段)和ESC進行單細胞轉錄組測序,分析其基因表達譜,揭示胚胎基因組激活(Embryonic Genome Activation, EGA)動態。
染色質開放性分析(ATAC-seq):比較TePR-sESCs與綿羊胎兒成纖維細胞(Sheep Fetal Fibroblasts, SFFs)的染色質開放區域,識別多能性相關轉錄因子結合 motif(如POU5F1、SOX2)。
全基因組甲基化分析(WGBS):對ESC和成纖維細胞進行WGBS,分析DNA甲基化模式,定位差異甲基化區域(DMRs)。
基因編輯:利用PiggyBac轉座和CRISPR/Cas9技術對ESC進行基因編輯,驗證其基因編輯能力。
嵌合體實驗:將ESC注入早期囊胚,觀察其在嵌合體胚胎中的貢獻。
結果圖形
(1)TePR培養基支持綿羊ESC系的構建和長期穩定培養
研究者測試了四種不同的培養條件(NBFR、bEPSCM、3i/LAF和TePR),發現TePR條件下的綿羊ESC(TePR-sESCs)能夠成功構建并長期穩定培養。TePR-sESCs展現出穩定的形態,能夠在單細胞水平上傳代,并在超過100代后保持未分化狀態。這些細胞表達多能性標記基因(如POU5F1、SOX2和NANOG),并通過胚胎體(EB)分化實驗顯示出三胚層分化潛力。這些結果表明,TePR培養基能夠支持綿羊ESC的建立和長期穩定培養,為后續研究提供可靠的細胞模型。
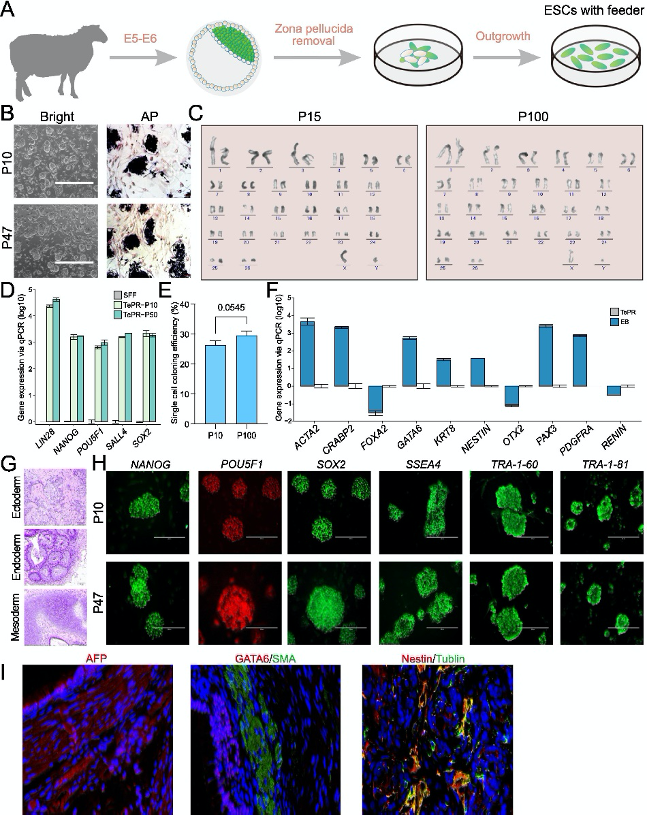
圖1:TePR-sESCs的生成與表征
(A) TePR-sESCs從第6天體內受精胚胎中分離的示意圖。
(B) TePR-sESCs的明場圖像和堿性磷酸酶(AP)染色。
(C) TePR-sESCs的核型分析。
(D) 使用RT-qPCR分析TePR-sESCs的核心多能性基因(POU5F1、SOX2、NANOG、LIN28和SALL4)的基因表達。
(E) TePR-sESCs(P10)和TePR-sESCs(P100)的單細胞克隆效率。
(F) 體外胚狀體(EB)分化實驗。通過RT-PCR檢測外胚層(OTX2、PAX3、KRT8和NESTIN)、中胚層(PDGFRA和ACTA2)和內胚層(FOXA2和GATA6)特異性基因的表達。
(G) 體內畸胎瘤形成實驗。TePR-sESCs形成的畸胎瘤的H&E染色。
(H) 免疫染色檢測POU5F1、SOX2、NANOG、SSEA4、TRA-1–81和TRA-1–60。
(I) 免疫染色檢測AFP、GATA6、SMA、Nestin和Tublin。
(2)TePR-sESCs的轉錄組表征
通過單細胞轉錄組Smart-seq2分析顯示,綿羊EGA發生于8細胞期至桑椹胚階段。TePR-sESCs的轉錄組特征與8細胞/桑椹胚胚胎高度相似,但多能基因表達模式存在差異:如POU5F1在桑椹胚中高表達,而在TePR-sESCs中下調。差異表達基因(DEGs)富集于WNT/BMP信號通路、胚胎器官形態發生等,提示TePR-sESCs處于一種接近胚胎早期發育的多能狀態,這些結果揭示了TePR-sESCs獨特的轉錄組特征。
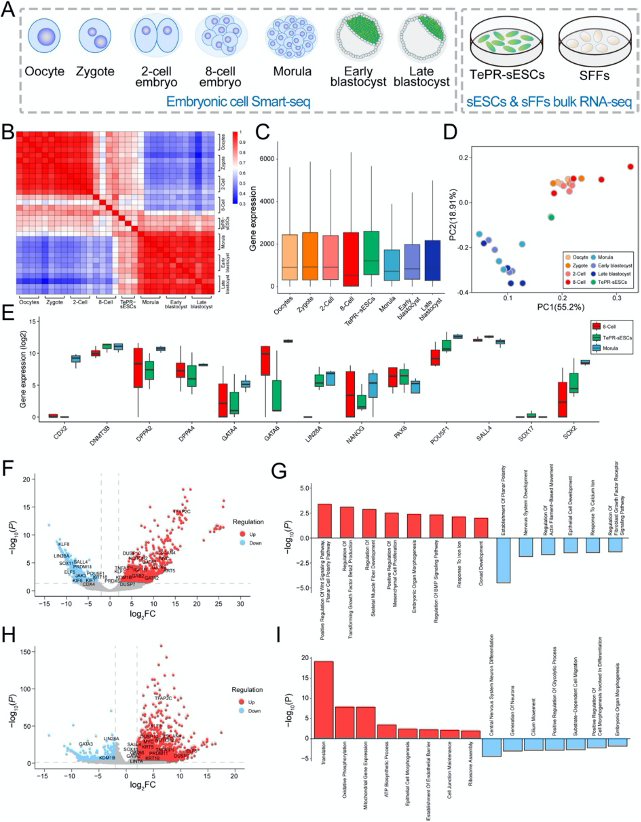
(B) 樣本相關性熱圖(MII卵母細胞、受精卵、2細胞期、8細胞期、桑椹胚、早期囊胚、晚期囊胚以及TePR-sESCs)。
(C) 不同胚胎階段(MII卵母細胞、受精卵、2細胞期、8細胞期、桑椹胚、早期囊胚、晚期囊胚以及TePR-sESCs)的基因表達水平。
(D) TePR-sESCs與不同胚胎階段的主成分分析。
(E) 8細胞期胚胎、桑椹胚和TePR-sESCs中標記基因表達的箱線圖。
(F) 8細胞期胚胎與TePR-sESCs之間差異表達基因(DEGs)的火山圖。
(G) 8細胞期胚胎與TePR-sESCs之間差異表達基因(DEGs)的GO富集分析。
(H) 桑椹胚與TePR-sESCs之間差異表達基因(DEGs)的火山圖。
(I) 桑椹胚與TePR-sESCs之間差異表達基因(DEGs)的GO富集分析。
(3)TePR-sESCs的表觀遺傳表征
利用ATAC-seq和WGBS技術,研究者分析了TePR-sESCs的染色質可及性和DNA甲基化模式。ATAC-seq結果顯示,TePR-sESCs的染色質可及區域顯著多于成纖維細胞,且這些區域富含多能性轉錄因子(如POU5F1、SOX2和NANOG)的結合位點。WGBS結果顯示,TePR-sESCs的DNA甲基化水平約為82%,與人類、豬和牛的EPSCs相似。這些結果表明,TePR-sESCs具有獨特的表觀遺傳特征,這些特征可能與其多能性狀態密切相關。
ATAC-seq:TePR-sESCs的染色質開放區域(DARs)顯著多于綿羊胎兒成纖維細胞(SFFs),且富集于多能基因啟動子區(如POU5F1、NANOG)(圖3A-D)。差異可及性基因參與cAMP/WNT信號通路(圖3E),表明表觀遺傳調控與多能性維持密切相關。
WGBS:TePR-sESCs全基因組甲基化水平約82%,與人類、豬和牛等物種的primed ESCs相似(圖3F)。DMRs主要位于基因間區和內含子區,且與TSS鄰近區域的染色質可及性呈負相關(圖3H),印證了DNA甲基化對基因表達的抑制作用。
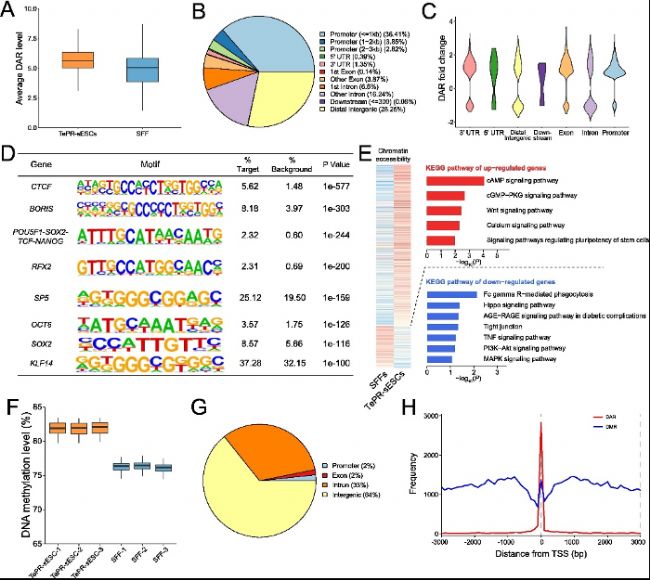
圖3:TePR-sESC的表觀遺傳表征。
(A)TePR-sESC和SFF的總ATAC-seq水平。
(B)TePR-sESC和SFF之間不同基因組區域(啟動子、內含子、編碼外顯子和遠端基因間區域)內DAR分布。
(C)每個基因組區域中DAR豐度小提琴圖。
(D)TePR-sESCs和SFF中ATAC-seq peaks的motif富集分析。
(E)與SFF相比,TePR-sESC中富集具有不同染色質可及性的基因通路。
(F)TePR-sESC和SFF的DNA甲基化水平。
(G)TePR-sESC和SFF之間不同基因組區域(啟動子、外顯子、基因間和內含子區域)內DMR的分布。(H)轉錄起始位點的平均DNA甲基化水平和DAR分布(TSS±3Kb)。
(4)TePR-sESCs的特異性基因網絡
通過整合多組學(DEGs+DARs+DMGs)數據,研究團隊鑒定出13個在TePR-sESCs中具有特異性表達模式基因(如PDE4D、SIX6、MECOM和TBX18)。這些基因在cAMP、MAPK、細胞間連接和Ras信號通路中富集。此外研究者還分析了TePR-sESCs與其他物種(豬、牛)ESC的轉錄組數據,發現TePR-sESCs與人類naive ESCs的表達模式最為接近。這些結果揭示了TePR-sESCs特異性的基因網絡特征,為研究綿羊胚胎發育和ESC多能性提供了新視角。
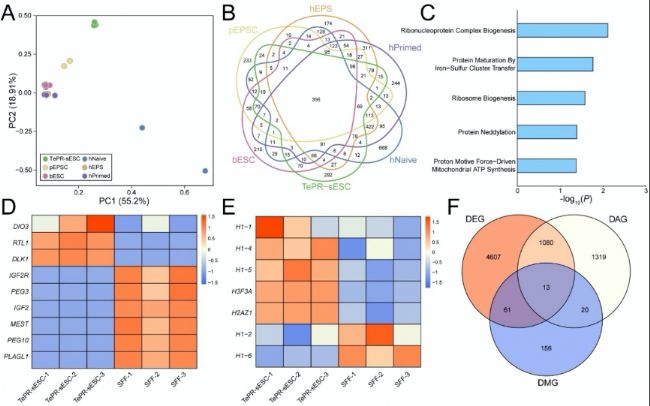
(B)TePR-sESC、pEPSC、bESC、hNaive ESC、hEPS和hPrimed ESC的維恩。
(C)TePR-sESCs獨特表達基因的GO富集分析。
(D)TePR-sESCs和SFFs中印記基因的表達。
(E)TePR-sESCs和SFFs中組蛋白基因的表達水平。
(F)TePR-sESCs和SFFs的DMR、DAR和DEG重疊。
(5)WNT信號通路維持TePR-sESCs多能性
研究者發現,WNT信號通路抑制劑IWR-1對于維持TePR-sESCs的多能性至關重要。去除IWR-1會導致細胞形態改變、堿性磷酸酶(AP)染色減弱以及多能性標記基因表達下降,而用同類型抑制劑XAV939替代后不會影響細胞的多能性。這些結果強調了WNT信號通路在維持TePR-sESCs多能性中的關鍵作用。
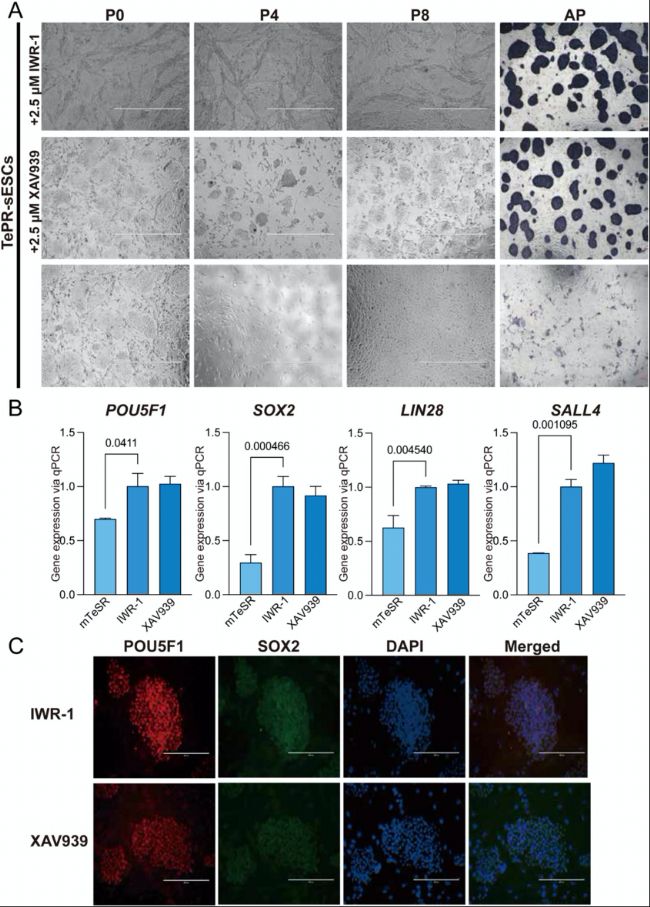
(B)qRT-PCR對多能性相關基因mRNA表達水平的定量分析。
(C)POU5F1、SOX2和NANOG的免疫熒光染色結果。
(6)TePR-sESCs實現精準基因編輯
研究者利用PiggyBac技術在TePR-sESCs中成功敲入mCherry基因,并通過CRISPR/Cas9技術敲除肌肉生長抑制素(MSTN)基因。Sanger測序和深度測序結果顯示,基因編輯效率高達93.9%和97.4%。Western blotting結果表明,編輯后的細胞不表達MSTN蛋白。此外,這些基因編輯后的細胞仍保持多能性。這些結果表明,TePR-sESCs能夠耐受多輪基因編輯,為農業和生物醫學應用提供了強大的工具。
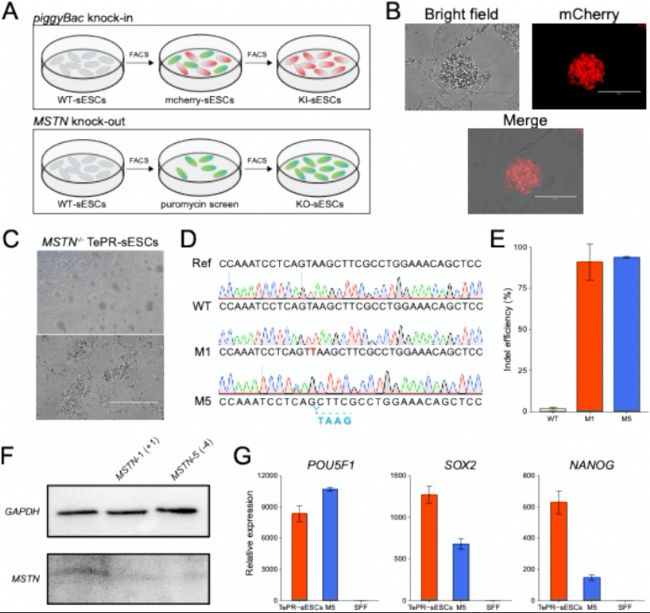
圖6:TePR-sESCs的基因編輯表現
(A)基因編輯流程示意圖。
(B)mCherry標記的TePR-sESCs熒光圖像。
(C)MSTN基因敲除(MSTN-/-)的TePR-sESCs圖像。
(D)MSTN-/- TePR-sESCs的編輯效率統計。
(E)MSTN-/- TePR-sESCs的Western blotting檢測結果,驗證MSTN蛋白表達缺失。
(F)MSTN-/- TePR-sESCs中多能性基因的qRT-PCR分析。
結果和啟示
本研究通過整合Smart-seq2、ATAC-seq和WGBS技術,首次系統地描繪了綿羊早期胚胎發育和ESC多能性狀態的分子與表觀遺傳全景圖。研究揭示了綿羊ESC獨特的轉錄和表觀遺傳特征,并成功實現了基因編輯。這些結果不僅增進了我們對反芻動物早期發育和干細胞多能性調控機制的理解,還為未來的農業和生物醫學研究提供了新的工具和方法。未來的研究可以進一步探索這些技術在其他物種中的應用,以揭示更多關于胚胎發育和干細胞多能性的奧秘。
參考文獻:
Jin M, Huang S, Zhou S, Shen W, Cao J, Song S, Wei Y, Kalds P, Hua J, Ma B, Ross PJ, Wang X, Chen Y. Efficient derivation of stable sheep embryonic stem cells opens a new avenue for agricultural and biomedical application. J Adv Res. 2025 Jul 23. doi: 10.1016/j.jare.2025.07.036.

標題:Efficient derivation of stable sheep embryonic stem cells opens a new avenue for agricultural and biomedical application(構建高效穩定的綿羊胚胎干細胞系,開啟農業和生物醫學應用新途徑)
發表時間:2025年7月23日
發表期刊:Journal of Advanced Research(J Adv Res)
影響因子:IF13/Q1
技術平臺:Smart-seq2、ATAC-seq和WGBS
作者單位:西北農林科技大學
DOI:10.1016/j.jare.2025.07.036

胚胎干細胞系(ESCs)可分化為所有成體細胞類型,在農業和生物醫學領域具有變革性潛力。然而,綿羊穩定ESCs的分離仍然具有挑戰性,限制其在進一步研究中的應用。本研究旨在通過簡化方案建立穩定的綿羊ESCs,保留其多能性。通過含有IWR-1的培養系統(稱為TePR)從囊胚內細胞團中分離綿羊胚胎干細胞。通過長期培養(>100代)、三胚層分化、轉錄組分析(E0-E6胚胎)和跨物種比較來評估多能性。其中,轉錄組學顯示TePR條件下分離培養的綿羊胚胎干細胞系(稱為TePR-sESCs)與8細胞/桑椹胚相似,且與綿羊基因組激活時間一致。此外,ATAC-seq揭示了其多能性基因(如POU5F1、NANOG)的染色質可及性。WGBS鑒定出多能性相關區域的低甲基化。TePR-sESCs在長期培養后仍保持正常核型、核心多能性基因表達(如POU5F1、NANOG)和三胚層分化能力,且耐受多輪基因編輯(如mCherry敲入和MSTN基因敲除),為農業育種和生物醫學研究提供重要工具。

圖形摘要
易小結
本研究不僅在綿羊胚胎干細胞領域取得了重要突破,還通過應用和拓展表觀基因組學和單細胞轉錄組學測序技術,為反芻動物干細胞研究、農業和生物醫學應用以及表觀遺傳學研究提供了新的工具和方法。這些成果不僅具有重要的科學價值,還為未來相關領域的研究提供了重要的參考和啟示。
易基因提供的Smart-seq2、ATAC-seq和WGBS等多組學整合技術支撐,不僅能夠獲得更全面的生物學信息,還能揭示不同組學層面之間的相互作用和調控機制。這一研究為未來多組學整合研究提供成功思路,展示了其在復雜生物系統研究中的巨大潛力。
研究方法
胚胎收集與培養:從雌性綿羊體內收集胚胎,并在體外培養至不同發育階段。
ESC的分離與培養:TePR條件下從囊胚內細胞團中分離綿羊ESC,并進行長期培養。
轉錄組分析(Smart-seq2):對綿羊植入前胚胎(卵母細胞至囊胚共7個階段)和ESC進行單細胞轉錄組測序,分析其基因表達譜,揭示胚胎基因組激活(Embryonic Genome Activation, EGA)動態。
染色質開放性分析(ATAC-seq):比較TePR-sESCs與綿羊胎兒成纖維細胞(Sheep Fetal Fibroblasts, SFFs)的染色質開放區域,識別多能性相關轉錄因子結合 motif(如POU5F1、SOX2)。
全基因組甲基化分析(WGBS):對ESC和成纖維細胞進行WGBS,分析DNA甲基化模式,定位差異甲基化區域(DMRs)。
基因編輯:利用PiggyBac轉座和CRISPR/Cas9技術對ESC進行基因編輯,驗證其基因編輯能力。
嵌合體實驗:將ESC注入早期囊胚,觀察其在嵌合體胚胎中的貢獻。
結果圖形
(1)TePR培養基支持綿羊ESC系的構建和長期穩定培養
研究者測試了四種不同的培養條件(NBFR、bEPSCM、3i/LAF和TePR),發現TePR條件下的綿羊ESC(TePR-sESCs)能夠成功構建并長期穩定培養。TePR-sESCs展現出穩定的形態,能夠在單細胞水平上傳代,并在超過100代后保持未分化狀態。這些細胞表達多能性標記基因(如POU5F1、SOX2和NANOG),并通過胚胎體(EB)分化實驗顯示出三胚層分化潛力。這些結果表明,TePR培養基能夠支持綿羊ESC的建立和長期穩定培養,為后續研究提供可靠的細胞模型。

圖1:TePR-sESCs的生成與表征
(B) TePR-sESCs的明場圖像和堿性磷酸酶(AP)染色。
(C) TePR-sESCs的核型分析。
(D) 使用RT-qPCR分析TePR-sESCs的核心多能性基因(POU5F1、SOX2、NANOG、LIN28和SALL4)的基因表達。
(E) TePR-sESCs(P10)和TePR-sESCs(P100)的單細胞克隆效率。
(F) 體外胚狀體(EB)分化實驗。通過RT-PCR檢測外胚層(OTX2、PAX3、KRT8和NESTIN)、中胚層(PDGFRA和ACTA2)和內胚層(FOXA2和GATA6)特異性基因的表達。
(G) 體內畸胎瘤形成實驗。TePR-sESCs形成的畸胎瘤的H&E染色。
(H) 免疫染色檢測POU5F1、SOX2、NANOG、SSEA4、TRA-1–81和TRA-1–60。
(I) 免疫染色檢測AFP、GATA6、SMA、Nestin和Tublin。
(2)TePR-sESCs的轉錄組表征
通過單細胞轉錄組Smart-seq2分析顯示,綿羊EGA發生于8細胞期至桑椹胚階段。TePR-sESCs的轉錄組特征與8細胞/桑椹胚胚胎高度相似,但多能基因表達模式存在差異:如POU5F1在桑椹胚中高表達,而在TePR-sESCs中下調。差異表達基因(DEGs)富集于WNT/BMP信號通路、胚胎器官形態發生等,提示TePR-sESCs處于一種接近胚胎早期發育的多能狀態,這些結果揭示了TePR-sESCs獨特的轉錄組特征。

圖2:TePR-sESCs的轉錄特征分析
(A) 轉錄組測序示意圖。(B) 樣本相關性熱圖(MII卵母細胞、受精卵、2細胞期、8細胞期、桑椹胚、早期囊胚、晚期囊胚以及TePR-sESCs)。
(C) 不同胚胎階段(MII卵母細胞、受精卵、2細胞期、8細胞期、桑椹胚、早期囊胚、晚期囊胚以及TePR-sESCs)的基因表達水平。
(D) TePR-sESCs與不同胚胎階段的主成分分析。
(E) 8細胞期胚胎、桑椹胚和TePR-sESCs中標記基因表達的箱線圖。
(F) 8細胞期胚胎與TePR-sESCs之間差異表達基因(DEGs)的火山圖。
(G) 8細胞期胚胎與TePR-sESCs之間差異表達基因(DEGs)的GO富集分析。
(H) 桑椹胚與TePR-sESCs之間差異表達基因(DEGs)的火山圖。
(I) 桑椹胚與TePR-sESCs之間差異表達基因(DEGs)的GO富集分析。
(3)TePR-sESCs的表觀遺傳表征
利用ATAC-seq和WGBS技術,研究者分析了TePR-sESCs的染色質可及性和DNA甲基化模式。ATAC-seq結果顯示,TePR-sESCs的染色質可及區域顯著多于成纖維細胞,且這些區域富含多能性轉錄因子(如POU5F1、SOX2和NANOG)的結合位點。WGBS結果顯示,TePR-sESCs的DNA甲基化水平約為82%,與人類、豬和牛的EPSCs相似。這些結果表明,TePR-sESCs具有獨特的表觀遺傳特征,這些特征可能與其多能性狀態密切相關。
ATAC-seq:TePR-sESCs的染色質開放區域(DARs)顯著多于綿羊胎兒成纖維細胞(SFFs),且富集于多能基因啟動子區(如POU5F1、NANOG)(圖3A-D)。差異可及性基因參與cAMP/WNT信號通路(圖3E),表明表觀遺傳調控與多能性維持密切相關。
WGBS:TePR-sESCs全基因組甲基化水平約82%,與人類、豬和牛等物種的primed ESCs相似(圖3F)。DMRs主要位于基因間區和內含子區,且與TSS鄰近區域的染色質可及性呈負相關(圖3H),印證了DNA甲基化對基因表達的抑制作用。

圖3:TePR-sESC的表觀遺傳表征。
(B)TePR-sESC和SFF之間不同基因組區域(啟動子、內含子、編碼外顯子和遠端基因間區域)內DAR分布。
(C)每個基因組區域中DAR豐度小提琴圖。
(D)TePR-sESCs和SFF中ATAC-seq peaks的motif富集分析。
(E)與SFF相比,TePR-sESC中富集具有不同染色質可及性的基因通路。
(F)TePR-sESC和SFF的DNA甲基化水平。
(G)TePR-sESC和SFF之間不同基因組區域(啟動子、外顯子、基因間和內含子區域)內DMR的分布。(H)轉錄起始位點的平均DNA甲基化水平和DAR分布(TSS±3Kb)。
(4)TePR-sESCs的特異性基因網絡
通過整合多組學(DEGs+DARs+DMGs)數據,研究團隊鑒定出13個在TePR-sESCs中具有特異性表達模式基因(如PDE4D、SIX6、MECOM和TBX18)。這些基因在cAMP、MAPK、細胞間連接和Ras信號通路中富集。此外研究者還分析了TePR-sESCs與其他物種(豬、牛)ESC的轉錄組數據,發現TePR-sESCs與人類naive ESCs的表達模式最為接近。這些結果揭示了TePR-sESCs特異性的基因網絡特征,為研究綿羊胚胎發育和ESC多能性提供了新視角。

圖4:TePR-sESC的特定基因網絡特征
(A) 比較 TePR-sESC、pEPSC、bESC、hNaive ESC、hEPS 和 hPrimed ESC 的 PCA 分析。(B)TePR-sESC、pEPSC、bESC、hNaive ESC、hEPS和hPrimed ESC的維恩。
(C)TePR-sESCs獨特表達基因的GO富集分析。
(D)TePR-sESCs和SFFs中印記基因的表達。
(E)TePR-sESCs和SFFs中組蛋白基因的表達水平。
(F)TePR-sESCs和SFFs的DMR、DAR和DEG重疊。
(5)WNT信號通路維持TePR-sESCs多能性
研究者發現,WNT信號通路抑制劑IWR-1對于維持TePR-sESCs的多能性至關重要。去除IWR-1會導致細胞形態改變、堿性磷酸酶(AP)染色減弱以及多能性標記基因表達下降,而用同類型抑制劑XAV939替代后不會影響細胞的多能性。這些結果強調了WNT信號通路在維持TePR-sESCs多能性中的關鍵作用。

圖5:WNT信號通路抑制劑維持TePR-sESCs的多能性
(A)比較IWR-1缺失和XAV939添加條件下培養的TePR-sESCs的形態與AP染色。(B)qRT-PCR對多能性相關基因mRNA表達水平的定量分析。
(C)POU5F1、SOX2和NANOG的免疫熒光染色結果。
(6)TePR-sESCs實現精準基因編輯
研究者利用PiggyBac技術在TePR-sESCs中成功敲入mCherry基因,并通過CRISPR/Cas9技術敲除肌肉生長抑制素(MSTN)基因。Sanger測序和深度測序結果顯示,基因編輯效率高達93.9%和97.4%。Western blotting結果表明,編輯后的細胞不表達MSTN蛋白。此外,這些基因編輯后的細胞仍保持多能性。這些結果表明,TePR-sESCs能夠耐受多輪基因編輯,為農業和生物醫學應用提供了強大的工具。

圖6:TePR-sESCs的基因編輯表現
(B)mCherry標記的TePR-sESCs熒光圖像。
(C)MSTN基因敲除(MSTN-/-)的TePR-sESCs圖像。
(D)MSTN-/- TePR-sESCs的編輯效率統計。
(E)MSTN-/- TePR-sESCs的Western blotting檢測結果,驗證MSTN蛋白表達缺失。
(F)MSTN-/- TePR-sESCs中多能性基因的qRT-PCR分析。
結果和啟示
本研究通過整合Smart-seq2、ATAC-seq和WGBS技術,首次系統地描繪了綿羊早期胚胎發育和ESC多能性狀態的分子與表觀遺傳全景圖。研究揭示了綿羊ESC獨特的轉錄和表觀遺傳特征,并成功實現了基因編輯。這些結果不僅增進了我們對反芻動物早期發育和干細胞多能性調控機制的理解,還為未來的農業和生物醫學研究提供了新的工具和方法。未來的研究可以進一步探索這些技術在其他物種中的應用,以揭示更多關于胚胎發育和干細胞多能性的奧秘。
參考文獻:
Jin M, Huang S, Zhou S, Shen W, Cao J, Song S, Wei Y, Kalds P, Hua J, Ma B, Ross PJ, Wang X, Chen Y. Efficient derivation of stable sheep embryonic stem cells opens a new avenue for agricultural and biomedical application. J Adv Res. 2025 Jul 23. doi: 10.1016/j.jare.2025.07.036.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






