Western實驗中HIF-1α空白條帶的原因及解決方法
很多剛接觸HIF-1α的同學們很容易碰到一個問題,就是做的Western老是空白條帶,什么都沒有。今天我們就帶著這個問題,一起深入了解下這個缺氧大明星。
發現
HIF-1的發現得感謝上面三位科學家。我們一直知道氧氣的重要性,卻不清楚細胞是如何適應氧氣水平的變化。這三位科學家為大家揭示了細胞水平的分子機理以及核心蛋白HIF-1,從而獲得諾貝爾生理學或醫學獎。
簡單描述下發現的過程:首先在缺氧情況下,發現細胞內的促紅細胞生成素(Erythropoietin, EPO)會大量表達,然后發現了增強EPO表達的關鍵區域——缺氧反應元件(Hypoxia Response Element,HRE)。最后發現與HRE特異性結合的蛋白——缺氧誘導因子(Hypoxia-Inducible Factor, HIF)。
結構
HIF-1結構上是一個異源二聚體,其中一個命名為HIF-1α,另外一個,命名為HIF-1β。HIF-1β又叫芳香烴受體核轉運因子(Aryl Hydrocarbon Receptor Nuclear Translocator,ARNT)。研究發現,HIF-1β對氧氣含量的變化并不敏感,所以我們的主角就是HIF-1α了。
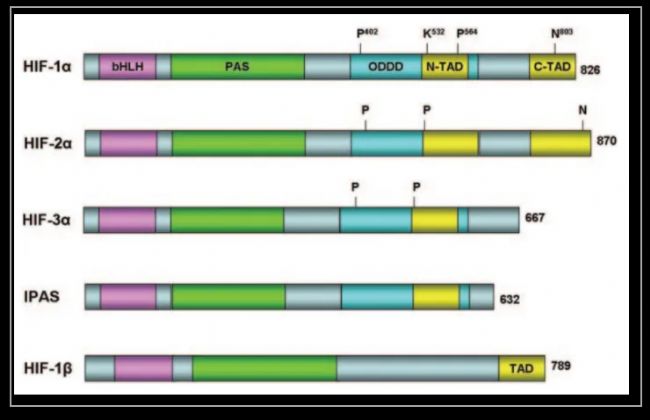
HIF家族結構域示意圖
HIF家族有共同的兩個結構域:一個是紫色部分的堿性螺旋-環-螺旋結構域(Basic Helix-Loop-Helix, bHLH),一個是綠色部分的Per-ARNT-Sim結構域(Periodicity-ARNT-Single-minded,PAS)。這兩個結構域是 HIF-1α 和 HIF-1β 亞基形成異二聚體所必需的。
藍色是氧依賴降解結構域(Oxygen-Dependent Degradation, ODD),是HIF1受氧調控的關鍵部位,這個我們下部分細講。N-TAD和C-TAD是兩個反式激活結構域(transactivation domain, TAD),N-TAD位于ODD結構域,C-TAD 可以和CBP/p300 等相互作用共同激活下游基因。這兩個結構域共同負責HIF-1α轉錄活性。
HIF-2α在 HIF-1α被發現不久后就被克隆出來了。HIF-2α與HIF-1α有 48% 的氨基酸序列是相同的,功能也類似,可以與HIF-1β形成異二聚體并結合HRE。不過與HIF-1α的普遍表達不同的是,HIF-2α主要表達在肺,內皮,頸動脈中。
后來發現的HIF-3α也在多種組織中表達,同樣與 HIF-1β 形成異二聚體并結合HRE。不過目前HIF-1α 和 HIF-2α研究更加廣泛,而HIF-3α和其他HIF亞型研究較少,還有待大家去研究。
降解
為什么HIF-1α Western難做呢,主要就是因為常氧快速降解,還沒等你檢測,就已經沒有了。
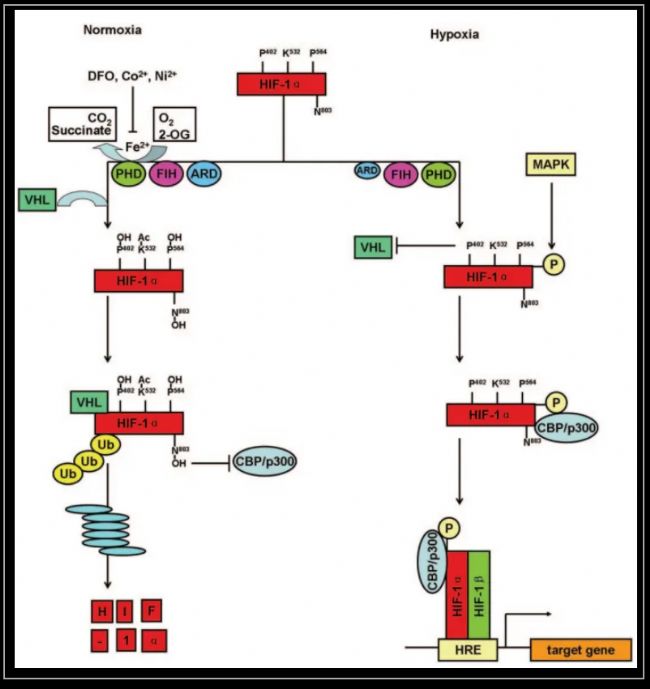
HIF-1α信號通路
我們一起來看上面的通路圖,在常氧條件下,HIF-1α 會發生脯氨酸羥基化(402和564位點都是脯氨酸),細心的同學還可以看到圖中K532也同時發生了乙酰化。這時馮·希佩爾-林道腫瘤抑制蛋白(von Hippel-Lindau tumor suppressor protein,VHL) 就會結合到HIF-1α,發生泛素化,形成E3泛素連接酶復合體。隨后發生蛋白酶體降解。
而在右邊的缺氧條件下,HIF-1α沒有了VHL這個蛋白的限制,不發生泛素化降解,從而不斷積累進入細胞核,調控下游基因的表達。如果我們使用一些羥化酶抑制劑,例如DFO去鐵胺和氯化鈷等,同樣可以阻斷HIF-1α的降解,使HIF-1α的水平上調。
還需要注意的是,HIF-1α的降解不是只通過VHL調控。研究報道還有許多其他蛋白可以影響 HIF-1α的泛素化和穩定性。例如P53可以通過MDM2來降解HIF-1α;Jab1又可以增加HIF-1α的表達水平。此外,VHL 也與 HIF-1信號通路的其他蛋白有相互作用,因此VHL調節的不僅只是HIF-1α 穩定性。生物體如此復雜,大部分蛋白調控都是交錯進行的。
常見問題
1.無條帶
做HIF-1α蛋白最常見的問題就是無條帶。在我們的咨詢中,無條帶的比例占到了80%。
碰到無條帶的情況,首先要確認你的樣本是否表達或高表達HIF-1α,是否使用低氧誘導,低氧誘導是否成功,這些都可以通過上下游蛋表達變化以及功能實驗去綜合判斷的。
有的同學說我做的不是低氧誘導,是藥物誘導,那么最好在旁邊添加一個低氧誘導的陽性對照來排查問題。
小優細節君建議
陽性對照推薦0.5%氧氣培養24h。如果沒有低氧培養箱,建議使用氯化鈷(100µM,4h)或者DMOG(1mM,6h)來處理細胞。
如果樣本表達和低氧誘導都沒有問題,還有一個關鍵點需要注意,就是蛋白提取操作是否成功。因為HIF-1α低氧誘導后主要在細胞核累積,所以提取蛋白時使用的裂解液和方法要充分裂解核蛋白。
建議使用裂解效果強的RIPA裂解液或者SDS裂解液,保證可以裂解核膜。裂解完增加超聲步驟,完全破碎細胞膜和細胞核膜,打斷DNA,充分釋放蛋白,同時可以增加樣本的均一性。建議每次超5~10S,間隔20S,共三個循環。超聲時需要根樣本體積及所用的探頭大小調整超聲功率,盡量保證在超聲過程中樣本不起泡,超聲后樣本變得澄清。
如果有同學說實驗室沒有超聲儀器怎么辦,可以使用1ml注射器,來回抽進打出5~10次,到沒有阻力為止。做Western時也可以做一下核內參。
2.條帶位置不對
HIF-1α理論分子量在93KD,實際上由于蛋白的多種修飾,尤其是泛素化修飾,呈現出來的分子量在110-120KD左右。我們之前就碰到有同學只裁窄窄的兩個marker之間的部分,很有可能將目的蛋白丟失。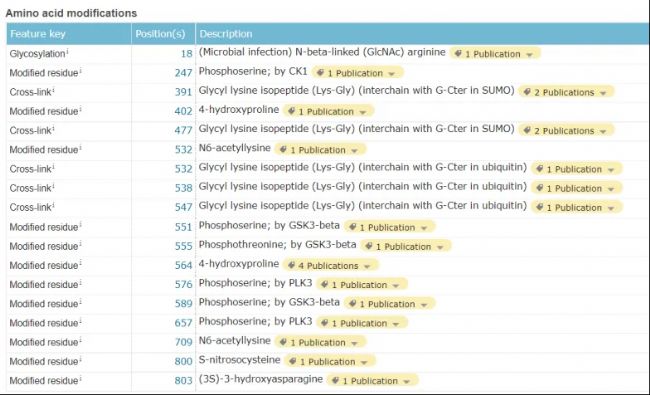
小優細節君建議
在跑HIF-1α一定要把膜裁寬一些,將70-150KD蛋白全部轉上去。這里還需要注意,預染marker由于偶聯了染料,出現5-10KD遷移偏差是很正常的現象。如果樣本條帶趨勢符合造模,且條帶位置和陽性對照一致,只是條帶出現在了130 KD位置,我們可以基本確認是目的條帶。
3.為什么HIF-1β/ARNT能做出來,HIF-1α做不出來?
這個問題其實仔細看過上文的同學們是可以找到答案的。因為HIF-1β對氧氣含量的變化并不敏感,也就是說正常的細胞組織是可以檢測出HIF-1β的。我們看下圖,同樣的HepG2細胞,只有CoCl2處理后才能檢測到HIF-1α,而未處理的HepG2就可以檢測到HIF-1β。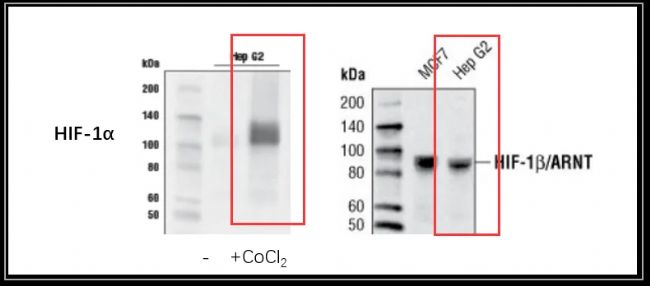
小優細節君建議
如果想通過其他亞型的表達情況來確認HIF-1α表達,建議可以做下HIF-2α。這兩個蛋白比較相近,可以說明一定問題。
部分推薦產品:
發現

美國癌癥學家威廉·凱林(William G. Kaelin, Jr.)
英國醫學家彼得·拉特克利夫(Sir Peter J. Ratcliffe)
美國醫學家格雷格·塞門扎(Gregg L. Semenza)
英國醫學家彼得·拉特克利夫(Sir Peter J. Ratcliffe)
美國醫學家格雷格·塞門扎(Gregg L. Semenza)
HIF-1的發現得感謝上面三位科學家。我們一直知道氧氣的重要性,卻不清楚細胞是如何適應氧氣水平的變化。這三位科學家為大家揭示了細胞水平的分子機理以及核心蛋白HIF-1,從而獲得諾貝爾生理學或醫學獎。
簡單描述下發現的過程:首先在缺氧情況下,發現細胞內的促紅細胞生成素(Erythropoietin, EPO)會大量表達,然后發現了增強EPO表達的關鍵區域——缺氧反應元件(Hypoxia Response Element,HRE)。最后發現與HRE特異性結合的蛋白——缺氧誘導因子(Hypoxia-Inducible Factor, HIF)。
結構
HIF-1結構上是一個異源二聚體,其中一個命名為HIF-1α,另外一個,命名為HIF-1β。HIF-1β又叫芳香烴受體核轉運因子(Aryl Hydrocarbon Receptor Nuclear Translocator,ARNT)。研究發現,HIF-1β對氧氣含量的變化并不敏感,所以我們的主角就是HIF-1α了。

HIF家族結構域示意圖
HIF家族有共同的兩個結構域:一個是紫色部分的堿性螺旋-環-螺旋結構域(Basic Helix-Loop-Helix, bHLH),一個是綠色部分的Per-ARNT-Sim結構域(Periodicity-ARNT-Single-minded,PAS)。這兩個結構域是 HIF-1α 和 HIF-1β 亞基形成異二聚體所必需的。
藍色是氧依賴降解結構域(Oxygen-Dependent Degradation, ODD),是HIF1受氧調控的關鍵部位,這個我們下部分細講。N-TAD和C-TAD是兩個反式激活結構域(transactivation domain, TAD),N-TAD位于ODD結構域,C-TAD 可以和CBP/p300 等相互作用共同激活下游基因。這兩個結構域共同負責HIF-1α轉錄活性。
HIF-2α在 HIF-1α被發現不久后就被克隆出來了。HIF-2α與HIF-1α有 48% 的氨基酸序列是相同的,功能也類似,可以與HIF-1β形成異二聚體并結合HRE。不過與HIF-1α的普遍表達不同的是,HIF-2α主要表達在肺,內皮,頸動脈中。
后來發現的HIF-3α也在多種組織中表達,同樣與 HIF-1β 形成異二聚體并結合HRE。不過目前HIF-1α 和 HIF-2α研究更加廣泛,而HIF-3α和其他HIF亞型研究較少,還有待大家去研究。
降解
為什么HIF-1α Western難做呢,主要就是因為常氧快速降解,還沒等你檢測,就已經沒有了。

HIF-1α信號通路
我們一起來看上面的通路圖,在常氧條件下,HIF-1α 會發生脯氨酸羥基化(402和564位點都是脯氨酸),細心的同學還可以看到圖中K532也同時發生了乙酰化。這時馮·希佩爾-林道腫瘤抑制蛋白(von Hippel-Lindau tumor suppressor protein,VHL) 就會結合到HIF-1α,發生泛素化,形成E3泛素連接酶復合體。隨后發生蛋白酶體降解。
而在右邊的缺氧條件下,HIF-1α沒有了VHL這個蛋白的限制,不發生泛素化降解,從而不斷積累進入細胞核,調控下游基因的表達。如果我們使用一些羥化酶抑制劑,例如DFO去鐵胺和氯化鈷等,同樣可以阻斷HIF-1α的降解,使HIF-1α的水平上調。
還需要注意的是,HIF-1α的降解不是只通過VHL調控。研究報道還有許多其他蛋白可以影響 HIF-1α的泛素化和穩定性。例如P53可以通過MDM2來降解HIF-1α;Jab1又可以增加HIF-1α的表達水平。此外,VHL 也與 HIF-1信號通路的其他蛋白有相互作用,因此VHL調節的不僅只是HIF-1α 穩定性。生物體如此復雜,大部分蛋白調控都是交錯進行的。
常見問題
1.無條帶

做HIF-1α蛋白最常見的問題就是無條帶。在我們的咨詢中,無條帶的比例占到了80%。
碰到無條帶的情況,首先要確認你的樣本是否表達或高表達HIF-1α,是否使用低氧誘導,低氧誘導是否成功,這些都可以通過上下游蛋表達變化以及功能實驗去綜合判斷的。
有的同學說我做的不是低氧誘導,是藥物誘導,那么最好在旁邊添加一個低氧誘導的陽性對照來排查問題。
小優細節君建議
陽性對照推薦0.5%氧氣培養24h。如果沒有低氧培養箱,建議使用氯化鈷(100µM,4h)或者DMOG(1mM,6h)來處理細胞。
如果樣本表達和低氧誘導都沒有問題,還有一個關鍵點需要注意,就是蛋白提取操作是否成功。因為HIF-1α低氧誘導后主要在細胞核累積,所以提取蛋白時使用的裂解液和方法要充分裂解核蛋白。
建議使用裂解效果強的RIPA裂解液或者SDS裂解液,保證可以裂解核膜。裂解完增加超聲步驟,完全破碎細胞膜和細胞核膜,打斷DNA,充分釋放蛋白,同時可以增加樣本的均一性。建議每次超5~10S,間隔20S,共三個循環。超聲時需要根樣本體積及所用的探頭大小調整超聲功率,盡量保證在超聲過程中樣本不起泡,超聲后樣本變得澄清。
如果有同學說實驗室沒有超聲儀器怎么辦,可以使用1ml注射器,來回抽進打出5~10次,到沒有阻力為止。做Western時也可以做一下核內參。
2.條帶位置不對
HIF-1α理論分子量在93KD,實際上由于蛋白的多種修飾,尤其是泛素化修飾,呈現出來的分子量在110-120KD左右。我們之前就碰到有同學只裁窄窄的兩個marker之間的部分,很有可能將目的蛋白丟失。

Uniprot上HIF-1α的修飾
小優細節君建議
在跑HIF-1α一定要把膜裁寬一些,將70-150KD蛋白全部轉上去。這里還需要注意,預染marker由于偶聯了染料,出現5-10KD遷移偏差是很正常的現象。如果樣本條帶趨勢符合造模,且條帶位置和陽性對照一致,只是條帶出現在了130 KD位置,我們可以基本確認是目的條帶。

3.為什么HIF-1β/ARNT能做出來,HIF-1α做不出來?
這個問題其實仔細看過上文的同學們是可以找到答案的。因為HIF-1β對氧氣含量的變化并不敏感,也就是說正常的細胞組織是可以檢測出HIF-1β的。我們看下圖,同樣的HepG2細胞,只有CoCl2處理后才能檢測到HIF-1α,而未處理的HepG2就可以檢測到HIF-1β。

HepG2細胞檢測HIF-1α和HIF-1β
小優細節君建議
如果想通過其他亞型的表達情況來確認HIF-1α表達,建議可以做下HIF-2α。這兩個蛋白比較相近,可以說明一定問題。
部分推薦產品:
|
貨號 |
名稱 |
|
HIF-1α (D1S7W) XP® Rabbit mAb |
|
|
HIF-1α (D2U3T) Rabbit mAb |
|
|
HIF-1 alpha Antibody |
|
|
Rabbit Polyclonal HIF-1 alpha Antibody |
|
|
Rabbit anti-HIF1A Polyclonal Antibody |
|
|
Rabbit Anti-HIF-1 Alpha Polyclonal Antibody |
參考文獻:
1. Qingdong Ke, Max Costa. Hypoxia-inducible factor-1 (HIF-1). Mol Pharmacol. 2006 Nov;70(5):1469-80.
2. G L Semenza. HIF-1 and mechanisms of hypoxia sensing. Curr Opin Cell Biol. 2001 Apr;13(2):167-71.
3. Johannes Schödel, Peter J Ratcliffe. Mechanisms of hypoxia signalling: new implications for nephrology. Nat Rev Nephrol. 2019 Oct;15(10):641-659.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






