受體酪氨酸激酶 (RTKs)結構組成、激活機制及其在抗癌研究中的應用
眾所周知,蛋白質有那么多多多多多多的功能往往都是需要經過修飾才能實現滴,而蛋白質的修飾通常由酶驅動。欸,有這樣一類兼具激酶與受體的雙重功能的酶類,了解一下?
Section.01
RTKs,
了解一下!
提到酶,大家最熟悉的應該是這一對:激酶 (Kinase) —— 磷酸化,磷酸化酶 (Phosphorylase) —— 去磷酸化。具體小 M 不再贅述,感興趣的小伙伴可以翻翻往期推文:“激酶”與“磷酸酶”,靶向治療兩手抓。
本期我們重點要聊的是信號通路中的重要參與者——蛋白激酶!其中,受體酪氨酸激酶 (Receptor Tyrosine Kinases, RTKs) 具備激酶與受體的雙重功能,是規模最大的一類跨膜酶聯受體!
RTKs 的結構組成
RTKs 家族由保守的結構域構成,即具備配體結合位點的細胞外結構域、單次跨膜的疏水 α 螺旋區,以及擁有酪氨酸蛋白激酶 (PTK) 活性的細胞內結構域[1][2]。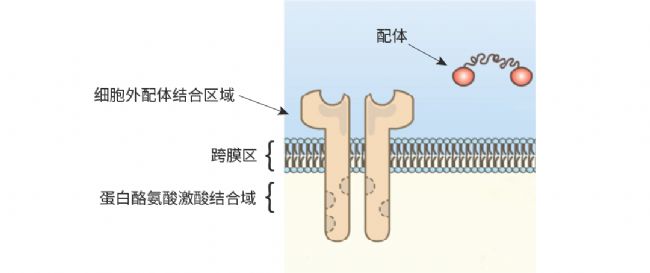 圖 1. RTKs 結構域[2]。
圖 1. RTKs 結構域[2]。
RTKs 的激活
RTKs 的激活是一個多維度的過程,受外部配體可及性與內在受體構象動力學之間微妙平衡的影響[1][3]。在分子層面上,RTKs 激活并非單一的事件,而是不同調節機制的匯聚,這些機制反映了它們所調控的復雜生物系統。
激活機制:配體結合首先促使受體二聚化,解除激酶域的自抑制狀態;接著觸發受體間的自磷酸化反應,在胞內區形成磷酸化酪氨酸殘基,進而穩定激酶的活性構象。這些磷酸化位點充當分子錨點,特異性地招募含有 SH2 或 PTB 結構域的下游信號適配蛋白 (如 Grb2、SOS)。激活后的信號蛋白隨后啟動 Ras - MAPK、PI3K - Akt 等核心信號級聯通路,最終通過信號放大精確調控細胞增殖、分化等關鍵生理過程。
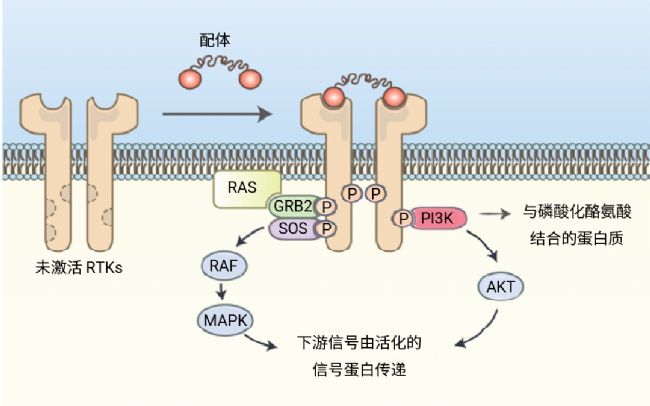 圖 2. RTKs 激活過程[2]。
圖 2. RTKs 激活過程[2]。
Section.02
RTKs家族大盤點
人類體內已鑒定出 58 種 RTKs,這些蛋白依據其細胞外結構域的組成差異被劃分為 20 個家族,其獨特的結構特征決定了它們在細胞信號傳導中功能的多樣性 (圖 1)[1][3]。同一家族的成員通常能夠識別并結合相同或結構相似的配體,從而激活特定的下游信號通路。
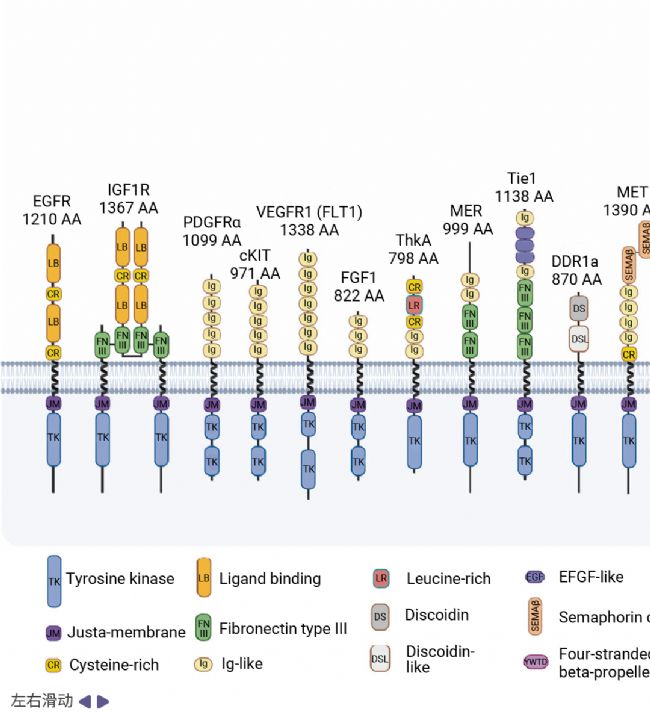
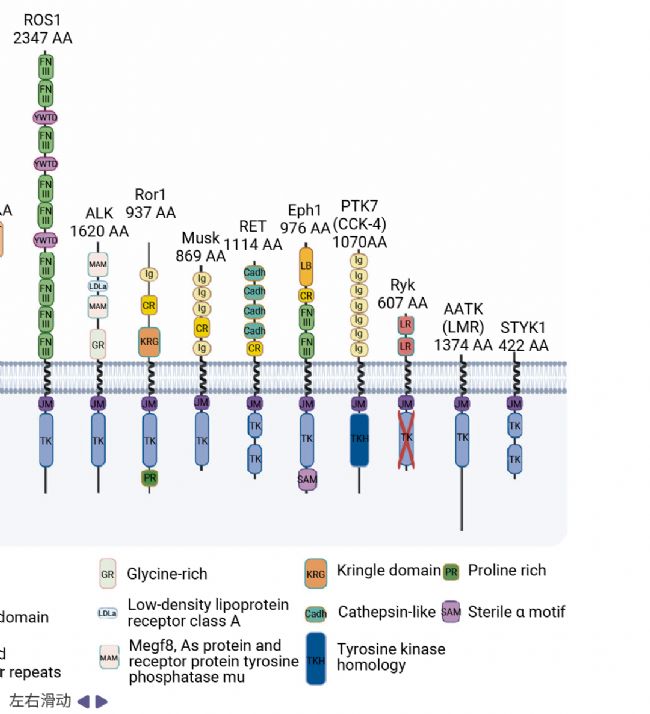
圖 3. 20 種受體酪氨酸激酶的結構[3]。
下面我們重點介紹下 RTKs 中的表皮生長因子受體 (EGFR/ErbB)、腎上腺素受體 (Eph) 和成纖維細胞生長因子受體 (FGFR)。
表皮生長因子受體 (EGFR/ErbB)
表皮生長因子受體 (EGFR/ErbB) 家族由四種高度同源的受體酪氨酸激酶構成,涵蓋 ErbB - 1 (HER1/EGFR)、ErbB - 2 (HER2/Neu)、ErbB - 3 (HER3) 和 ErbB - 4 (HER4)。這些受體在間充質、上皮及神經元來源的組織中廣泛表達,通過調控細胞的增殖、分化和存活,參與多種生理過程[4]。
EGFR 家族成員具備保守的跨膜結構,包含 N 端糖基化的胞外配體結合域、疏水跨膜區、近膜調節區、胞內酪氨酸激酶域以及 C 端尾部。
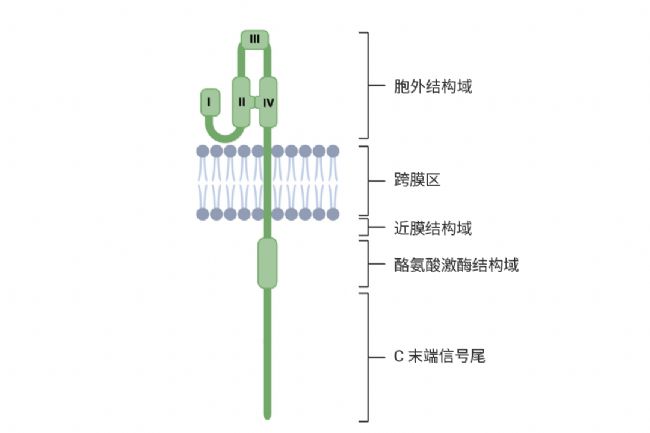 圖 4. ErbB-3 受體的單體形式示意圖[6]。
圖 4. ErbB-3 受體的單體形式示意圖[6]。
EGFR 不僅在上皮細胞、膠質細胞、肌肉細胞和神經元細胞譜系的確定方面至關重要,而且在惡性轉化等病理過程中也發揮著關鍵作用。其過表達已被公認為是與各種腫瘤類型相關的最常見的細胞失調現象之一[6]。
Eph 受體
Eph 受體是目前已知的受體酪氨酸激酶 (RTKs) 中最大的家族,其配體為產生促紅細胞生成素的肝癌受體相互作用蛋白 (Ephrins)[7]。在哺乳動物中,該家族已鑒定出 14 個成員。依據序列同源性、配體結合特性以及結構差異,它們被系統地劃分為 EPHA (包含 EPHA1 - 8 及 EPHA10) 和 EPHB (包含 EPHB1 - 4 及 EPHB6)。
從分子結構角度而言,Eph 受體具備高度保守的跨膜特征。其胞外區由 N 端球狀配體結合域、富含 20 個半胱氨酸的連接區以及兩個纖連蛋白 Ⅲ 型重復區構成。其中,球狀結構域決定了配體結合的亞族特異性。跨膜區由疏水氨基酸組成,而胞內區則涵蓋酪氨酸激酶活性域 (TK)、介導受體寡聚化的 SAM 結構域以及參與突觸后信號復合體組裝的 PDZ 結合基序[8]。
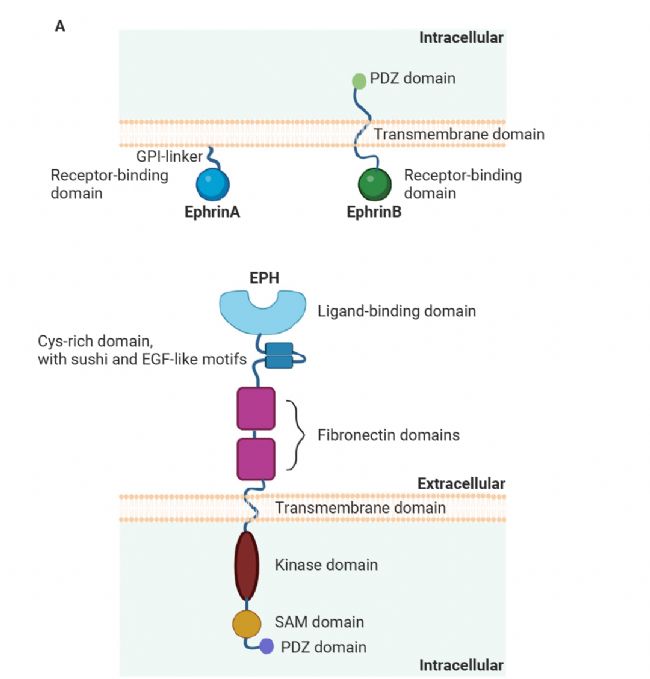 圖 5. Ephrins 與 Eph 受體的結構[8]。
圖 5. Ephrins 與 Eph 受體的結構[8]。
Eph 受體不僅在調節胚胎發育、組織邊界形成以及腫瘤細胞存活等過程中發揮著關鍵作用,還在動脈粥樣硬化、心肌再生等心血管疾病的干預方面展現出潛在的治療價值。
成纖維細胞生長因子受體 (FGFR)
成纖維細胞生長因子受體 (FGFR) 是一類具有高度保守性的跨膜酪氨酸激酶受體,能夠特異性地與成纖維細胞生長因子 (FGF) 蛋白家族的不同配體相結合。在脊椎動物中,已鑒定出五種不同的膜 FGFR,它們均隸屬于酪氨酸激酶超家族 (FGFR1、FGFR2、FGFR3、FGFR4、FGFR5)[9]。其中部分受體與病理狀況存在關聯,例如 FGFR3 中的點突變可經由組成型激活受體,進而引發軟骨發育不全。
FGFR 家族是發育過程中最為關鍵的旁分泌因子組之一,能夠精確調控中胚層分化、血管生成、肢體形態發生以及多種組織細胞的命運抉擇。
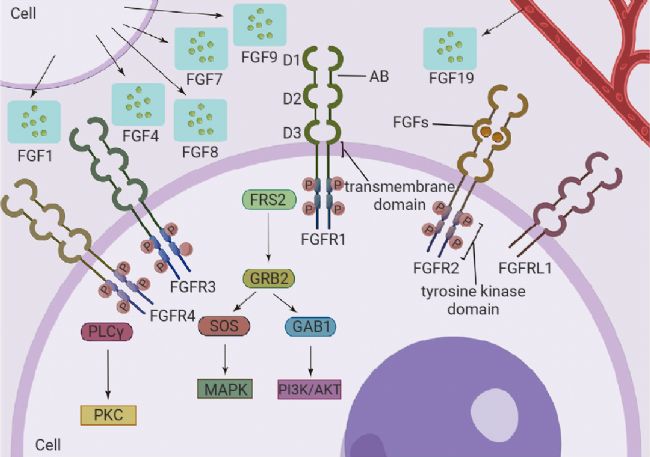 圖 6. FGFR 家族的基本結構[9]。
圖 6. FGFR 家族的基本結構[9]。
Section.03
RTKs 失調與癌癥
RTKs 通過調控細胞增殖、存活、遷移以及血管生成等關鍵通路,維持機體的正常生理穩態。但在癌癥的發生與發展過程中,RTKs 的異常激活是驅動腫瘤惡性轉化的核心機制之一。
在癌細胞中,RTKs 的失調主要由功能獲得性突變、過表達與基因組擴增、染色體重排、激酶結構域重復以及自分泌/旁分泌激活這五種機制介導[3][10]。這些機制會致使 RTKs 發生持續性磷酸化,進而過度激活下游的致癌信號通路,打破細胞生長與死亡的平衡,最終引發腫瘤轉移、血管生成以及治療耐藥性。
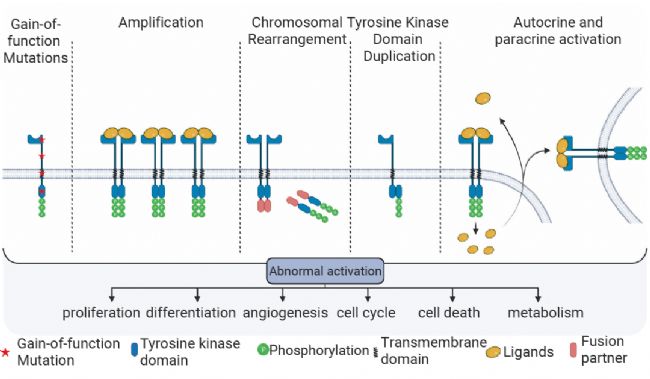 圖 7. RTKs 失調機制[3]。
圖 7. RTKs 失調機制[3]。
首先,EGFR 的突變主要集中于激酶結構域的保守區域 (外顯子18 - 21)[11]。例如,L858R 突變能夠穩固激酶的活性構象,使激酶無需二聚化便可持續激活下游 RAS/MAPK 信號通路,進而促進肺癌細胞的增殖[12]。此外,EGFR 的非激酶結構域突變同樣存在致癌的可能性。例如,在膠質母細胞瘤中發現的胞外結構域 P596L 和 G598V 突變會阻礙受體內吞過程,延長其信號傳導的持續時間,從而導致對酪氨酸激酶抑制劑 (如厄洛替尼) 的敏感性降低,產生耐藥性[13][14]。
其次,腫瘤中 FGFR 的失調主要體現為基因擴增,其次是突變和重排[15][16]。在 FGFR 家族中,FGFR1 和 FGFR4 的擴增頻率最高,由 FGFR1 擴增引發的癌癥包括激素受體陽性、人表皮生長因子受體 2 陽性和三陰性乳腺癌等[17]。當然,FGFR1 也會出現激活突變,最常見的是位于激活結構域的 N546K 和 K656E 突變,這些突變會致使體外激酶的激活和轉化增加。同時,FGFR 基因融合也可通過染色體重排或易位發生,進而導致受體二聚化和激活增加,以及 FGFR 或其融合伴侶基因的表達失調。FGFR1 - 3 的融合涉及多種不同的伴侶基因,并且已在多種癌癥中被檢測到,包括乳腺癌、尿路上皮癌、膠質母細胞瘤、頭頸部鱗狀細胞癌等。在這些癌癥中,大多數 FGFR 融合發生在框架內,以產生功能性嵌合蛋白。
總之,EGFR 不同結構域的突變及多樣化的 FGFR 異常激活,使其成為極具潛力的抗癌關注點。
關于 MCE
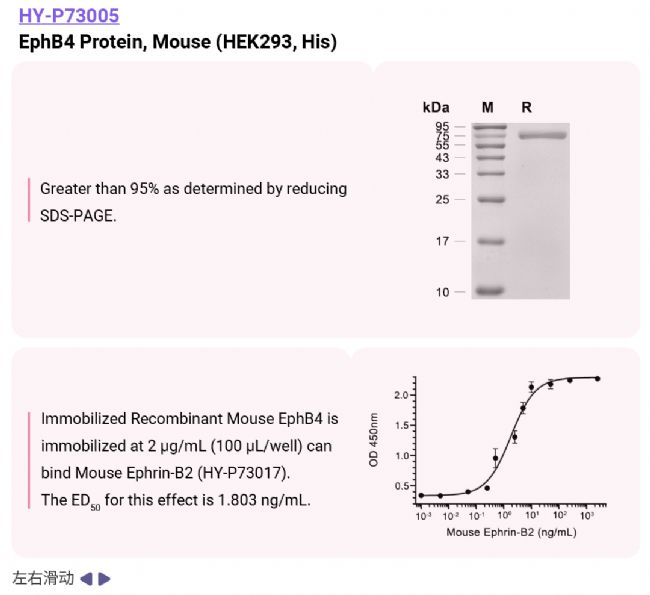
MCE 具備成熟的酶蛋白開發和生產經驗。同時,MCE 收錄了 1,200 + 種酪氨酸激酶信號通路相關的產品,可用于酪氨酸激酶相關疾病研究,助力科研,滿足您的實驗需求!現有 EGFR、Ephrin、FGHR Receptor 等熱門受體酪氨酸激酶重組蛋白,更有常用細胞因子、受體蛋白、泛素相關蛋白等產品!

[1] Zhang N, et al. Receptor tyrosine kinases: biological functions and anticancer targeted therapy. MedComm (2020). 2023;4(6):e446.
[2] Azad T, et al. Hippo Signaling Pathway as a Central Mediator of Receptors Tyrosine Kinases (RTKs) in Tumorigenesis. Cancers (Basel). 2020;12(8):2042.
[3] Tomuleasa C, et al. Therapeutic advances of targeting receptor tyrosine kinases in cancer. Signal Transduct Target Ther. 2024;9(1):201.
[4] Talukdar S, et al.. EGFR: An essential receptor tyrosine kinase-regulator of cancer stem cells. Adv Cancer Res. 2020;147:161-188.
[5] Chen Y, et al. ERBB3 targeting: A promising approach to overcoming cancer therapeutic resistance. Cancer Lett. 2024;599:217146.
[6] Yu J, et al. Antibody-Drug Conjugates Targeting the Human Epidermal Growth Factor Receptor Family in Cancers. Front Mol Biosci. 2022;9:847835.
[7] Zhu Y, et al. Recent advances of the Ephrin and Eph family in cardiovascular development and pathologies. iScience. 2024;27(8):110556.
[8] Stergiou IE, et al. EPH/Ephrin Signaling in Normal Hematopoiesis and Hematologic Malignancies: Deciphering Their Intricate Role and Unraveling Possible New Therapeutic Targets. Cancers (Basel). 2023;15(15):3963.
[9] Liu Q, et al. FGFR families: biological functions and therapeutic interventions in tumors. MedComm (2020). 2023;4(5):e367.
[10] Ebrahimi N, et al. Receptor tyrosine kinase inhibitors in cancer. Cell Mol Life Sci. 2023;80(4):104.
[11] Gotoh N. Somatic mutations of the EGF receptor and their signal transducers affect the efficacy of EGF receptor-specific tyrosine kinase inhibitors. Int J Clin Exp Pathol. 2011;4(4):403-409.
[12] Kannan S, et al. Conformational landscape of the epidermal growth factor receptor kinase reveals a mutant specific allosteric pocket. Chem Sci. 2018;9(23):5212-5222.
[13] Riese DJ 2nd, et al. Mutational activation of ErbB family receptor tyrosine kinases: insights into mechanisms of signal transduction and tumorigenesis. Bioessays. 2007;29(6):558-565.
[14] Hayes TK, et al. Comprehensive mutational scanning of EGFR reveals TKI sensitivities of extracellular domain mutants. Nat Commun. 2024;15(1):2742.
[15] Zhang P, et al. Targeting FGFR for cancer therapy. J Hematol Oncol. 2024;17(1):39.
[16] Liu Q, et al. FGFR families: biological functions and therapeutic interventions in tumors. MedComm (2020). 2023;4(5):e367.
[17] Krook MA, et al. Fibroblast growth factor receptors in cancer: genetic alterations, diagnostics, therapeutic targets and mechanisms of resistance. Br J Cancer. 2021;124(5):880-892.
Section.01
RTKs,
了解一下!
提到酶,大家最熟悉的應該是這一對:激酶 (Kinase) —— 磷酸化,磷酸化酶 (Phosphorylase) —— 去磷酸化。具體小 M 不再贅述,感興趣的小伙伴可以翻翻往期推文:“激酶”與“磷酸酶”,靶向治療兩手抓。
本期我們重點要聊的是信號通路中的重要參與者——蛋白激酶!其中,受體酪氨酸激酶 (Receptor Tyrosine Kinases, RTKs) 具備激酶與受體的雙重功能,是規模最大的一類跨膜酶聯受體!
- 受體功能: 作為細胞表面的高親和性受體,RTKs 能夠精準識別并結合多種生長因子、細胞因子和激素等配體,進而觸發下游靶蛋白酪氨酸殘基的磷酸化級聯反應
- 激酶功能: 一旦結合配體,其胞內激酶域就會激活,通過酪氨酸磷酸化來啟動下游信號傳遞。
RTKs 的結構組成
RTKs 家族由保守的結構域構成,即具備配體結合位點的細胞外結構域、單次跨膜的疏水 α 螺旋區,以及擁有酪氨酸蛋白激酶 (PTK) 活性的細胞內結構域[1][2]。
- 細胞外結構域:具備配體 (生長因子) 結合位點,負責識別并結合特定配體。此部分包含多種具有特定氨基酸序列的結構域,例如富半胱氨酸結構域、酸性結構域、免疫球蛋白樣結構域等。
- 跨膜區:通常為單次跨膜的疏水 α 螺旋區,起到連接胞外區與胞內區的作用。
- 細胞內結構域:含有酪氨酸蛋白激酶活性域,借助自磷酸化以及對下游信號蛋白的磷酸化來啟動信號轉導。
 圖 1. RTKs 結構域[2]。
圖 1. RTKs 結構域[2]。RTKs 的激活
RTKs 的激活是一個多維度的過程,受外部配體可及性與內在受體構象動力學之間微妙平衡的影響[1][3]。在分子層面上,RTKs 激活并非單一的事件,而是不同調節機制的匯聚,這些機制反映了它們所調控的復雜生物系統。
激活機制:配體結合首先促使受體二聚化,解除激酶域的自抑制狀態;接著觸發受體間的自磷酸化反應,在胞內區形成磷酸化酪氨酸殘基,進而穩定激酶的活性構象。這些磷酸化位點充當分子錨點,特異性地招募含有 SH2 或 PTB 結構域的下游信號適配蛋白 (如 Grb2、SOS)。激活后的信號蛋白隨后啟動 Ras - MAPK、PI3K - Akt 等核心信號級聯通路,最終通過信號放大精確調控細胞增殖、分化等關鍵生理過程。
 圖 2. RTKs 激活過程[2]。
圖 2. RTKs 激活過程[2]。Section.02
RTKs家族大盤點
人類體內已鑒定出 58 種 RTKs,這些蛋白依據其細胞外結構域的組成差異被劃分為 20 個家族,其獨特的結構特征決定了它們在細胞信號傳導中功能的多樣性 (圖 1)[1][3]。同一家族的成員通常能夠識別并結合相同或結構相似的配體,從而激活特定的下游信號通路。


圖 3. 20 種受體酪氨酸激酶的結構[3]。
下面我們重點介紹下 RTKs 中的表皮生長因子受體 (EGFR/ErbB)、腎上腺素受體 (Eph) 和成纖維細胞生長因子受體 (FGFR)。
表皮生長因子受體 (EGFR/ErbB)
表皮生長因子受體 (EGFR/ErbB) 家族由四種高度同源的受體酪氨酸激酶構成,涵蓋 ErbB - 1 (HER1/EGFR)、ErbB - 2 (HER2/Neu)、ErbB - 3 (HER3) 和 ErbB - 4 (HER4)。這些受體在間充質、上皮及神經元來源的組織中廣泛表達,通過調控細胞的增殖、分化和存活,參與多種生理過程[4]。
EGFR 家族成員具備保守的跨膜結構,包含 N 端糖基化的胞外配體結合域、疏水跨膜區、近膜調節區、胞內酪氨酸激酶域以及 C 端尾部。
 圖 4. ErbB-3 受體的單體形式示意圖[6]。
圖 4. ErbB-3 受體的單體形式示意圖[6]。EGFR 不僅在上皮細胞、膠質細胞、肌肉細胞和神經元細胞譜系的確定方面至關重要,而且在惡性轉化等病理過程中也發揮著關鍵作用。其過表達已被公認為是與各種腫瘤類型相關的最常見的細胞失調現象之一[6]。
Eph 受體
Eph 受體是目前已知的受體酪氨酸激酶 (RTKs) 中最大的家族,其配體為產生促紅細胞生成素的肝癌受體相互作用蛋白 (Ephrins)[7]。在哺乳動物中,該家族已鑒定出 14 個成員。依據序列同源性、配體結合特性以及結構差異,它們被系統地劃分為 EPHA (包含 EPHA1 - 8 及 EPHA10) 和 EPHB (包含 EPHB1 - 4 及 EPHB6)。
從分子結構角度而言,Eph 受體具備高度保守的跨膜特征。其胞外區由 N 端球狀配體結合域、富含 20 個半胱氨酸的連接區以及兩個纖連蛋白 Ⅲ 型重復區構成。其中,球狀結構域決定了配體結合的亞族特異性。跨膜區由疏水氨基酸組成,而胞內區則涵蓋酪氨酸激酶活性域 (TK)、介導受體寡聚化的 SAM 結構域以及參與突觸后信號復合體組裝的 PDZ 結合基序[8]。
 圖 5. Ephrins 與 Eph 受體的結構[8]。
圖 5. Ephrins 與 Eph 受體的結構[8]。Eph 受體不僅在調節胚胎發育、組織邊界形成以及腫瘤細胞存活等過程中發揮著關鍵作用,還在動脈粥樣硬化、心肌再生等心血管疾病的干預方面展現出潛在的治療價值。
成纖維細胞生長因子受體 (FGFR)
成纖維細胞生長因子受體 (FGFR) 是一類具有高度保守性的跨膜酪氨酸激酶受體,能夠特異性地與成纖維細胞生長因子 (FGF) 蛋白家族的不同配體相結合。在脊椎動物中,已鑒定出五種不同的膜 FGFR,它們均隸屬于酪氨酸激酶超家族 (FGFR1、FGFR2、FGFR3、FGFR4、FGFR5)[9]。其中部分受體與病理狀況存在關聯,例如 FGFR3 中的點突變可經由組成型激活受體,進而引發軟骨發育不全。
FGFR 家族是發育過程中最為關鍵的旁分泌因子組之一,能夠精確調控中胚層分化、血管生成、肢體形態發生以及多種組織細胞的命運抉擇。
 圖 6. FGFR 家族的基本結構[9]。
圖 6. FGFR 家族的基本結構[9]。Section.03
RTKs 失調與癌癥
RTKs 通過調控細胞增殖、存活、遷移以及血管生成等關鍵通路,維持機體的正常生理穩態。但在癌癥的發生與發展過程中,RTKs 的異常激活是驅動腫瘤惡性轉化的核心機制之一。
在癌細胞中,RTKs 的失調主要由功能獲得性突變、過表達與基因組擴增、染色體重排、激酶結構域重復以及自分泌/旁分泌激活這五種機制介導[3][10]。這些機制會致使 RTKs 發生持續性磷酸化,進而過度激活下游的致癌信號通路,打破細胞生長與死亡的平衡,最終引發腫瘤轉移、血管生成以及治療耐藥性。
 圖 7. RTKs 失調機制[3]。
圖 7. RTKs 失調機制[3]。首先,EGFR 的突變主要集中于激酶結構域的保守區域 (外顯子18 - 21)[11]。例如,L858R 突變能夠穩固激酶的活性構象,使激酶無需二聚化便可持續激活下游 RAS/MAPK 信號通路,進而促進肺癌細胞的增殖[12]。此外,EGFR 的非激酶結構域突變同樣存在致癌的可能性。例如,在膠質母細胞瘤中發現的胞外結構域 P596L 和 G598V 突變會阻礙受體內吞過程,延長其信號傳導的持續時間,從而導致對酪氨酸激酶抑制劑 (如厄洛替尼) 的敏感性降低,產生耐藥性[13][14]。
其次,腫瘤中 FGFR 的失調主要體現為基因擴增,其次是突變和重排[15][16]。在 FGFR 家族中,FGFR1 和 FGFR4 的擴增頻率最高,由 FGFR1 擴增引發的癌癥包括激素受體陽性、人表皮生長因子受體 2 陽性和三陰性乳腺癌等[17]。當然,FGFR1 也會出現激活突變,最常見的是位于激活結構域的 N546K 和 K656E 突變,這些突變會致使體外激酶的激活和轉化增加。同時,FGFR 基因融合也可通過染色體重排或易位發生,進而導致受體二聚化和激活增加,以及 FGFR 或其融合伴侶基因的表達失調。FGFR1 - 3 的融合涉及多種不同的伴侶基因,并且已在多種癌癥中被檢測到,包括乳腺癌、尿路上皮癌、膠質母細胞瘤、頭頸部鱗狀細胞癌等。在這些癌癥中,大多數 FGFR 融合發生在框架內,以產生功能性嵌合蛋白。
總之,EGFR 不同結構域的突變及多樣化的 FGFR 異常激活,使其成為極具潛力的抗癌關注點。
關于 MCE
MCE 具備成熟的酶蛋白開發和生產經驗。同時,MCE 收錄了 1,200 + 種酪氨酸激酶信號通路相關的產品,可用于酪氨酸激酶相關疾病研究,助力科研,滿足您的實驗需求!現有 EGFR、Ephrin、FGHR Receptor 等熱門受體酪氨酸激酶重組蛋白,更有常用細胞因子、受體蛋白、泛素相關蛋白等產品!


|
產品推薦 |
|
EGFR/ErbB 家族由四種緊密相關的受體酪氨酸激酶組成,分別是 ErbB-1 (HER1/EGFR)、ErbB-2 (HER2)、ErbB-3 (HER3) 和 ErbB-4 (HER4)。 |
|
Eph 受體可分為 EphA 或 EphB 亞家族,嚙齒動物中有 9 個EphA 和 5 個 EphB 成員。 |
|
在人類中,目前鑒定出 6 個 FGFR 家族成員 (FGFR1-6)。 |
|
TAM 受體家族由三種保守的受體酪氨酸激酶組成,即 Tyro3、Axl 和 Mer。 |
|
血管內皮生長因子受體 (VEGFR) 家族 由三種蛋白酪氨酸激酶 (VEGFR1、VEGFR2 和 VEGFR3) 和兩種非蛋白激酶共受體 (neuropilin-1 和 neuropilin-2) 組成。 |
|
Trk 家族由 TrkA、TrkB 和 TrkC 三種受體酪氨酸激酶 (RTKs) 組成,又稱為神經營養酪氨酸受體激酶。 |
|
受體酪氨酸激酶樣孤兒受體 (ROR) 家族,包含細胞外卷曲樣半胱氨酸富結構域 (CRDs) 和膜近端 Kringle 結構域。在脊椎動物中,RORs 家族由 Ror1 和 Ror2 兩個結構相關的成員組成。 |
|
血小板衍生生長因子受體 (PDGFRs) 主要位于血管內皮細胞、成纖維細胞和 Kupffer 細胞,有 PDGFR-α 和 PDGFR-β 兩種類型。 |
|
盤狀結構域受體氨酸激酶 (DDRs) 家族包括兩個不同的成員,DDR1 和 DDR2。DDRs 表達廣泛,DDR1 主要表達于上皮細胞,DDR2 主要表達于間充質細胞。 |

[1] Zhang N, et al. Receptor tyrosine kinases: biological functions and anticancer targeted therapy. MedComm (2020). 2023;4(6):e446.
[2] Azad T, et al. Hippo Signaling Pathway as a Central Mediator of Receptors Tyrosine Kinases (RTKs) in Tumorigenesis. Cancers (Basel). 2020;12(8):2042.
[3] Tomuleasa C, et al. Therapeutic advances of targeting receptor tyrosine kinases in cancer. Signal Transduct Target Ther. 2024;9(1):201.
[4] Talukdar S, et al.. EGFR: An essential receptor tyrosine kinase-regulator of cancer stem cells. Adv Cancer Res. 2020;147:161-188.
[5] Chen Y, et al. ERBB3 targeting: A promising approach to overcoming cancer therapeutic resistance. Cancer Lett. 2024;599:217146.
[6] Yu J, et al. Antibody-Drug Conjugates Targeting the Human Epidermal Growth Factor Receptor Family in Cancers. Front Mol Biosci. 2022;9:847835.
[7] Zhu Y, et al. Recent advances of the Ephrin and Eph family in cardiovascular development and pathologies. iScience. 2024;27(8):110556.
[8] Stergiou IE, et al. EPH/Ephrin Signaling in Normal Hematopoiesis and Hematologic Malignancies: Deciphering Their Intricate Role and Unraveling Possible New Therapeutic Targets. Cancers (Basel). 2023;15(15):3963.
[9] Liu Q, et al. FGFR families: biological functions and therapeutic interventions in tumors. MedComm (2020). 2023;4(5):e367.
[10] Ebrahimi N, et al. Receptor tyrosine kinase inhibitors in cancer. Cell Mol Life Sci. 2023;80(4):104.
[11] Gotoh N. Somatic mutations of the EGF receptor and their signal transducers affect the efficacy of EGF receptor-specific tyrosine kinase inhibitors. Int J Clin Exp Pathol. 2011;4(4):403-409.
[12] Kannan S, et al. Conformational landscape of the epidermal growth factor receptor kinase reveals a mutant specific allosteric pocket. Chem Sci. 2018;9(23):5212-5222.
[13] Riese DJ 2nd, et al. Mutational activation of ErbB family receptor tyrosine kinases: insights into mechanisms of signal transduction and tumorigenesis. Bioessays. 2007;29(6):558-565.
[14] Hayes TK, et al. Comprehensive mutational scanning of EGFR reveals TKI sensitivities of extracellular domain mutants. Nat Commun. 2024;15(1):2742.
[15] Zhang P, et al. Targeting FGFR for cancer therapy. J Hematol Oncol. 2024;17(1):39.
[16] Liu Q, et al. FGFR families: biological functions and therapeutic interventions in tumors. MedComm (2020). 2023;4(5):e367.
[17] Krook MA, et al. Fibroblast growth factor receptors in cancer: genetic alterations, diagnostics, therapeutic targets and mechanisms of resistance. Br J Cancer. 2021;124(5):880-892.


標簽:
癌癥
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






