Western實驗中Actin有多條帶的原因分析
Actin相信大家再熟悉不過了,無論做哪個蛋白的Western,它總是不離不棄,需要你一直帶著。它也是真核生物中含量最豐富的蛋白質之一,含量豐富意味著容易檢測。大家回憶一下,第一次做Western是不是就是做的actin。可偏偏最簡單的事情,卻很難每次都做出完美的條帶,總會出一些意想不到的結果。
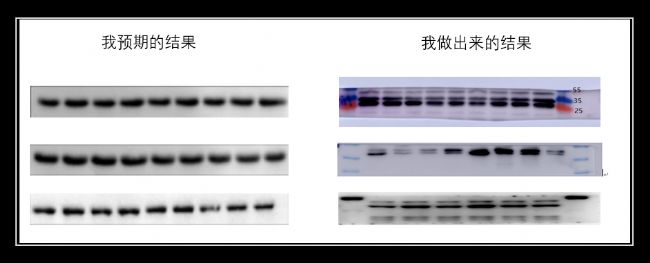
如果內參actin跑不好,其他目的蛋白想跑出漂亮條帶的難度也會大大增加,就好比地基沒打好,很難建成高樓。今天小優細節君就來幫大家分析下為什么actin會有多條帶?
蛋白特性
Western實驗最重要的兩個因素,一是蛋白,二是抗體。要探究原因,必須從源頭出發,我們先看看蛋白特性。
研究發現,有很多蛋白酶可以降解actin,使原本42KDa的actin變成更短的片段,40-41KDa、37KDa、30-32KDa、10-15KDa等。
圖1是凝血酶Thrombin作用不同時間后G-actin和F-actin的降解情況,主要生成37KDa(K),27KDa(L)和10KDa(M)條帶。
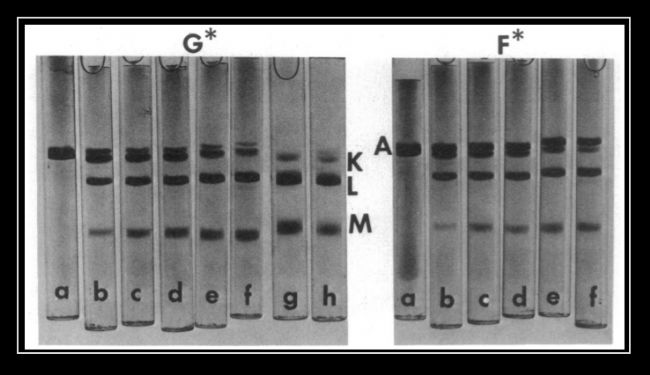
圖1
圖2是組織蛋白酶Cathepsin L作用不同時間后actin的降解情況,先生成40KDa和30KDa的條帶,隨著時間增加,又出現了37KDa的條帶。
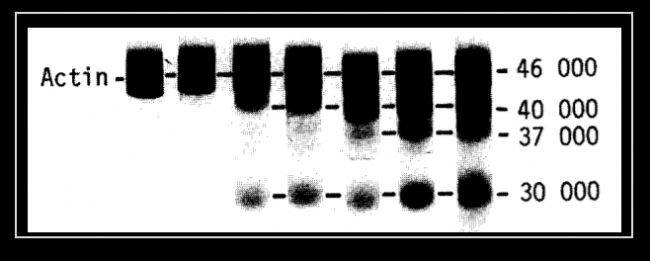
圖2
圖3是彈性硬蛋白酶(PMN-Elastase)剪切actin的情況,生成了37KDa的條帶,剪切位點在Val43 and Met44之間。
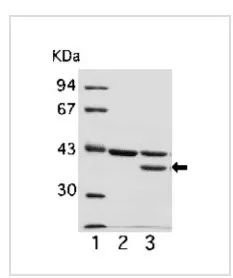
圖3
圖4是白介1β轉化酶(ICE)作用不同時間后actin的降解情況,先生成了41KD的條帶,隨著時間增加,又出現了30KD和14KD的條帶。
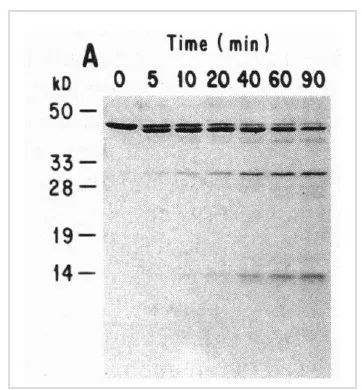
圖4
圖5是半胱氨酸蛋白酶3(caspase-3)剪切actin的情況,和ICE酶類似,凋亡情況下,actin會被剪切,產生多條帶。而被 caspase-3 剪切的actin,會被泛素/蛋白酶體加速降解。
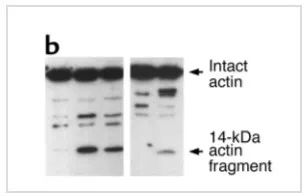
圖5
還有許多尚未發現的酶都有可能對actin有剪切和降解作用,看到這里,有小伙伴會問,我做的課題又沒加這些酶,為什么還是會有多條帶呢?
其實不然,像上面提及的凝血酶、組織蛋白酶等是本身存在且廣泛分布的,在提取蛋白的過程中就會將它們釋放出來,成為降解actin的“兇手”。為什么我們一直強調制樣要加入蛋白酶抑制劑,以及冰上操作,就是為了抑制這些酶的活性。
那是不是加了蛋白酶抑制劑就萬事大吉了呢?
研究發現,即使添加了多種蛋白酶抑制劑,包括桿菌肽(bacitracin),亮肽素(leupeptin),抑肽素(pepstatin),抗蛋白酶(antipain),苯甲基磺酰氟(PMSF)等,還是無法抑制凋亡對內參的降解(圖6)。所以,我們還要盡量保持細胞處于良好的狀態和較低的傳代次數,避免發生凋亡。而對于研究凋亡的小伙伴來說,需要根據具體情況選擇合適的抗體或者考慮其他內參。
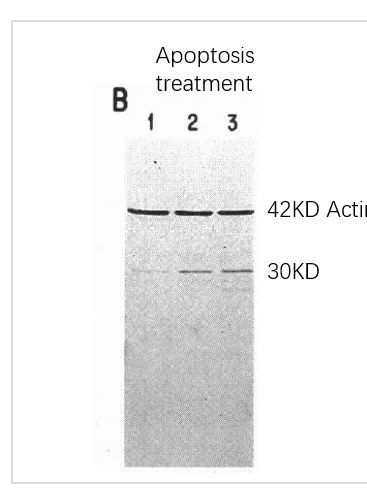
圖6
抗體特性
這時又小伙伴又問了,我按照要求制樣之后還有多條帶,怎么辦呢?
前面我們提到了Western的兩大影響因素,除了蛋白本身,我們還可以從抗體入手,工欲善其事,必先利其器。Actin最常見的剪切片段是37 kDa,是因為許多酶都會在N端進行剪切,大概在Val43,或者更靠近N端的位點。這時我們可以在選擇抗體的時候花一點“小心思”,盡量選擇免疫原在N端,并且比剪切位點更靠近N端的抗體,就可以盡量“避免”識別剪切下來的片段,從而獲得單一條帶。這里需要注意,此時我們獲得的Western結果雖然是單一條帶,但不能反映樣本本身是否降解或剪切。如果剪切位點在靠近C端的位置,抗體也會識別大片段。
還有一點需要注意,actin的N端序列在物種間的保守程度不如C端,因此這類抗體識別的種屬范圍不如其他C端抗體或者多克隆抗體廣,但特異性較高。
總結一下,如果你在實驗中發現actin的條帶總是出現其他固定位置的條帶,比如37kDa、30 kDa等,很有可能就是酶的作用使actin發生了剪切。建議使用新鮮的組織或者健康的細胞進行重新制樣,制樣過程中充分抑制蛋白酶活性。選擇抗體盡量選擇N端單克隆抗體,可以事半功倍。希望大家都能做出完美的actin單一條帶~
部分推薦產品
|
貨號 |
免疫原序列 |
|
N端,不與γ actin反應 |
|
|
N端,可與γ actin反應 |
|
|
N端 |
|
|
N端 |
|
|
N端 |
參考文獻
1.S Yamashita, et al. Characterization of a Protease Responsible for Truncated Actin Increase in Neutrophils of Patients with Behçet’s Disease. Biol Pharm Bull. 2001 Feb;24(2):119-22.
2.L Muszbek, et al. Cleavage of Actin by Thrombin. Proc Natl Acad Sci USA. 1974 Jun;71(6):2208-11.
3.U Matsukura, et al. Mode of degradation of myofibrillar proteins by an endogenous protease, cathepsin L. Biochim Biophys Acta. 1981 Nov 13;662(1):41-7.
4.C Kayalar, et al. Cleavage of actin by interleukin 1 beta-converting enzyme to reverse DNase I inhibition. Proc Natl Acad Sci USA. 1996 Mar 5;93(5):2234-8.
5.Jie Du, et al. Activation of caspase-3 is an initial step triggering accelerated muscle proteolysis in catabolic conditions. J Clin Invest. 2004 Jan;113(1):115-23.






