攻克磷酸酶、轉(zhuǎn)錄因子、KRAS三種“不可成藥”靶點的應(yīng)對策略
隨著對癌癥進(jìn)展的分子基礎(chǔ)和多種驅(qū)動因素的深入理解,科學(xué)家開始尋找能夠高效抑制生長因子受體、酶類或其他靶點的藥物。
如圖 1 所示,許多的癌癥靶點都有破壞其功能的藥物,通常被認(rèn)為是“可成藥”的藥物靶點 (紅色標(biāo)注)。磷酸酶、轉(zhuǎn)錄因子和 RAS 家族成員是“不可成藥”的三大類靶點 (綠色標(biāo)注)。
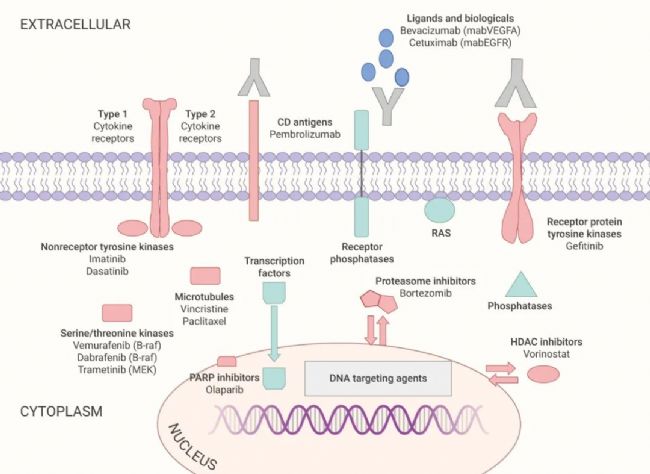
圖 1. 當(dāng)代癌癥藥物分子靶點的示意圖[1]
RAS 是人類癌癥中最常發(fā)生突變的癌基因;RAS 存在三種不同的亞型 (KRAS、HRAS 和 NRAS) 中,它們具有高度的序列同源性。RAS 蛋白具有固有的 GTPase 活性,在非活性 (GDP 結(jié)合) 和活性 (GTP 結(jié)合) 形式之間循環(huán)。當(dāng)與 GTP 結(jié)合時,它被“打開”并激活細(xì)胞內(nèi)信號通路,突變的 RAS 被持續(xù)性激活并持續(xù)“開啟”,從而增強下游信號并導(dǎo)致腫瘤發(fā)生。
下面簡單總結(jié)了針對 RAS 突變腫瘤抑制劑主要包括:抑制 RAS 上游蛋白、RAS 蛋白以及 RAS 下游蛋白三個層面的抑制劑。
■ 抑制 RAS 上游蛋白
受體酪氨酸激酶的激活,如 EGFR 家族成員,可促進(jìn) RAS 中 GDP 與 GTP 的交換,從而激活 RAS。那么,抑制 EGFR 可以減少這種激活。突變 RAS 蛋白以 GTP 結(jié)合狀態(tài)積累。抑制 SOS 或 SHP2 會降低 GDP-GTP 交換率,并減少 GTP 結(jié)合的 RAS 數(shù)量。
■ 直接靶向 RAS 蛋白在10年前,直接針對 RAS 抑制劑還非常難以捉摸,隨著科學(xué)家的不斷努力,KRAS 抑制劑 Sotorasib 獲 FDA 批準(zhǔn)上市, 用于治療 KRAS G12C 突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌成年患者。此外還有 KRAS-G12C 結(jié)合的共價等位基因特異性抑制劑等正在臨床實驗階段。
■ 靶向 RAS 下游蛋白GTP 結(jié)合的 RAS 通過與效應(yīng)蛋白(如 RAF 和 p110)的 RAS 結(jié)合域結(jié)合來激活下游信號,從而分別激活 MAPK 和 PI3K 信號通路。MAPK 和 PI3K 信號通路的每個激酶層面都可以被抑制的。
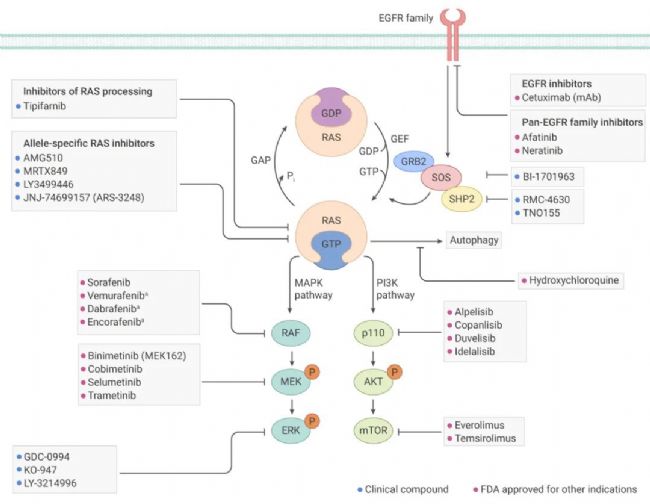
圖 3. RAS 突變腫瘤抑制劑的研究進(jìn)展[4]
轉(zhuǎn)錄因子在癌癥、自身免疫、糖尿病和心血管疾病等疾病中扮演著十分重要的生物學(xué)角色。然而,由于嚴(yán)重的結(jié)構(gòu)紊亂和缺乏明確的小分子結(jié)合腔,轉(zhuǎn)錄因子在傳統(tǒng)上被認(rèn)為是“不可治療”的靶點。
在許多癌癥進(jìn)程中,轉(zhuǎn)錄因子可以通過多種作用機制發(fā)生突變或失調(diào),包括:染色體易位、基因擴增或缺失、點突變和表達(dá)改變等。突變或失調(diào)的轉(zhuǎn)錄因子可以介導(dǎo)異常的靶基因表達(dá),是一類獨特的藥物靶點。
目前已經(jīng)證明了多種靶向轉(zhuǎn)錄因子活性的方法,主要包括
■ 抑制轉(zhuǎn)錄因子-輔因子的蛋白質(zhì)-蛋白質(zhì)相互作用;
■ 抑制轉(zhuǎn)錄因子和 DNA 結(jié)合;
■ 通過改變泛素化水平和隨后的蛋白酶體降解或通過抑制轉(zhuǎn)錄因子表達(dá)調(diào)節(jié)因子,以調(diào)節(jié)轉(zhuǎn)錄因子活性水平。
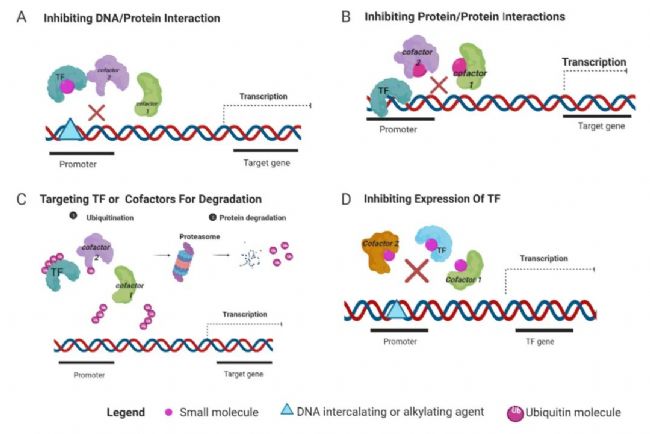
圖 4. 靶向轉(zhuǎn)錄因子的作用機制[6]
A. 特異性小分子阻斷轉(zhuǎn)錄因子/DNA 相互作用。B. 小分子抑制轉(zhuǎn)錄因子/蛋白質(zhì)相互作用。C. 靶向轉(zhuǎn)錄因子或輔因子并通過泛素化進(jìn)行降解。D. 通過抑制轉(zhuǎn)錄調(diào)節(jié)劑來控制轉(zhuǎn)錄因子的表達(dá)。
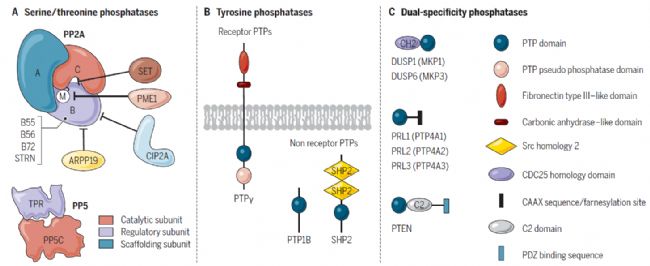
圖 5. 磷酸酶家族[8]
A. 絲氨酸/蘇氨酸磷酸酶,B. 酪氨酸磷酸酶(PTPs),C. 或能夠使絲氨酸/蘇氨酸殘基和酪氨酸殘基(DUSP/MKP和PRL磷酸酶) 去磷酸化的雙特異性磷酸酶(DUPs)
與它相對應(yīng)的蛋白激酶已經(jīng)是非常成熟的藥物靶點。然而,安全有效的磷酸酶抑制劑仍然難以尋覓。因此,磷酸酶在傳統(tǒng)上被認(rèn)為是“不可治療”的靶點。
最近,這一領(lǐng)域發(fā)生了突破性進(jìn)展。不同于大多數(shù)藥物與它們靶點的活性位點相結(jié)合,這些磷酸酶抑制劑的作用方式是與活性位點之外的別構(gòu)位點相結(jié)合。別構(gòu)抑制可能是打破磷酸酶“不可成藥”性的成功策略。
如圖 6 所示,SHP2 抑制劑 SHP099、RMC-4630 和 SHP244 結(jié)合致癌性 SHP2 磷酸酶的 SH2 結(jié)構(gòu)域和激酶結(jié)構(gòu)域,并將酶鎖定在非活性構(gòu)象中。BCI-215 作為 DUSP1 和 DUSP6 的變構(gòu)抑制劑,可結(jié)合在磷酸酶催化位點附近,阻礙底物結(jié)合所需的變構(gòu)變化。PP2A 的間接活化劑 FTY720 和 CC11 與二聚體 PP2A 抑制劑蛋白質(zhì) SET 結(jié)合并釋放 SET 單體以允許 PP2A 催化亞單位的催化活性。
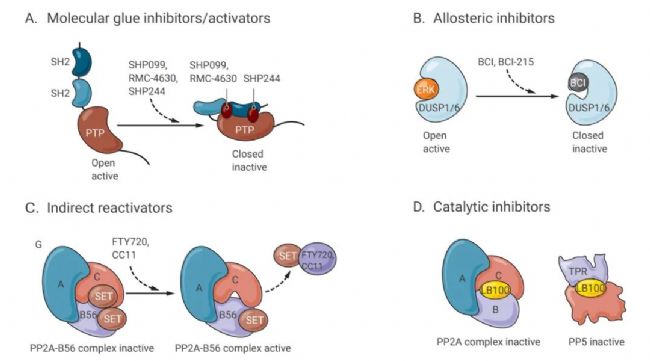
圖 6. 磷酸酶靶向治療的作用模式[8]
在過去的十年中,分子癌癥靶點得到了顯著的驗證,這些靶點以前被認(rèn)為是具有挑戰(zhàn)性的,甚至是不可克服的。其中,最顯著的是“不可成藥”的三大類靶點:磷酸酶、轉(zhuǎn)錄因子和 RAS 家族成員。
隨著科學(xué)技術(shù)的不斷進(jìn)步,新型的小分子抑制劑 (激動劑) 和生物制劑的開發(fā)和應(yīng)用極大地促進(jìn)了抗腫瘤的新藥研發(fā)。展望未來,我們相信:靶向“不可成藥”靶點,攻克癌癥指日可待。
參考文獻(xiàn)
1. Lazo JS, Sharlow ER. Drugging Undruggable Molecular Cancer Targets. Annu Rev Pharmacol Toxicol. 2016;56:23-40.
2. Blair HA. Sotorasib: First Approval. Drugs. 2021 Sep;81(13):1573-1579. doi: 10.1007/s40265-021-01574-2.
3. Cox AD, Fesik SW, Kimmelman AC, Luo J, Der CJ. Drugging the undruggable RAS: Mission possible? Nat Rev Drug Discov. 2014 Nov;13(11):828-51.
4. Moore AR, Rosenberg SC, McCormick F, Malek S. RAS-targeted therapies: is the undruggable drugged? Nat Rev Drug Discov. 2020 Aug;19(8):533-552.
5. Henley MJ, Koehler AN. Advances in targeting 'undruggable' transcription factors with small molecules. Nat Rev Drug Discov. 2021 Sep;20(9):669-688.
6. Walters HA, Temesvari LA. Target acquired: transcriptional regulators as drug targets for protozoan parasites. Int J Parasitol. 2021 Jul;51(8):599-611.
7. Bushweller JH. Targeting transcription factors in cancer - from undruggable to reality. Nat Rev Cancer. 2019 Nov;19(11):611-624.
8. Vainonen JP, Momeny M, Westermarck J. Druggable cancer phosphatases. Sci Transl Med. 2021 Apr 7;13(588):eabe2967.
- 受擠壓的細(xì)胞記住自身形狀以高效遷移的機制科普
- 全新細(xì)胞死亡方式Mitoxyperilysis的機制及其在疾病治療中的價值
- 實驗性自身免疫性腦脊髓炎(EAE)造模誘導(dǎo)方法及核心試劑的優(yōu)勢和作用
- 細(xì)胞因子IL-10 、IL-12、干擾素及腫瘤壞死因子 (TNF) 家族介紹及應(yīng)用
- 受體酪氨酸激酶 (RTKs)結(jié)構(gòu)組成、激活機制及其在抗癌研究中的應(yīng)用
- OCT包埋劑的作用原理、使用方法及應(yīng)用
- PBS緩沖液的功能、作用機制及在生命科學(xué)研究中的多場景應(yīng)用
- Dexamethasone地塞米松(DEX)在構(gòu)建動物疾病模型中的應(yīng)用






