單細(xì)胞轉(zhuǎn)錄組測(cè)序技術(shù)的原理、方法與應(yīng)用分析
單細(xì)胞轉(zhuǎn)錄組測(cè)序技術(shù)作為細(xì)胞生物學(xué)研究的革命性工具,能夠在單細(xì)胞分辨率下解析基因表達(dá)譜,揭示細(xì)胞異質(zhì)性、發(fā)育軌跡及微環(huán)境互作等復(fù)雜生物學(xué)過程。與群體細(xì)胞測(cè)序相比,該技術(shù)通過分析單個(gè)細(xì)胞的轉(zhuǎn)錄組信息,避免了細(xì)胞群體平均化帶來的信息損失。
實(shí)現(xiàn)單細(xì)胞轉(zhuǎn)錄組測(cè)序需克服兩大核心技術(shù)挑戰(zhàn):
1. PCR擴(kuò)增偏差控制
單個(gè)細(xì)胞僅含約10 pg總RNA,其中mRNA含量更低。為達(dá)到測(cè)序所需的核酸量,擴(kuò)增倍數(shù)需超過百萬倍。在此過程中,即使微小的擴(kuò)增效率差異也會(huì)在指數(shù)擴(kuò)增后被顯著放大。理論計(jì)算表明,若兩個(gè)表達(dá)量相同的基因在擴(kuò)增效率上僅存在2%的差異(99% vs 97%),經(jīng)過30個(gè)擴(kuò)增循環(huán)后,最終產(chǎn)物量將產(chǎn)生1.84倍的差異,可能造成假陽性差異表達(dá)結(jié)果。
2. rRNA干擾消除
核糖體RNA在總RNA中占比通常超過80%。若不對(duì)其進(jìn)行有效去除,測(cè)序數(shù)據(jù)將嚴(yán)重偏向rRNA序列,大幅降低有效信息獲取效率,增加測(cè)序成本。
目前主流的單細(xì)胞轉(zhuǎn)錄組測(cè)序技術(shù)主要基于三種核心擴(kuò)增策略,各具特色與適用場(chǎng)景。
1. SMART擴(kuò)增技術(shù)
SMART技術(shù)通過設(shè)計(jì)特殊引物系統(tǒng)與MMLV逆轉(zhuǎn)錄酶的獨(dú)特特性相結(jié)合,實(shí)現(xiàn)高效的全長(zhǎng)cDNA擴(kuò)增。

核心技術(shù)特征:
特殊Oligo(dT)引物:在PolyT序列3'端設(shè)置特定簡(jiǎn)并堿基,確保引物精確結(jié)合于mRNA poly(A)尾起始處
模板末端轉(zhuǎn)移活性:MMLV逆轉(zhuǎn)錄酶在完成逆轉(zhuǎn)錄后,可在新生cDNA的3'端添加非模板依賴的胞嘧啶殘基
模板轉(zhuǎn)換機(jī)制:含有核糖核酸鳥嘌呤的通用引物與添加的C殘基互補(bǔ),引導(dǎo)酶進(jìn)行第二鏈合成
均一擴(kuò)增優(yōu)勢(shì):兩端引入通用引物序列,實(shí)現(xiàn)后續(xù)PCR的均一擴(kuò)增
技術(shù)局限:
主要捕獲mRNA信息,非編碼RNA(如lncRNA)大量丟失
對(duì)RNA完整性要求較高,降解導(dǎo)致5'端信息缺失
缺乏分子標(biāo)簽系統(tǒng),無法區(qū)分PCR重復(fù)與真實(shí)生物變異
2. 10× Genomics技術(shù)
基于微流控與油滴包被系統(tǒng),實(shí)現(xiàn)高通量單細(xì)胞捕獲與標(biāo)記。
核心技術(shù)特征:
凝膠微珠系統(tǒng):每個(gè)微珠包含獨(dú)特的分子標(biāo)識(shí)符(16bp Barcode)與唯一分子標(biāo)識(shí)(10bp UMI)
高通量捕獲:通過油包水微滴實(shí)現(xiàn)單個(gè)細(xì)胞與單個(gè)微珠的精準(zhǔn)配對(duì)
分子計(jì)數(shù)準(zhǔn)確:UMI系統(tǒng)可區(qū)分PCR擴(kuò)增重復(fù)與原始轉(zhuǎn)錄本,實(shí)現(xiàn)絕對(duì)定量
大規(guī)模并行:?jiǎn)未螌?shí)驗(yàn)可同時(shí)分析數(shù)千至上萬個(gè)細(xì)胞
技術(shù)局限:
主要針對(duì)poly(A)+ RNA,lncRNA捕獲效率有限
RNA降解影響5'端完整性
平臺(tái)依賴性較強(qiáng),設(shè)備投入成本較高
3. AnyDeplete技術(shù)
采用隨機(jī)引物啟動(dòng)與選擇性去除策略,提高技術(shù)適應(yīng)性。
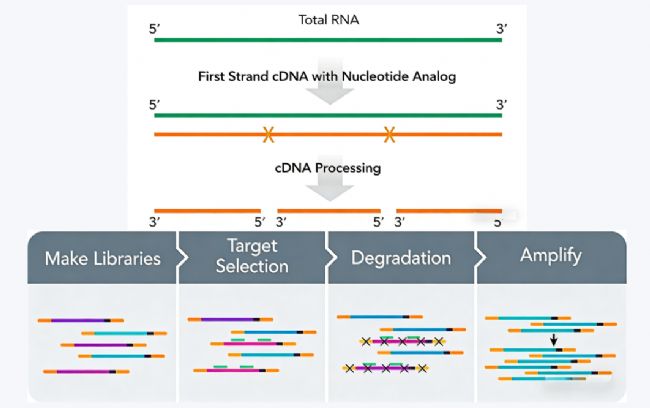
核心技術(shù)特征:
隨機(jī)引物啟動(dòng):不依賴poly(A)尾,可捕獲包括非編碼RNA在內(nèi)的多種RNA類型
鏈特異性建庫:通過核苷酸類似物標(biāo)記實(shí)現(xiàn)鏈來源區(qū)分
選擇性去除:利用特異性探針與酶切系統(tǒng)選擇性消除rRNA衍生的cDNA
降解樣本兼容:對(duì)RNA完整性要求較低,適用于部分降解樣本
技術(shù)局限:
當(dāng)僅需mRNA信息時(shí),部分測(cè)序通量被非編碼RNA占據(jù)
實(shí)驗(yàn)操作相對(duì)復(fù)雜
數(shù)據(jù)分析需考慮鏈特異性信息
| 技術(shù)特性 | SMART技術(shù) | 10× Genomics技術(shù) | AnyDeplete技術(shù) |
|---|---|---|---|
| RNA類型 | 主要mRNA | 主要mRNA | mRNA+lncRNA |
| 樣本要求 | 高質(zhì)量RNA | 高質(zhì)量RNA | 耐受部分降解 |
| 通量水平 | 中低通量 | 超高通量 | 中高通量 |
| 定量準(zhǔn)確性 | 相對(duì)定量 | 絕對(duì)定量(UMI) | 絕對(duì)定量(UMI) |
| 信息完整性 | 5'端易缺失 | 5'端易缺失 | 全長(zhǎng)保留較好 |
| 成本效益 | 成本較低 | 平臺(tái)成本高 | 中等成本 |
1. 多組學(xué)整合
轉(zhuǎn)錄組與表觀組聯(lián)合分析
蛋白表達(dá)與轉(zhuǎn)錄組同步檢測(cè)
空間轉(zhuǎn)錄組技術(shù)的融合發(fā)展
2. 分析算法優(yōu)化
批次效應(yīng)校正方法的完善
細(xì)胞類型注釋的標(biāo)準(zhǔn)化
軌跡推斷算法的精度提升
3. 臨床應(yīng)用拓展
腫瘤異質(zhì)性圖譜構(gòu)建
免疫細(xì)胞狀態(tài)分析
發(fā)育生物學(xué)研究
4. 技術(shù)瓶頸突破
超低起始量RNA的穩(wěn)定擴(kuò)增
全長(zhǎng)轉(zhuǎn)錄本的高效捕獲
成本效益的持續(xù)優(yōu)化
單細(xì)胞轉(zhuǎn)錄組測(cè)序技術(shù)的快速發(fā)展,為生命科學(xué)研究提供了前所未有的分辨率。三種主流技術(shù)各具優(yōu)勢(shì):SMART技術(shù)適合對(duì)RNA質(zhì)量要求高、通量需求適中的研究;10× Genomics技術(shù)滿足大規(guī)模細(xì)胞群體分析需求;AnyDeplete技術(shù)則為降解樣本和非編碼RNA研究提供解決方案。
未來技術(shù)發(fā)展將更加注重:技術(shù)整合:結(jié)合不同技術(shù)優(yōu)勢(shì),開發(fā)混合策略。標(biāo)準(zhǔn)化建設(shè):建立統(tǒng)一的數(shù)據(jù)質(zhì)量評(píng)估標(biāo)準(zhǔn)。臨床應(yīng)用:推動(dòng)技術(shù)向臨床診斷和治療監(jiān)測(cè)轉(zhuǎn)化。計(jì)算創(chuàng)新:開發(fā)更強(qiáng)大的數(shù)據(jù)分析工具和算法
隨著技術(shù)進(jìn)步和成本降低,單細(xì)胞轉(zhuǎn)錄組測(cè)序有望成為常規(guī)研究工具,在精準(zhǔn)醫(yī)學(xué)、藥物開發(fā)和基礎(chǔ)研究中發(fā)揮更大作用。研究者在選擇技術(shù)時(shí)應(yīng)綜合考慮樣本特性、研究目標(biāo)、通量需求和成本預(yù)算,以實(shí)現(xiàn)最優(yōu)的實(shí)驗(yàn)設(shè)計(jì)與數(shù)據(jù)分析。
六、單細(xì)胞轉(zhuǎn)錄組測(cè)序技術(shù)哪里有?
LabEx提供單細(xì)胞轉(zhuǎn)錄組測(cè)序(scRNA-seq),scRNA-seq利用磁珠+寡核苷酸的偶聯(lián)結(jié)構(gòu),寡核苷酸的結(jié)構(gòu)分為4個(gè)組成部分:PCR引物結(jié)合位點(diǎn)、細(xì)胞條形碼、分子標(biāo)簽和poly-dT序列。通過A-T互補(bǔ)配對(duì)的方式,捕獲并標(biāo)記單個(gè)細(xì)胞釋放出的帶有polyA尾巴的mRNA分子,最終利用高通量測(cè)序反映每個(gè)細(xì)胞的各個(gè)基因的mRNA含量。
樂備實(shí)是國(guó)內(nèi)專注于提供高質(zhì)量蛋白檢測(cè)以及組學(xué)分析服務(wù)的實(shí)驗(yàn)服務(wù)專家,自2018年成立以來,樂備實(shí)不斷尋求突破,公司的服務(wù)技術(shù)平臺(tái)已擴(kuò)展到單細(xì)胞測(cè)序、空間多組學(xué)、流式檢測(cè)、超敏電化學(xué)發(fā)光、Luminex多因子檢測(cè)、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學(xué)等30多個(gè),建立起了一套涵蓋基因、蛋白、細(xì)胞以及組織水平實(shí)驗(yàn)的完整檢測(cè)體系。
- 單細(xì)胞轉(zhuǎn)錄組測(cè)序技術(shù)的原理、方法與應(yīng)用分析
- CRISPR基因編輯技術(shù)在重塑現(xiàn)代生物醫(yī)學(xué)研究范式中的作用及應(yīng)用
- 解碼精神分裂癥:SNP如何撬動(dòng)患病風(fēng)險(xiǎn)?
- 單細(xì)胞擬時(shí)序分析技術(shù)的核心特征、原理、分析步驟及應(yīng)用場(chǎng)景
- 現(xiàn)貨型新生抗原疫苗聯(lián)合ICI在晚期纖維板層型肝癌中展現(xiàn)治療潛力
- 解鎖細(xì)胞年齡的密碼:端粒檢測(cè)如何成為健康管理新視角?
- 多組學(xué)分析揭示DNA低甲基化定義人組織調(diào)節(jié)性T細(xì)胞的表觀遺傳適應(yīng)性
- Polysome Profiling—解析翻譯調(diào)控機(jī)制的金標(biāo)準(zhǔn)
- 伯豪&真邁簽署戰(zhàn)略合作協(xié)議,共建多組學(xué)應(yīng)用新平臺(tái)
- 伯豪生物攜時(shí)空組學(xué)技術(shù)平臺(tái)亮相全國(guó)系統(tǒng)生物學(xué)大會(huì)
- 開學(xué)季促銷,LabEx DSP空間組學(xué)測(cè)序免費(fèi)送12個(gè)ROI
- 新址新程,豪創(chuàng)未來-伯豪生物喬遷慶典圓滿舉行
- 樂備實(shí)LabEx助力發(fā)文獎(jiǎng)勵(lì)進(jìn)行中,最高獲2000元現(xiàn)金
- 中國(guó)首批AVITI24原位多組學(xué)平臺(tái)實(shí)測(cè)數(shù)據(jù)發(fā)布
- 伯豪生物2025系列培訓(xùn)班(上海站)報(bào)名開啟
- 2025伯豪生物春季全國(guó)巡講開啟,早鳥報(bào)名搶占先機(jī)






