Portal環(huán)狀RNA遞送技術無需基因組整合即可實現(xiàn)5天以上持久表達
在細胞治療與基因功能研究中,研究人員常面臨兩難選擇:mRNA表達快速但轉(zhuǎn)瞬即逝,病毒載體雖能持久表達卻存在基因組整合帶來的安全風險。
如今,Portal公司帶來了第三種選擇——多重環(huán)狀RNA遞送技術,真正實現(xiàn)“魚與熊掌兼得”:既能獲得持久、高效的蛋白表達,又無需持久性改變細胞基因組。
誰將是Portal技術的受益者?
細胞治療團隊:如果您正在尋找持久性基因修飾(如病毒轉(zhuǎn)導)的替代方案,以開發(fā)更安全的下一代細胞療法。
研發(fā)與工藝開發(fā)人員:如果您需要在原代細胞中長時間過表達目標基因,用于功能研究或工藝優(yōu)化,同時希望跳過繁瑣、耗時的穩(wěn)轉(zhuǎn)細胞系構建過程。
四大核心優(yōu)勢
表達持久穩(wěn)定:mRNA的半衰期很短,蛋白表達通常僅維持1–2天。而Portal遞送的環(huán)狀RNA憑借其獨特的共價閉合環(huán)狀結構,能夠抵抗核酸外切酶的降解,在細胞內(nèi)穩(wěn)定表達超過5天,為長期功能研究提供保障。
無基因組整合風險:環(huán)狀RNA在細胞質(zhì)內(nèi)獨立翻譯,不進入細胞核,不會整合至宿主基因組。在獲得持久生物學效應的同時,避免了因基因插入突變引發(fā)的潛在安全風險。
無需堿基修飾:與傳統(tǒng)mRNA不同,通過Portal機械穿孔技術遞送的環(huán)狀RNA,無需進行堿基修飾(如假尿嘧啶) 即可實現(xiàn)高效、穩(wěn)定的蛋白表達,不僅簡化生產(chǎn)工藝,也進一步降低了成本。
靈活的多重共遞送:Portal專利的機械穿孔技術可輕松將多種環(huán)狀RNA分子(如治療性CAR基因與增強因子)按特定比例共同導入同一細胞,實現(xiàn)協(xié)同增效的“多重工程化”,為復雜細胞療法設計開辟新路徑。
數(shù)據(jù)印證實力:環(huán)狀RNA在表達與功能上均表現(xiàn)卓越
驗證一:環(huán)狀RNA在免疫細胞中表達持久性顯著優(yōu)于mRNA
為評估環(huán)狀RNA與mRNA的表達穩(wěn)定性,本研究在體外培養(yǎng)的PBMC及純化T細胞中,分別轉(zhuǎn)染編碼GFP報告基因的環(huán)狀RNA與線性mRNA。mRNA組在轉(zhuǎn)染后48小時內(nèi)表達水平急劇下降,而環(huán)狀RNA組在相同時間內(nèi)維持穩(wěn)定表達,直至第5天仍檢測到顯著熒光信號(圖1)。
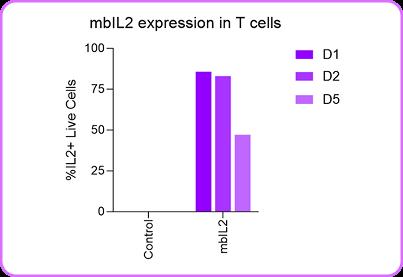
進一步采用突變型IL-2環(huán)狀RNA增強T細胞功能,證實環(huán)狀RNA可支持mbIL-2的持續(xù)分泌(圖2),并顯著提升CAR-T細胞對CD19陽性靶細胞殺傷活性(圖3),其效應強度與表達持續(xù)時間呈正相關。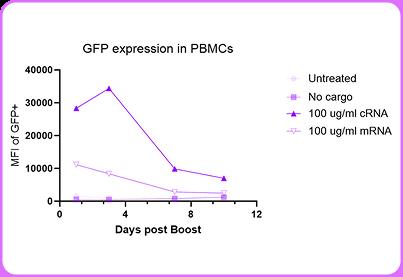 圖1. 與mRNA相比,環(huán)狀RNA在人類原代PBMC中的表達強度更高,且能持續(xù)長達10天之久。
圖1. 與mRNA相比,環(huán)狀RNA在人類原代PBMC中的表達強度更高,且能持續(xù)長達10天之久。
驗證二:多重工程化實現(xiàn)協(xié)同高效殺傷
在更復雜的工程化T細胞中,我們構建了共表達CD19嵌合抗原受體與雙功能增強因子(mbIL-2/IL-12)的環(huán)狀RNA遞送系統(tǒng)。通過優(yōu)化共遞送方式,當CD19 CAR與mbIL-12環(huán)狀RNA同時轉(zhuǎn)導時,實現(xiàn)了CAR與細胞因子的高效協(xié)同表達(圖3)。
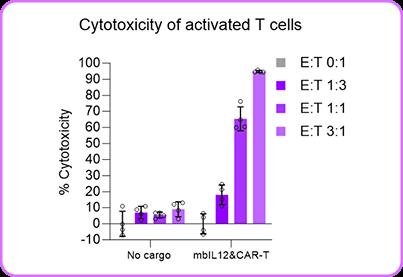
功能驗證顯示,經(jīng)該聯(lián)合增強方式處理的T細胞在效靶比3:1條件下,對CD19陽性腫瘤細胞殺傷效率顯著提升,細胞毒性檢測顯示殺傷率超過90%(圖4),較單一CAR表達組表現(xiàn)出統(tǒng)計學差異(p<0.01)。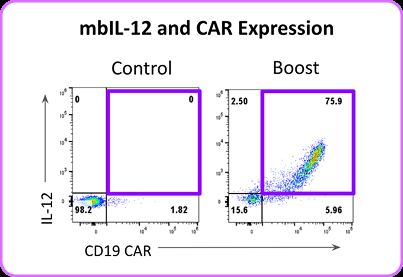 圖3. 在T細胞導入(boost)48小時后,通過流式細胞術檢測CD19 CAR與mblL-12的表達情況。
圖3. 在T細胞導入(boost)48小時后,通過流式細胞術檢測CD19 CAR與mblL-12的表達情況。
核心技術支撐:高效低損傷的機械擠壓穿孔技術
本研究所采用的遞送技術核心在于專利的機械擠壓遞送系統(tǒng)(Portal技術)。與電穿孔技術通過高壓電場誘導細胞膜不可控破裂不同,Portal技術基于可控的物理力學機制,在細胞膜上瞬時形成直徑約50-200 nm的納米級孔道,實現(xiàn)環(huán)狀RNA等大分子物質(zhì)(分子量>100 kDa)的高效胞內(nèi)遞送。該過程具備以下技術優(yōu)勢:
細胞相容性:機械擠壓作用力可精確控制,顯著降低細胞膜損傷(細胞存活率>95%),避免電穿孔導致的細胞應激反應等。
遞送效率:通過優(yōu)化擠壓參數(shù)(壓力梯度、作用時間等),可使環(huán)狀RNA在T細胞中的轉(zhuǎn)染效率達85%以上,較傳統(tǒng)電穿孔提升2-3倍。
功能保持:經(jīng)Portal技術處理細胞保持完整細胞周期分布,為后續(xù)功能驗證提供可靠細胞模型。

未來展望
Portal環(huán)狀RNA遞送平臺為解決細胞治療與基礎研究中“表達時長”與“安全性”之間的矛盾,提供了一個強大而靈活的工具。無論是開發(fā)更安全的現(xiàn)貨型細胞療法,還是開展復雜的基因功能篩選,這項技術都將助力您加速創(chuàng)新。
立即聯(lián)系我們,了解如何將Portal環(huán)狀RNA遞送技術應用于您的研究項目!
如今,Portal公司帶來了第三種選擇——多重環(huán)狀RNA遞送技術,真正實現(xiàn)“魚與熊掌兼得”:既能獲得持久、高效的蛋白表達,又無需持久性改變細胞基因組。
誰將是Portal技術的受益者?
細胞治療團隊:如果您正在尋找持久性基因修飾(如病毒轉(zhuǎn)導)的替代方案,以開發(fā)更安全的下一代細胞療法。
研發(fā)與工藝開發(fā)人員:如果您需要在原代細胞中長時間過表達目標基因,用于功能研究或工藝優(yōu)化,同時希望跳過繁瑣、耗時的穩(wěn)轉(zhuǎn)細胞系構建過程。
四大核心優(yōu)勢
表達持久穩(wěn)定:mRNA的半衰期很短,蛋白表達通常僅維持1–2天。而Portal遞送的環(huán)狀RNA憑借其獨特的共價閉合環(huán)狀結構,能夠抵抗核酸外切酶的降解,在細胞內(nèi)穩(wěn)定表達超過5天,為長期功能研究提供保障。
無基因組整合風險:環(huán)狀RNA在細胞質(zhì)內(nèi)獨立翻譯,不進入細胞核,不會整合至宿主基因組。在獲得持久生物學效應的同時,避免了因基因插入突變引發(fā)的潛在安全風險。
無需堿基修飾:與傳統(tǒng)mRNA不同,通過Portal機械穿孔技術遞送的環(huán)狀RNA,無需進行堿基修飾(如假尿嘧啶) 即可實現(xiàn)高效、穩(wěn)定的蛋白表達,不僅簡化生產(chǎn)工藝,也進一步降低了成本。
靈活的多重共遞送:Portal專利的機械穿孔技術可輕松將多種環(huán)狀RNA分子(如治療性CAR基因與增強因子)按特定比例共同導入同一細胞,實現(xiàn)協(xié)同增效的“多重工程化”,為復雜細胞療法設計開辟新路徑。
數(shù)據(jù)印證實力:環(huán)狀RNA在表達與功能上均表現(xiàn)卓越
驗證一:環(huán)狀RNA在免疫細胞中表達持久性顯著優(yōu)于mRNA
為評估環(huán)狀RNA與mRNA的表達穩(wěn)定性,本研究在體外培養(yǎng)的PBMC及純化T細胞中,分別轉(zhuǎn)染編碼GFP報告基因的環(huán)狀RNA與線性mRNA。mRNA組在轉(zhuǎn)染后48小時內(nèi)表達水平急劇下降,而環(huán)狀RNA組在相同時間內(nèi)維持穩(wěn)定表達,直至第5天仍檢測到顯著熒光信號(圖1)。
進一步采用突變型IL-2環(huán)狀RNA增強T細胞功能,證實環(huán)狀RNA可支持mbIL-2的持續(xù)分泌(圖2),并顯著提升CAR-T細胞對CD19陽性靶細胞殺傷活性(圖3),其效應強度與表達持續(xù)時間呈正相關。


圖2. mblL2環(huán)狀RNA在T細胞中的表達可持續(xù)5天以上。
驗證二:多重工程化實現(xiàn)協(xié)同高效殺傷
在更復雜的工程化T細胞中,我們構建了共表達CD19嵌合抗原受體與雙功能增強因子(mbIL-2/IL-12)的環(huán)狀RNA遞送系統(tǒng)。通過優(yōu)化共遞送方式,當CD19 CAR與mbIL-12環(huán)狀RNA同時轉(zhuǎn)導時,實現(xiàn)了CAR與細胞因子的高效協(xié)同表達(圖3)。
功能驗證顯示,經(jīng)該聯(lián)合增強方式處理的T細胞在效靶比3:1條件下,對CD19陽性腫瘤細胞殺傷效率顯著提升,細胞毒性檢測顯示殺傷率超過90%(圖4),較單一CAR表達組表現(xiàn)出統(tǒng)計學差異(p<0.01)。


圖4. 經(jīng)mblL-12與CD19 CAR環(huán)狀RNA共增強的T細胞,
其雙重表達呈現(xiàn)高度相關性,并展現(xiàn)出相應的協(xié)同殺傷效力。
其雙重表達呈現(xiàn)高度相關性,并展現(xiàn)出相應的協(xié)同殺傷效力。
核心技術支撐:高效低損傷的機械擠壓穿孔技術
本研究所采用的遞送技術核心在于專利的機械擠壓遞送系統(tǒng)(Portal技術)。與電穿孔技術通過高壓電場誘導細胞膜不可控破裂不同,Portal技術基于可控的物理力學機制,在細胞膜上瞬時形成直徑約50-200 nm的納米級孔道,實現(xiàn)環(huán)狀RNA等大分子物質(zhì)(分子量>100 kDa)的高效胞內(nèi)遞送。該過程具備以下技術優(yōu)勢:
細胞相容性:機械擠壓作用力可精確控制,顯著降低細胞膜損傷(細胞存活率>95%),避免電穿孔導致的細胞應激反應等。
遞送效率:通過優(yōu)化擠壓參數(shù)(壓力梯度、作用時間等),可使環(huán)狀RNA在T細胞中的轉(zhuǎn)染效率達85%以上,較傳統(tǒng)電穿孔提升2-3倍。
功能保持:經(jīng)Portal技術處理細胞保持完整細胞周期分布,為后續(xù)功能驗證提供可靠細胞模型。


圖5. Portal機械擠壓穿孔技術工作原理
未來展望
Portal環(huán)狀RNA遞送平臺為解決細胞治療與基礎研究中“表達時長”與“安全性”之間的矛盾,提供了一個強大而靈活的工具。無論是開發(fā)更安全的現(xiàn)貨型細胞療法,還是開展復雜的基因功能篩選,這項技術都將助力您加速創(chuàng)新。
立即聯(lián)系我們,了解如何將Portal環(huán)狀RNA遞送技術應用于您的研究項目!
- Portal環(huán)狀RNA遞送技術無需基因組整合即可實現(xiàn)5天以上持久表達
- MaxCyte電轉(zhuǎn)系統(tǒng)助力“自武裝”CAR-T療法突破實體瘤免疫抑制屏障
- MaxCyte流式電轉(zhuǎn)儀在急性髓系白血病(AML)通用型CAR-T療法中的優(yōu)勢
- x細胞遞送平臺Gateway™系統(tǒng)的組成、原理及應用案例分享
- 文章分享:HIP助力CAR-T完全逃避免疫排斥及實現(xiàn)異體胰島細胞移植
- Portal機械擠壓穿孔技術在造血干細胞工程化中的應用優(yōu)勢
- 3.0時代毛細管型電轉(zhuǎn)儀:助力更高效率的細胞轉(zhuǎn)染實驗
- 電轉(zhuǎn)染波形的原理、性能與應用差異剖析:方波 vs 指數(shù)衰減波的選擇
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






