外泌體藥物遞送結合細胞電轉染系統重塑藥物遞送未來
外泌體是細胞分泌的納米級囊泡(直徑40-160 nm),有脂質雙層膜,可以包裹蛋白質、核酸等生物分子。因其低免疫原性、高生物相容性、穿透生理屏障的能力(如血腦屏障)及靶向特性,外泌體被視為新一代極具潛力的藥物遞送載體。目前,外泌體藥物遞送在多種疾病的治療中有著廣泛的應用前景。
外泌體藥物遞送應用
以結直腸癌為例。研究人員通過將lncRNA PTENP1轉染到293A細胞后,細胞分泌含PTENP1的外泌體。這些外泌體通過PTENP1與miRNA-17競爭結合,上調PTEN蛋白表達,從而抑制膀胱癌細胞的惡性行為。同樣方法制備的含circLPAR1的外泌體,則通過與eIF3h直接結合,阻斷METTL3與eIF3h的相互作用,降低BRD4表達,進而抑制結直腸癌細胞生長[1]。
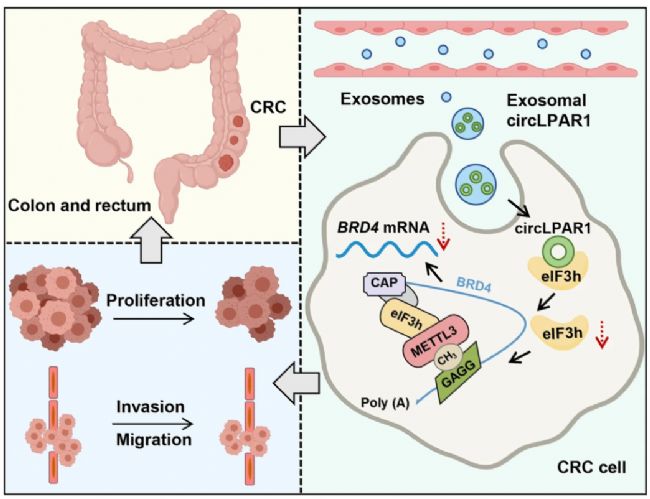
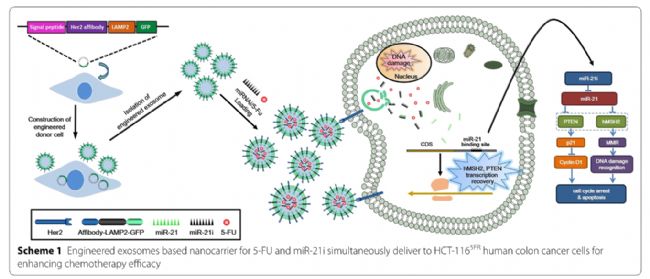
而腫瘤細胞也會分泌外泌體,腫瘤細胞分泌的外泌體不僅能規避免疫識別,還具有靶向同源腫瘤的“歸巢效應”,因此被廣泛用于藥物遞送。例如,有研究將miR-375模擬物載入腫瘤來源的外泌體,有效抑制了結腸癌細胞的遷移和侵襲;另有研究將miR-21抑制劑(miR-21i)與化療藥5-氟尿嘧啶(5-FU)共同封裝,并通過EGFR介導的內吞作用,精準遞送至耐藥的HCT-116結直腸癌細胞,顯著增強了抗腫瘤效果[2]。
外泌體藥物裝載
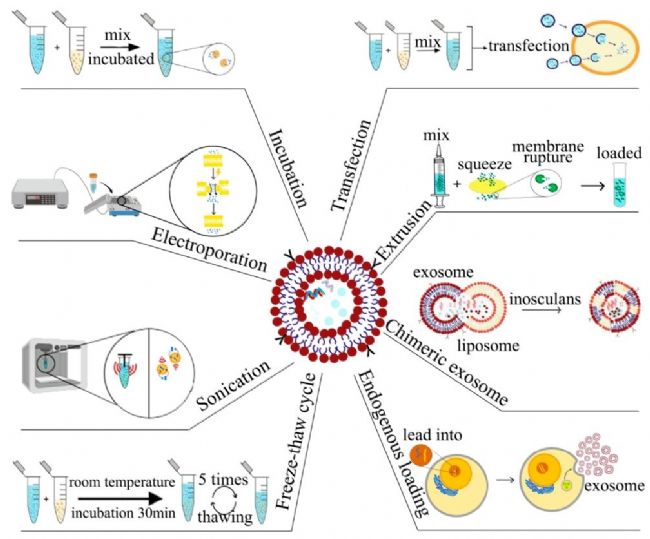
在利用外泌體作為藥物載體時,載藥方式主要分為內源性及外源性兩種。
內源性載藥是通過基因工程技術或共孵育,讓供體細胞表達目標分子(如核酸、蛋白質),這些分子隨后被包裝進外泌體并分泌出來。再分離和純化獲取已載藥的外泌體。此方法能夠保持外泌體的完整性和功能,但過程較為復雜,耗時較長且成本較高。
外源性載藥是將外泌體純化后,通過電穿孔、共孵育、超聲、化學轉染或反復凍融等方法將藥物裝載入外泌體中。這種方法的優點是操作相對簡單直接,但可能會影響外泌體的完整性,并需要額外步驟去除未成功裝載的藥物。
電穿孔裝載法
在上述所有遞送策略中,電穿孔法因獨特機制與性能,在藥物裝載尤其是小分子藥物和核酸藥物裝載中具有顯著優勢。
1、裝載效率高且可控
電穿孔法通過高壓脈沖在外泌體膜上形成瞬時孔道,使藥物分子(尤其是極性小分子、核酸)更易擴散進入,裝載效率顯著更高。例如,裝載 DOX 時,電穿孔法效率遠高于孵育法;且可通過優化關鍵參數(如外泌體量、藥物 - 囊泡比例、脈沖電壓與場強)進一步提升[3]。
2、保留藥物與外泌體活性
電穿孔不會破壞外泌體的球形結構、脂質組成與功能,同時藥物原有藥理特性不易被破壞。例如,通過電穿孔將 HAL 裝載到 M2 巨噬細胞來源的外泌體中,所得載藥外泌體仍保持良好的抗炎活性,可緩解動脈粥樣硬化[4]。
3、適用藥物類型廣
電穿孔法不僅適用于小分子藥物(如 DOX、姜黃素),還可高效裝載核酸藥物(siRNA、miRNA及抑制劑)與蛋白質藥物(胰島素、Cas9 RNP),無需對藥物進行復雜修飾。例如,可同時裝載 miR-21 抑制劑與 5 - 氟尿嘧啶,實現協同治療,且在 10ms、1000V 條件下達到最高裝載效率[2]。
4、操作簡便且易標準化
電穿孔法實驗步驟相對簡單(混合藥物與外泌體、設置參數、后續孵育修復),且關鍵參數(電壓、脈沖時間、脈沖次數)可量化控制,便于不同實驗室重復與標準化,為后續規模化應用奠定基礎。
在眾多載藥方法中,電轉染技術正以其獨特的高效率優勢,成為推動外泌體治療應用的核心技術之一。
Extransfection™細胞電轉染系統
奎克泰生物推出的ExTransfection™第三代毛細管型電轉儀,憑借獨特的Gold-Tip設計,毛細管絕緣,保證電極表面積小的同時,使電極間距大,因此電場相較于傳統比色皿更加穩定。該設計可以最大限度地減少氣泡的形成和電解。因此,在外泌體直接電轉的外源性裝載或電轉藥物至細胞中的內源性裝載上,均能顯著提高效率且降低外泌體或外泌體細胞的損傷。

ExTransfection在外泌體藥物載藥應用中的特點:
①適應性廣
對于內源性載藥,ExTransfection廣泛適用于哺乳動物細胞類型,涵蓋工程化細胞系、難轉染細胞(干細胞、神經元、免疫細胞等)。無論是內源性載藥還是外源性載藥,該系統均能遞送DNA、RNA及CRISPR/Cas9復合物等。因此,工程化外泌體來源細胞(如HEK293、MSCs、iPSC等)還是特異性腫瘤細胞均能適用。
②效率性高
通過密集、均勻的電能將核酸和蛋白質等遞送到細胞中,不會出現意外損失并最大程度降低細胞及外泌體的損傷,顯著提升效率與存活率。
③優化性高
對于內源性載藥,內置300+細胞類型轉染參數,并搭配24/18孔板優化方案,還可進行精密調參,對于最佳轉染參數摸索友好,能快速摸索出藥物遞送外泌體來源細胞極為便捷。
④重復性高
標準化操作流程,及簡便的操作步驟,可在相同條件下提供可重復的結果。
⑤簡便性強
操作流程簡便,三步法操作(混樣——電轉——培養)極大省去人為操作,且無縫兼容10μL和100μL體系,小體系摸索條件,大體系放大轉染。
隨著對外泌體研究的不斷深入,外泌體展現了其在精準醫療領域的無限潛力。而奎克泰生物推出的ExTransfection™第三代毛細管型電轉儀為外泌體藥物遞送的實際應用提供了強有力的支持。未來,隨著技術的進步和對生物學機制理解的加深,外泌體有望成為治療多種難治性疾病的關鍵力量,開啟個性化醫療的新篇章。
參考文獻
[1]Zheng R, Zhang K, Tan S, Gao F, Zhang Y, Xu W, Wang H, Gu D, Zhu L, Li S, Chu H, Zhang Z, Liu L, Du M, Wang M. Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3-eIF3h interaction. Mol Cancer. 2022 Feb 14;21(1):49. doi: 10.1186/s12943-021-01471-y. PMID: 35164758; PMCID: PMC8842935.
[2]Liang G, Zhu Y, Ali DJ, Tian T, Xu H, Si K, Sun B, Chen B, Xiao Z. Engineered exosomes for targeted co-delivery of miR-21 inhibitor and chemotherapeutics to reverse drug resistance in colon cancer. J Nanobiotechnology. 2020 Jan 9;18(1):10. doi: 10.1186/s12951-019-0563-2. PMID: 31918721; PMCID: PMC6950820.
[3]Lennaárd AJ, Mamand DR, Wiklander RJ, El Andaloussi S, Wiklander OPB. Optimised Electroporation for Loading of Extracellular Vesicles with Doxorubicin. Pharmaceutics. 2021 Dec 24;14(1):38. doi: 10.3390/pharmaceutics14010038. PMID: 35056933; PMCID: PMC8780628.
[4]Wu G, Zhang J, Zhao Q, Zhuang W, Ding J, Zhang C, Gao H, Pang DW, Pu K, Xie HY. Molecularly Engineered Macrophage-Derived Exosomes with Inflammation Tropism and Intrinsic Heme Biosynthesis for Atherosclerosis Treatment. Angew Chem Int Ed Engl. 2020 Mar 2;59(10):4068-4074. doi: 10.1002/anie.201913700. Epub 2020 Jan 23. PMID: 31854064.






