RNA甲基化綜述:RNA修飾的生理和病理功能及其潛在臨床應用
2023年09月15日,來自德國癌癥研究中心(Deutsches Krebsforschungszentrum,DKFZ) 的Michaela Frye團隊在《Nature Reviews Genetics》(IF52/Q1)期刊發表題為“RNA modifications in physiology anddisease: towards clinical applications”的重磅綜述,系統闡述了RNA修飾在生理功能、疾病機制及臨床應用中的最新進展。首先,文章綜合介紹了mRNA、tRNA以及rRNA的已知RNA修飾類型,這些修飾涵蓋對RNA轉錄、加工、定位、穩定性以及翻譯等功能進行不同作用。接著,文章介紹了上述RNA修飾在正常生理(如細胞應激響應、發育過程等)中具體如何發揮作用,此外,介紹了異常RNA修飾在神經系統疾病、代謝疾病及腫瘤等病理狀態下通過影響RNA定位、線粒體功能以及細胞可塑性等方式發揮功能。最后對mRNA以及ASOs(antisense oligonucleotides)/siRNA等非編碼RNA作為藥物的修飾策略與應用前景進行了介紹。
本文系統總結了150余種RNA修飾通過動態調控mRNA、tRNA與rRNA功能,構建出連接轉錄與翻譯的“表觀轉錄組”系統,此系統通過修飾酶響應環境信號,快速重編程蛋白質合成以實現細胞狀態轉換,失調則導致神經、代謝疾病及癌癥的不良結局。本研究不僅闡明“代謝-修飾-翻譯”軸的調控框架,更推動修飾應用于mRNA疫苗、反義寡核苷酸等臨床療法,且為理解生命過程的動態調控提供全新角度,標志著從中心法則靜態模型向“可塑性轉錄后調控”理論的轉變,有助于促進精準RNA醫學與疾病生物標志物的突破。
 (doi: 10.1038/s41576-023-00645-2)
(doi: 10.1038/s41576-023-00645-2)
自20世紀60年代首次發現5-甲基胞苷(m5C)、N6-甲基腺苷(m6A)和假尿苷(Ψ)等天然RNA修飾,迄今已鑒定超過150種不同的RNA修飾,共同組成了復雜的"表觀轉錄組"。目前幾乎所有類型的RNA分子在生命周期中都會攜帶某種或某些化學修飾,這些修飾通過改變核苷酸的靜電荷、疏水表面和堿基配對能力,調控著RNA的穩定性、空間結構及其與蛋白質分子互作的能力。此外,在蛋白質合成過程中發揮核心作用的三類主要RNA:信使RNA(mRNA)、轉運RNA(tRNA)和核糖體RNA(rRNA),這些修飾可在轉錄期間或轉錄后參與調控基因轉錄、RNA加工、出核、細胞定位及mRNA翻譯等多個環節,在基因轉錄與蛋白出核之間構建起關鍵的分子橋梁,進而對細胞功能產生深遠影響(圖1)。
高通量檢測技術的發展推動了全轉錄組范圍內修飾圖譜的繪制,揭示了修飾動態響應外界刺激(如氧化應激、DNA損傷)的調控機制。異常修飾譜可導致神經發育缺陷、代謝疾病及癌癥,而修飾的化學特性(如增強mRNA穩定性和翻譯效率)已被應用于mRNA疫苗等臨床療法。
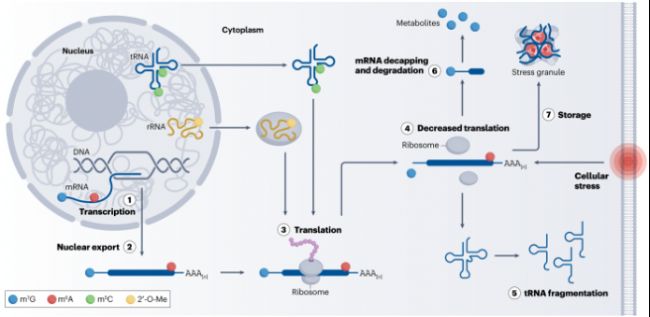
RNA修飾類型
RNA修飾廣泛發生于腺苷(adenosine, A)、鳥苷(guanosine, G)、胞苷(cytidine, C)和尿苷(uridine, U)四種核苷中。嘌呤或嘧啶堿基最常見的修飾類型,包括甲基化、假尿苷化和腺苷-肌苷編輯(adenosine-to-inosine editing)。核糖部分的修飾化學多樣性有限,但2'-O-甲基化(2′-O-methylation, 2′-O-Me)在rRNA、tRNA和snRNA(small nuclear RNA)中頻繁出現。這些核苷酸修飾通過影響RNA加工、穩定性和結構,在轉錄、轉錄后和翻譯水平調控基因表達(表1)。
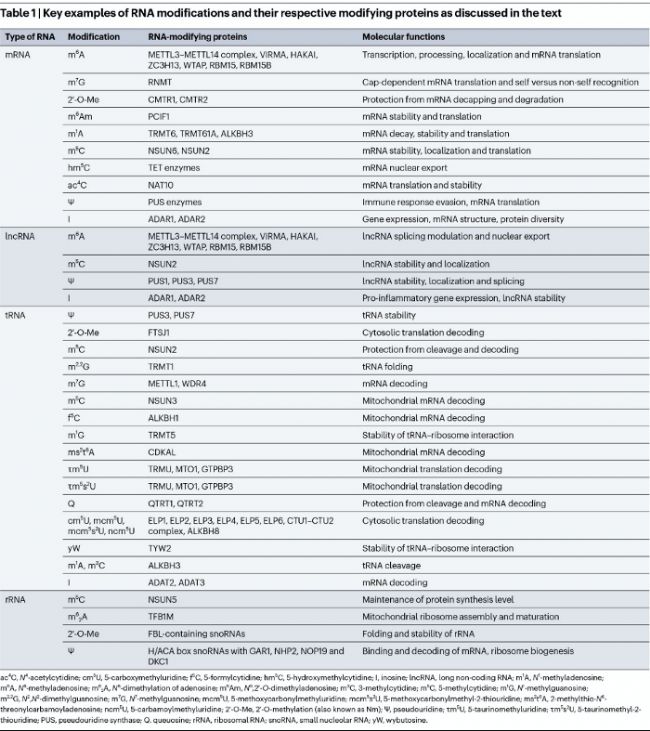
表1:文中所述RNA修飾及其相應修飾蛋白的關鍵示例
編碼RNA修飾
至少十種核苷酸修飾在真核mRNA中被報道(表1),確保其正確的轉錄、加工、亞細胞定位和翻譯。mRNA中最豐富的修飾是內部位點(如m6A)和5′帽子結構(如m⁷G、m6Am),這些修飾由METTL3-METTL14甲基轉移酶復合體、去甲基酶FTO/ALKBH5等至少20種調控蛋白動態調控。m6A對基因表達受特定reader蛋白結合調控,包括YTH結構域家族和HNRNP蛋白。YTHDF蛋白通常介導mRNA降解,也可促進特定轉錄本翻譯;核內reader蛋白YTHDC1則調控mRNA剪接、定位,并以m6A依賴方式調節染色質可及性和逆轉錄轉座子沉默。5′帽子結構的重要性體現在保護新生mRNA免受降解、促進翻譯起始、并將mRNA標記為"自身"以引導免疫系統區分內外源核酸等多個層面。然而,m6Am對帽子依賴翻譯的影響具有雙重性,既可增強也可減弱翻譯效率。應激狀態下,經典帽子依賴翻譯被破壞,必需mRNA翻譯可通過內部核糖體進入位點(internal ribosome entry sites, IRES)或帽子獨立翻譯增強子維持,或由METTL3結合的3′UTRs區域介導的mRNA環化來促進。非經典帽子結構(如NAD⁺、FAD衍生物)通過代謝物衍生而來,主要來源于NAD、FAD、CoA等代謝物和RNA相關輔因子,影響RNA穩定性、線粒體功能及翻譯。
此外,mRNA中還存在Ψ、肌苷(inosine, I)、N1-甲基腺苷(N1-methyladenosine, m1A)、5-甲基胞苷(5-methylcytidine, m5C)、5-羥甲基胞苷(5-hydroxymethylcytidine, hm5C)和N4-乙酰胞苷(N4-acetylcytidine, ac4C)等修飾。mRNA 3′聚腺苷酸尾(poly(A) tail)與5′帽結構的直接互作可協同增強翻譯,該過程通過PABPC1蛋白與eIF4F復合物的蛋白-蛋白互作實現mRNA環化,促進核糖體環路。METTL3可通過結合eIF3h或PABPC1促進mRNA成環,增強癌基因特異性翻譯。盡管5′帽和m6A修飾的調控蛋白是否直接協作尚不明確,但不同調控蛋白集合在共轉錄和轉錄后階段塑造mRNA修飾譜,在翻譯前或翻譯過程中穩定或不穩定mRNA,均參與轉錄后調控(圖2)。
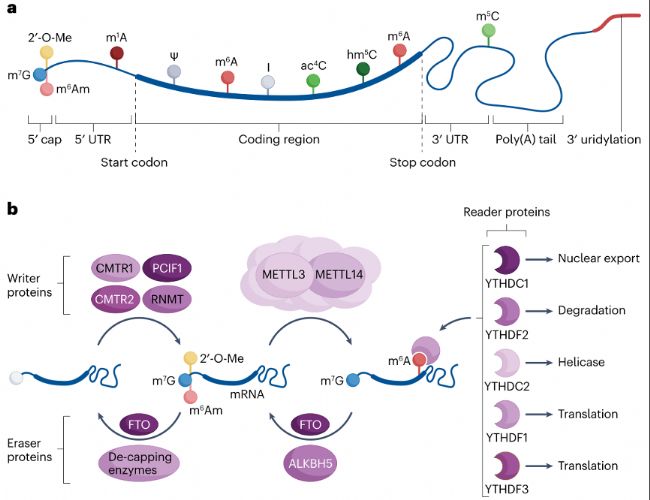
非編碼RNA修飾
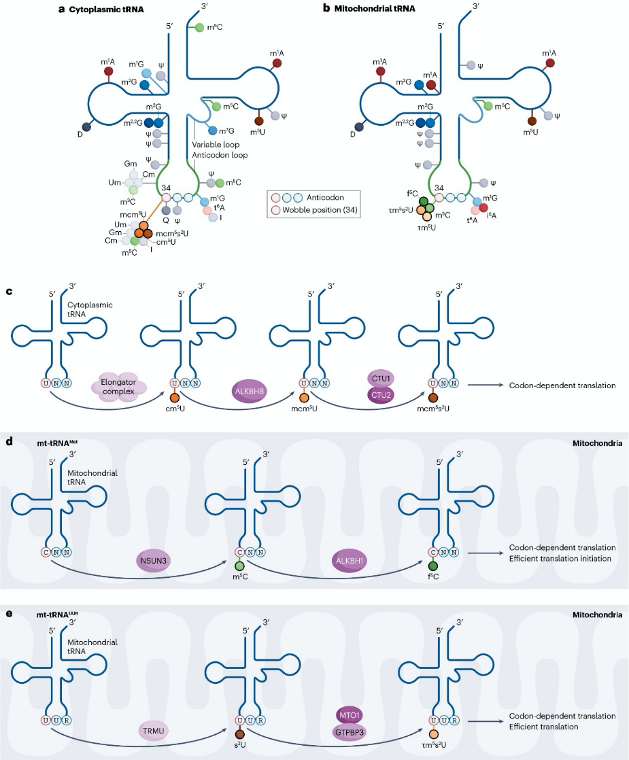
長鏈非編碼RNA(long non-coding RNAs, lncRNAs)通常由RNA聚合酶II轉錄,攜帶m7G帽子、剪接和poly(A)尾,因此很可能安裝有與mRNA相似的修飾。目前已發現MALAT1、vault RNAs、HOTAIR、TERRA、7SK和XIST等lncRNA含有m6A、m5C和Ψ修飾。rRNA在轉錄和成熟過程中也廣泛修飾。但修飾最豐富的RNA類型是tRNA,人類細胞核編碼tRNA平均攜帶13種修飾(占殘基17%),線粒體tRNA平均含5種修飾(占8.7%)。單種修飾的精確功能嚴格取決于其在tRNA分子中的位置,影響轉錄、加工、剪接、穩定性和亞細胞定位。反密碼子區修飾(如 wobble position的U34),結構多樣性最高,可通過調控密碼子識別精度和翻譯效率,適應基因的密碼子使用偏好。反密碼子環外的多數修飾穩定tRNA-mRNA密碼子互作,從而增強解碼準確性和效率。特定tRNA修飾可被單酶或多酶級聯進一步修飾,形成5-甲酰胞苷(5-formylcytidine, f5C)、5-甲氧羰基甲基-2-硫尿苷(5-methoxycarbonylmethyl-2-thiouridine, mcm5s2U)、5-牛磺酸甲基尿苷(5-taurinomethyluridine, τm5U)和5-牛磺酸甲基-2-硫尿苷(τm5s2U)等復雜修飾。位于反密碼子或可變環的修飾如queuosine (Q)或m5C可保護tRNA免受內切核酸酶切割。tRNA片段化是真核生物應對氧化應激的保守反應,某些tRNA來源片段與mRNA競爭核糖體結合以調控應激下的翻譯,其他片段則與Argonaute蛋白結合實現轉錄后基因表達調控。tRNA片段的穩定性和功能也受特定核苷酸修飾決定,例如Ψ修飾的tRNA片段在干細胞和癌細胞中選擇性抑制異常蛋白合成。
rRNA修飾(如2'-O-甲基化(2'-O-Me)和假尿苷(ψ))由snoRNA介導,影響核糖體生物發生和翻譯準確性。長鏈非編碼RNA(lncRNA)修飾(如m6A、m⁵C)與mRNA類似,但功能多與翻譯無關。
RNA修飾的生理功能
所有細胞中能量消耗最大的過程是蛋白質合成,必須由RNA修飾通過代謝物、營養物質和細胞代謝通路的直接調控來嚴格平衡合成與分解代謝。在響應環境脅迫時,全局蛋白質合成和轉錄被抑制,細胞轉而靶向翻譯應激特異性調控蛋白,急性細胞應激響應完全在翻譯水平調控。RNA修飾蛋白通過去除翻譯抑制mRNA的m7G帽,導致mRNA降解并組裝成mRNA核糖核蛋白,在加工小體(processing bodies)和應激顆粒(stress granules)中積累。
tRNA修飾在適應蛋白合成中具多重調控作用。營養應激可改變tRNA的氨酰化水平,導致蛋白質合成減慢或密碼子使用模式改變;擺動位點(wobble position)修飾可產生轉錄本特異性翻譯效應并增強細胞適應性,細胞缺失修飾在解決應激誘導的蛋白聚集方面存在缺失。
干細胞分化研究揭示了RNA修飾如何連接應激通路與蛋白合成以調控細胞命運。成體組織中慢周期或靜止的干細胞蛋白合成效率較低以節省能量避免早衰,tRNA中m5C的缺失導致內切核酸酶angiogenin對未修飾tRNA的切割增加,引起全局蛋白合成減少,從而維持干細胞功能并延遲分化;氧化應激暴露同樣抑制m5C形成,減少蛋白合成并誘導細胞進入分解代謝狀態。T細胞從靜息狀態向效應細胞轉化時也需要保護tRNA免受切割以維持蛋白合成。
全局翻譯抑制還涉及rRNA加工抑制,未加工rRNA儲存在核仁直至應激消除,核仁動態變化可激活腫瘤抑制蛋白p53和應激信號通路。rRNA修飾也調控轉錄和成熟過程,例如NSUN5缺失去除28S rRNA C3782位的m5C,降低蛋白合成且促進應激下的適應性翻譯程序,并顯著延長生物體壽命。因此,RNA修飾譜隨著微環境的改變而動態變化,通過靶向翻譯啟動細胞應激響應,其失調可導致人類疾病。
病理性異常RNA修飾
RNA修飾酶基因的功能喪失突變,或抑制RNA分子修飾位點發生突變,均可引發人類疾病。異常修飾模式通過導致RNA降解或結構改變影響基因表達,rRNA或tRNA的結構變化影響核糖體結合或密碼子-反密碼子互作,從而降低蛋白合成效率和準確性。調控異常mRNA翻譯通常降低細胞適應環境所需的代謝可塑性,這構成了神經與代謝疾病及癌癥發生的基礎。
神經系統疾病
人腦對異常tRNA修飾譜尤為敏感,編碼tRNA修飾酶的基因突變常與神經發育缺陷相關,導致小頭畸形、智力障礙等癥狀。當tRNA修飾基因PUS7、PUS3(負責Ψ修飾)、FTSJ1(2′-O-Me修飾)或NSUN2(m5C修飾)發生突變時,可能出現矮小、攻擊行為或抑郁焦慮等行為改變。例如,NSUN2在小鼠前額葉皮層過表達足以引起抑郁樣行為,而其敲除則呈現抗抑郁表型。
動物模型和人類干細胞分化實驗揭示,tRNA低修飾會改變腦細胞功能。NSUN2缺失小鼠因神經元分化延遲和運動能力降低而腦體積減小,該缺陷可通過抑制tRNA切割或N-乙酰半胱氨酸抗氧化干預挽救;NSUN2或FTSJ1缺失降低谷氨酸能神經傳遞或突觸功能相關蛋白的密碼子特異性翻譯;TRMT1(負責N2,N2-二甲基鳥苷m2,2G修飾)缺失改變人神經細胞對氧化應激的敏感性。METTL1(負責m7G修飾)敲除導致小鼠胚胎干細胞在自我更新和神經分化必需基因的翻譯過程中發生核糖體停滯。
腦發育中的神經元亞型分化等關鍵階段主要在翻譯水平調控且依賴線粒體代謝;樹突和軸突的復雜結構需要遠離細胞體的局部蛋白合成,800多種mRNA在樹突-軸突區室的翻譯速率高于細胞體,YTHDF蛋白促進m6A修飾mRNA向神經突的定位。在果蠅中,Ythdf與Fmr1(FMRP同源物)互作,FMRP通過調控m6A修飾RNA的穩定性、翻譯和核-質轉運影響神經元突觸可塑性。FMR1表觀遺傳沉默導致脆性X綜合征,該病患者腦組織RNA呈低編輯狀態,自閉癥患者也存在廣泛的RNA編輯失調。
代謝疾病
線粒體疾病是最常見的遺傳性代謝疾病和神經系統疾病,由氧化磷酸化(oxidative phosphorylation, OXPHOS)缺失導致。核基因編碼的線粒體tRNA或rRNA修飾酶突變,以及線粒體基因組影響這些修飾的突變,均可通過破壞線粒體蛋白合成引發線粒體疾病。線粒體基因組僅編碼22個tRNA、2個rRNA和13個OXPHOS系統蛋白,NSUN3介導的線粒體tRNA^Met反密碼子序列34位m5C修飾缺失即可導致線粒體基因翻譯抑制,NSUN3功能喪失突變患者表現為復合線粒體呼吸鏈缺陷和早發性線粒體腦肌病。TRMT5突變同樣導致多種線粒體呼吸鏈復合體缺陷,該酶在反密碼子環37位形成N1-甲基鳥苷(m1G),穩定tRNA-核糖體互作,其缺失引起+1位移碼,導致全局和線粒體翻譯缺陷。ALKBH7在線粒體前tRNA區域去甲基化m2,2G和m1A,減少多順反子線粒體RNA加工,降低線粒體編碼tRNA水平和蛋白翻譯。
值得注意的是,某些修飾直接依賴特定營養因子生成,腸道微生物來源的queuine合成Q修飾,其缺失減慢翻譯并激活未折疊蛋白反應(unfolded protein response);膳食來源的牛磺酸是τm5U和τm5s2U合成的底物,其缺失與心肌病、腎功能障礙和視網膜神經元損傷相關,而補充牛磺酸可改善健康壽命。MTO1催化牛磺酸依賴的線粒體tRNA修飾,其缺失會導致小鼠線粒體翻譯和呼吸活動嚴重受損,人類MTO1突變也引發肥厚型心肌病、乳酸酸中毒、腦病和嬰兒肝衰竭。MELAS(線粒體肌病、腦病、乳酸酸中毒和卒中樣發作)綜合征患者的口服牛磺酸補充III期臨床試驗顯示,該治療干預有效增加線粒體tRNA^Leu(UUR)的牛磺酸依賴修飾并減少卒中樣發作復發。
在糖尿病條件下,eIF4E帽結合活性降低導致某些胞質mRNA的帽子依賴翻譯減少,盡管m6Am帽修飾不調節eIF4E結合,但FTO多態性仍與人類肥胖和2型糖尿病相關。肥胖小鼠中FTO上調導致其m6Am修飾靶基因(富集于代謝過程)下調,進一步損害代謝協調。FTO基因多態性通過調控m6A/m6Am水平與肥胖、2型糖尿病相關,FTO敲除小鼠可抵抗高脂飲食誘導的肥胖。
癌癥
腫瘤發生各階段均需細胞代謝重編程以確保生存和生長,而RNA修飾蛋白是響應外部信號的關鍵調控因子。NSUN2缺失抑制tRNA中m5C形成,是首個在體內證實抑制RNA修飾可增強腫瘤細胞化療敏感性的機制。單獨NSUN2缺失不致死,但增加tRNA片段化、降低全局蛋白合成并迫使腫瘤起始細胞進入靜止狀態,喪失上調m5C修飾的能力使其對細胞毒性應激高度敏感,5-氟尿嘧啶或順鉑處理后腫瘤再生被抑制。5-氮雜胞苷(5-azacytidine)抑制RNA和DNA的m5C形成常用于治療骨髓增生異常綜合征。
細胞質tRNA擺動位點的尿苷修飾同樣參與腫瘤發生,U34位的cm5U、mcm5U、mcm5s2U和ncm5U修飾由Elongator復合體介導,可促進WNT驅動腸腫瘤起始和乳腺癌轉移,同時增強糖酵解相關基因的密碼子依賴翻譯并促進黑色素瘤細胞化療耐藥。Elongator復合體成員(ELP1-ELP6)缺失在不同癌基因背景下可分別促進或抑制癌細胞存活,例如ELP3缺失通過激活p53依賴檢查點導致骨髓衰竭,但ELP3與p53同時失活則促進白血病發生。NSUN3在線粒體tRNA^Met的C34位形成m5C及其衍生物f5C,其缺失降低線粒體OXPHOS組分翻譯,嚴重損害代謝可塑性,導致線粒體m5C缺陷腫瘤無法轉移,提示抑制線粒體翻譯是靶向轉移的潛在策略。
rRNA修飾也通過重編程翻譯支持轉化表型。急性髓系白血病(acute myeloid leukaemia, AML)中特有的2′-O-Me rRNA特征通過重定向氨基酸轉運蛋白mRNA的最優密碼子使用,促進白血病干細胞惡性自我更新。該修飾由C/D box小核仁核糖核蛋白(snoRNP)復合體催化,提供了通過snoRNA反義寡核苷酸(ASO)靶向特定2′-O-Me位點破壞白血病干細胞基因表達程序的可能性。內部m6A修飾在多數癌癥中均有功能報道,首個METTL3抑制劑STM-2457已于2022年進入I期臨床試驗,但METTL3對非轉化細胞也至關重要,其抑制難以選擇性靶向癌細胞。
相比之下,靶向m6A reader蛋白YTHDF2是更有前景的替代策略,YTHDF2缺失選擇性根除白血病干細胞,通過增加m6A修飾的TNFR2 mRNA穩定性,上調白血病細胞的TNF誘導凋亡,但正常造血干細胞功能不受影響。然而長期YTHDF2缺失會導致造血干細胞耗竭,因促炎基因上調引發干細胞功能衰退。其他mRNA修飾如m1A和m5C也能增強癌細胞特定轉錄本的翻譯,但這些修飾同時在更高化學計量的tRNA中共存,抑制了精確分子機制的理解。
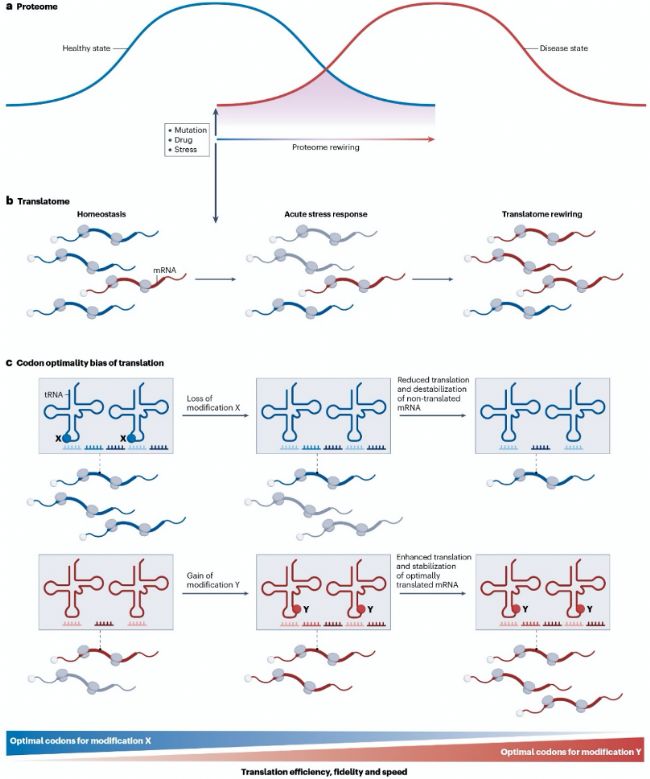
圖4:反密碼子tRNA修飾的細胞背景依賴性功能
RNA修飾的臨床應用
隨著對天然RNA修飾如何影響編碼和非編碼RNA分子機制的深入理解,治療機會不斷涌現,既包括糾正病理性異常修飾,也包括通過在臨床使用的RNA中引入天然或合成修飾來提升療效。
編碼RNA
特定核苷酸修飾穩定mRNA并增強翻譯的能力已被廣泛用于疫苗接種或治療性蛋白遞送。目前ClinicalTrials.gov數據庫中已列出超過450項使用mRNA疫苗的臨床研究,包括靶向感染、癌癥和遺傳病的個性化mRNA疫苗。治療性體外轉錄RNA應盡可能模擬天然成熟胞質mRNA,包含5′帽、poly(A)尾、UTR及內部核苷酸修飾,以增強翻譯并將外源RNA識別為"自身"而避免先天免疫降解。
外源RNA常被模式識別受體(pattern-recognition receptors, PRRs)識別,而特定核苷酸修飾可影響PRR識別并調節炎癥因子釋放。肌苷可阻止MDA5介導的免疫信號,某些核糖甲基化抑制TLR7下游的細胞因子產生。ψ或N1-甲基假尿苷(m1ψ)修飾的mRNA通過TLR7通路免疫原性低,且不易激活蛋白激酶R(protein kinase R, PKR),在PKR磷酸化缺失時eIF2α促進翻譯前起始復合體形成,使mRNA更穩定翻譯。ψ和m1ψ修飾還能幫助解析停滯核糖體并防止翻譯提前終止,提高核糖體密度,這些特性促成了COVID-19 mRNA疫苗的快速成功開發。原則上,任何影響RNA結構和功能的修飾都可應用于mRNA疫苗或蛋白替代療法,但其有效性和安全性信息仍有待研究。
小非編碼RNA
獲批的小非編碼RNA療法包括反義寡核苷酸(antisense oligonucleotides, ASOs),用于降低或增加蛋白水平或改善功能。ASO治療劑均經過化學修飾,如脊髓性肌萎縮癥(spinal muscular atrophy, SMA)治療藥物nusinersen,其2′-O-甲氧乙基修飾結合硫代磷酸骨架,含完全甲基化的m5C和m5U。ASO也已獲批用于杜氏肌營養不良和遺傳性轉甲狀腺素蛋白淀粉樣變性所致多發性神經病。RNA干擾通路編程使用的小干擾RNA(small interfering RNAs, siRNAs)是另一新興療法,patisiran和givosiran已獲批用于遺傳性轉甲狀腺素蛋白淀粉樣變性和急性肝卟啉癥,其特征是完全修飾的核苷酸序列,包括硫代磷酸酯、2′-O-Me、2′-MOE和2′-脫氧-2′-氟(2′-F)組合。
工程化tRNA在糾正提前終止密碼子方面潛力巨大。約10-15%的遺傳病由無義突變導致,人工tRNA可繞過終止信號摻入正確氨基酸。反密碼子編輯的抑制性tRNA(ACE-tRNAs)已在囊性纖維化跨膜調節因子(CFTR)基因無義突變中恢復通道功能,脂質納米顆粒遞送的工程化抑制tRNA(sup-tRNAs)可在小鼠和患者來源的鼻上皮中恢復功能性CFTR產生。另一種策略是通過工程化snoRNA將終止密碼子中的尿苷轉化為Ψ,從而恢復翻譯,該技術已在CFTR G542X無義突變和Hurler綜合征Idua基因W402X突變的小鼠模型中驗證有效,但如何特異性靶向選定轉錄本及組織遞送仍是待解決的問題。tRNA修飾通過提高含最優密碼子轉錄本的翻譯保真度、準確性和效率,還可用于上調蛋白合成,如m1G37修飾可穩定密碼子-反密碼子互作,而tRNA來源片段可通過抑制應激下蛋白合成成為潛在治療手段。
結論與未來展望
盡管迭代的檢測方法、分子技術和遺傳模型推動了對RNA修飾生理與病理功能的理解,但要將表觀轉錄組全面整合到臨床應用中,仍需克服許多局限和挑戰。
首要任務是推進RNA修飾的繪制和定量方法,目前缺乏可靠、穩定的高通量方法以在全基因組范圍同時檢測所有RNA修飾的類型。此外,其中大多數修飾不限于特定RNA類型,某些修飾蛋白同時靶向編碼和非編碼RNA,且不同RNA類型中個別修飾的化學計量差異顯著,使得解析修飾的RNA類型特異性功能極具挑戰性。頗具挑戰的是除tRNA和rRNA外,其他非編碼RNA的功能常不明確,難以闡明其修飾的重要性。未來在單細胞水平對所有RNA類型進行高靈敏度、可重復的修飾動態沉積和功能分析將提供關鍵信息。
其次,需要深入理解RNA修飾的調控網絡。RNA分子壽命直接依賴其修飾譜,但修飾一旦完成,其壽命可能超過相應修飾酶的表達。成熟哺乳動物tRNA半衰期約4天,而修飾酶常瞬時表達,導致修飾水平與修飾酶表達的相關性可能被扭曲。修飾功能常由特定reader蛋白介導,同一修飾在不同序列背景下可能因reader或eraser蛋白的存在與否而功能不同。
第三,靶向RNA修飾蛋白和RNA療法的藥物發現流程亟需優化。現有藥物常缺乏特異性,導致不良反應,需通過計算預測模型、體外高通量酶促實驗和細胞通路互作研究加以改進。RNA療法雖已利用修飾增強穩定性、效力和特異性,但其藥理性質可通過天然與合成化學修飾的組合及最優序列上下文和位置確定進一步優化。最終,結合單細胞水平的比較分析與健康及患病人群細胞中的先進分子、生化與細胞功能研究,將為RNA修飾進一步整合到臨床應用鋪平道路。
總之,當前挑戰包括開發單細胞分辨率修飾檢測技術、解析修飾酶動態網絡、提高靶向藥物特異性。未來需結合單細胞多組學與疾病模型,推動RNA修飾在分層治療中的應用。修飾化學特性的深入理解將優化RNA療法設計,如聯合天然/合成修飾提升藥物穩定性與靶向性。
參考文獻:
Delaunay S, Helm M, Frye M. RNA modifications in physiology and disease: towards clinical applications. Nat Rev Genet. 2023 Sep 15. doi: 10.1038/s41576-023-00645-2.
本文系統總結了150余種RNA修飾通過動態調控mRNA、tRNA與rRNA功能,構建出連接轉錄與翻譯的“表觀轉錄組”系統,此系統通過修飾酶響應環境信號,快速重編程蛋白質合成以實現細胞狀態轉換,失調則導致神經、代謝疾病及癌癥的不良結局。本研究不僅闡明“代謝-修飾-翻譯”軸的調控框架,更推動修飾應用于mRNA疫苗、反義寡核苷酸等臨床療法,且為理解生命過程的動態調控提供全新角度,標志著從中心法則靜態模型向“可塑性轉錄后調控”理論的轉變,有助于促進精準RNA醫學與疾病生物標志物的突破。
 (doi: 10.1038/s41576-023-00645-2)
(doi: 10.1038/s41576-023-00645-2)自20世紀60年代首次發現5-甲基胞苷(m5C)、N6-甲基腺苷(m6A)和假尿苷(Ψ)等天然RNA修飾,迄今已鑒定超過150種不同的RNA修飾,共同組成了復雜的"表觀轉錄組"。目前幾乎所有類型的RNA分子在生命周期中都會攜帶某種或某些化學修飾,這些修飾通過改變核苷酸的靜電荷、疏水表面和堿基配對能力,調控著RNA的穩定性、空間結構及其與蛋白質分子互作的能力。此外,在蛋白質合成過程中發揮核心作用的三類主要RNA:信使RNA(mRNA)、轉運RNA(tRNA)和核糖體RNA(rRNA),這些修飾可在轉錄期間或轉錄后參與調控基因轉錄、RNA加工、出核、細胞定位及mRNA翻譯等多個環節,在基因轉錄與蛋白出核之間構建起關鍵的分子橋梁,進而對細胞功能產生深遠影響(圖1)。
高通量檢測技術的發展推動了全轉錄組范圍內修飾圖譜的繪制,揭示了修飾動態響應外界刺激(如氧化應激、DNA損傷)的調控機制。異常修飾譜可導致神經發育缺陷、代謝疾病及癌癥,而修飾的化學特性(如增強mRNA穩定性和翻譯效率)已被應用于mRNA疫苗等臨床療法。

圖1:RNA修飾影響基因表達的所有步驟
RNA修飾類型
RNA修飾廣泛發生于腺苷(adenosine, A)、鳥苷(guanosine, G)、胞苷(cytidine, C)和尿苷(uridine, U)四種核苷中。嘌呤或嘧啶堿基最常見的修飾類型,包括甲基化、假尿苷化和腺苷-肌苷編輯(adenosine-to-inosine editing)。核糖部分的修飾化學多樣性有限,但2'-O-甲基化(2′-O-methylation, 2′-O-Me)在rRNA、tRNA和snRNA(small nuclear RNA)中頻繁出現。這些核苷酸修飾通過影響RNA加工、穩定性和結構,在轉錄、轉錄后和翻譯水平調控基因表達(表1)。

表1:文中所述RNA修飾及其相應修飾蛋白的關鍵示例
編碼RNA修飾
至少十種核苷酸修飾在真核mRNA中被報道(表1),確保其正確的轉錄、加工、亞細胞定位和翻譯。mRNA中最豐富的修飾是內部位點(如m6A)和5′帽子結構(如m⁷G、m6Am),這些修飾由METTL3-METTL14甲基轉移酶復合體、去甲基酶FTO/ALKBH5等至少20種調控蛋白動態調控。m6A對基因表達受特定reader蛋白結合調控,包括YTH結構域家族和HNRNP蛋白。YTHDF蛋白通常介導mRNA降解,也可促進特定轉錄本翻譯;核內reader蛋白YTHDC1則調控mRNA剪接、定位,并以m6A依賴方式調節染色質可及性和逆轉錄轉座子沉默。5′帽子結構的重要性體現在保護新生mRNA免受降解、促進翻譯起始、并將mRNA標記為"自身"以引導免疫系統區分內外源核酸等多個層面。然而,m6Am對帽子依賴翻譯的影響具有雙重性,既可增強也可減弱翻譯效率。應激狀態下,經典帽子依賴翻譯被破壞,必需mRNA翻譯可通過內部核糖體進入位點(internal ribosome entry sites, IRES)或帽子獨立翻譯增強子維持,或由METTL3結合的3′UTRs區域介導的mRNA環化來促進。非經典帽子結構(如NAD⁺、FAD衍生物)通過代謝物衍生而來,主要來源于NAD、FAD、CoA等代謝物和RNA相關輔因子,影響RNA穩定性、線粒體功能及翻譯。
此外,mRNA中還存在Ψ、肌苷(inosine, I)、N1-甲基腺苷(N1-methyladenosine, m1A)、5-甲基胞苷(5-methylcytidine, m5C)、5-羥甲基胞苷(5-hydroxymethylcytidine, hm5C)和N4-乙酰胞苷(N4-acetylcytidine, ac4C)等修飾。mRNA 3′聚腺苷酸尾(poly(A) tail)與5′帽結構的直接互作可協同增強翻譯,該過程通過PABPC1蛋白與eIF4F復合物的蛋白-蛋白互作實現mRNA環化,促進核糖體環路。METTL3可通過結合eIF3h或PABPC1促進mRNA成環,增強癌基因特異性翻譯。盡管5′帽和m6A修飾的調控蛋白是否直接協作尚不明確,但不同調控蛋白集合在共轉錄和轉錄后階段塑造mRNA修飾譜,在翻譯前或翻譯過程中穩定或不穩定mRNA,均參與轉錄后調控(圖2)。

圖2:編碼RNA中的核苷酸修飾
非編碼RNA修飾
長鏈非編碼RNA(long non-coding RNAs, lncRNAs)通常由RNA聚合酶II轉錄,攜帶m7G帽子、剪接和poly(A)尾,因此很可能安裝有與mRNA相似的修飾。目前已發現MALAT1、vault RNAs、HOTAIR、TERRA、7SK和XIST等lncRNA含有m6A、m5C和Ψ修飾。rRNA在轉錄和成熟過程中也廣泛修飾。但修飾最豐富的RNA類型是tRNA,人類細胞核編碼tRNA平均攜帶13種修飾(占殘基17%),線粒體tRNA平均含5種修飾(占8.7%)。單種修飾的精確功能嚴格取決于其在tRNA分子中的位置,影響轉錄、加工、剪接、穩定性和亞細胞定位。反密碼子區修飾(如 wobble position的U34),結構多樣性最高,可通過調控密碼子識別精度和翻譯效率,適應基因的密碼子使用偏好。反密碼子環外的多數修飾穩定tRNA-mRNA密碼子互作,從而增強解碼準確性和效率。特定tRNA修飾可被單酶或多酶級聯進一步修飾,形成5-甲酰胞苷(5-formylcytidine, f5C)、5-甲氧羰基甲基-2-硫尿苷(5-methoxycarbonylmethyl-2-thiouridine, mcm5s2U)、5-牛磺酸甲基尿苷(5-taurinomethyluridine, τm5U)和5-牛磺酸甲基-2-硫尿苷(τm5s2U)等復雜修飾。位于反密碼子或可變環的修飾如queuosine (Q)或m5C可保護tRNA免受內切核酸酶切割。tRNA片段化是真核生物應對氧化應激的保守反應,某些tRNA來源片段與mRNA競爭核糖體結合以調控應激下的翻譯,其他片段則與Argonaute蛋白結合實現轉錄后基因表達調控。tRNA片段的穩定性和功能也受特定核苷酸修飾決定,例如Ψ修飾的tRNA片段在干細胞和癌細胞中選擇性抑制異常蛋白合成。
rRNA修飾(如2'-O-甲基化(2'-O-Me)和假尿苷(ψ))由snoRNA介導,影響核糖體生物發生和翻譯準確性。長鏈非編碼RNA(lncRNA)修飾(如m6A、m⁵C)與mRNA類似,但功能多與翻譯無關。

圖3:tRNA反密碼子序列中的核苷酸修飾調控翻譯效率
RNA修飾的生理功能
所有細胞中能量消耗最大的過程是蛋白質合成,必須由RNA修飾通過代謝物、營養物質和細胞代謝通路的直接調控來嚴格平衡合成與分解代謝。在響應環境脅迫時,全局蛋白質合成和轉錄被抑制,細胞轉而靶向翻譯應激特異性調控蛋白,急性細胞應激響應完全在翻譯水平調控。RNA修飾蛋白通過去除翻譯抑制mRNA的m7G帽,導致mRNA降解并組裝成mRNA核糖核蛋白,在加工小體(processing bodies)和應激顆粒(stress granules)中積累。
tRNA修飾在適應蛋白合成中具多重調控作用。營養應激可改變tRNA的氨酰化水平,導致蛋白質合成減慢或密碼子使用模式改變;擺動位點(wobble position)修飾可產生轉錄本特異性翻譯效應并增強細胞適應性,細胞缺失修飾在解決應激誘導的蛋白聚集方面存在缺失。
干細胞分化研究揭示了RNA修飾如何連接應激通路與蛋白合成以調控細胞命運。成體組織中慢周期或靜止的干細胞蛋白合成效率較低以節省能量避免早衰,tRNA中m5C的缺失導致內切核酸酶angiogenin對未修飾tRNA的切割增加,引起全局蛋白合成減少,從而維持干細胞功能并延遲分化;氧化應激暴露同樣抑制m5C形成,減少蛋白合成并誘導細胞進入分解代謝狀態。T細胞從靜息狀態向效應細胞轉化時也需要保護tRNA免受切割以維持蛋白合成。
全局翻譯抑制還涉及rRNA加工抑制,未加工rRNA儲存在核仁直至應激消除,核仁動態變化可激活腫瘤抑制蛋白p53和應激信號通路。rRNA修飾也調控轉錄和成熟過程,例如NSUN5缺失去除28S rRNA C3782位的m5C,降低蛋白合成且促進應激下的適應性翻譯程序,并顯著延長生物體壽命。因此,RNA修飾譜隨著微環境的改變而動態變化,通過靶向翻譯啟動細胞應激響應,其失調可導致人類疾病。
病理性異常RNA修飾
RNA修飾酶基因的功能喪失突變,或抑制RNA分子修飾位點發生突變,均可引發人類疾病。異常修飾模式通過導致RNA降解或結構改變影響基因表達,rRNA或tRNA的結構變化影響核糖體結合或密碼子-反密碼子互作,從而降低蛋白合成效率和準確性。調控異常mRNA翻譯通常降低細胞適應環境所需的代謝可塑性,這構成了神經與代謝疾病及癌癥發生的基礎。
神經系統疾病
人腦對異常tRNA修飾譜尤為敏感,編碼tRNA修飾酶的基因突變常與神經發育缺陷相關,導致小頭畸形、智力障礙等癥狀。當tRNA修飾基因PUS7、PUS3(負責Ψ修飾)、FTSJ1(2′-O-Me修飾)或NSUN2(m5C修飾)發生突變時,可能出現矮小、攻擊行為或抑郁焦慮等行為改變。例如,NSUN2在小鼠前額葉皮層過表達足以引起抑郁樣行為,而其敲除則呈現抗抑郁表型。
動物模型和人類干細胞分化實驗揭示,tRNA低修飾會改變腦細胞功能。NSUN2缺失小鼠因神經元分化延遲和運動能力降低而腦體積減小,該缺陷可通過抑制tRNA切割或N-乙酰半胱氨酸抗氧化干預挽救;NSUN2或FTSJ1缺失降低谷氨酸能神經傳遞或突觸功能相關蛋白的密碼子特異性翻譯;TRMT1(負責N2,N2-二甲基鳥苷m2,2G修飾)缺失改變人神經細胞對氧化應激的敏感性。METTL1(負責m7G修飾)敲除導致小鼠胚胎干細胞在自我更新和神經分化必需基因的翻譯過程中發生核糖體停滯。
腦發育中的神經元亞型分化等關鍵階段主要在翻譯水平調控且依賴線粒體代謝;樹突和軸突的復雜結構需要遠離細胞體的局部蛋白合成,800多種mRNA在樹突-軸突區室的翻譯速率高于細胞體,YTHDF蛋白促進m6A修飾mRNA向神經突的定位。在果蠅中,Ythdf與Fmr1(FMRP同源物)互作,FMRP通過調控m6A修飾RNA的穩定性、翻譯和核-質轉運影響神經元突觸可塑性。FMR1表觀遺傳沉默導致脆性X綜合征,該病患者腦組織RNA呈低編輯狀態,自閉癥患者也存在廣泛的RNA編輯失調。
代謝疾病
線粒體疾病是最常見的遺傳性代謝疾病和神經系統疾病,由氧化磷酸化(oxidative phosphorylation, OXPHOS)缺失導致。核基因編碼的線粒體tRNA或rRNA修飾酶突變,以及線粒體基因組影響這些修飾的突變,均可通過破壞線粒體蛋白合成引發線粒體疾病。線粒體基因組僅編碼22個tRNA、2個rRNA和13個OXPHOS系統蛋白,NSUN3介導的線粒體tRNA^Met反密碼子序列34位m5C修飾缺失即可導致線粒體基因翻譯抑制,NSUN3功能喪失突變患者表現為復合線粒體呼吸鏈缺陷和早發性線粒體腦肌病。TRMT5突變同樣導致多種線粒體呼吸鏈復合體缺陷,該酶在反密碼子環37位形成N1-甲基鳥苷(m1G),穩定tRNA-核糖體互作,其缺失引起+1位移碼,導致全局和線粒體翻譯缺陷。ALKBH7在線粒體前tRNA區域去甲基化m2,2G和m1A,減少多順反子線粒體RNA加工,降低線粒體編碼tRNA水平和蛋白翻譯。
值得注意的是,某些修飾直接依賴特定營養因子生成,腸道微生物來源的queuine合成Q修飾,其缺失減慢翻譯并激活未折疊蛋白反應(unfolded protein response);膳食來源的牛磺酸是τm5U和τm5s2U合成的底物,其缺失與心肌病、腎功能障礙和視網膜神經元損傷相關,而補充牛磺酸可改善健康壽命。MTO1催化牛磺酸依賴的線粒體tRNA修飾,其缺失會導致小鼠線粒體翻譯和呼吸活動嚴重受損,人類MTO1突變也引發肥厚型心肌病、乳酸酸中毒、腦病和嬰兒肝衰竭。MELAS(線粒體肌病、腦病、乳酸酸中毒和卒中樣發作)綜合征患者的口服牛磺酸補充III期臨床試驗顯示,該治療干預有效增加線粒體tRNA^Leu(UUR)的牛磺酸依賴修飾并減少卒中樣發作復發。
在糖尿病條件下,eIF4E帽結合活性降低導致某些胞質mRNA的帽子依賴翻譯減少,盡管m6Am帽修飾不調節eIF4E結合,但FTO多態性仍與人類肥胖和2型糖尿病相關。肥胖小鼠中FTO上調導致其m6Am修飾靶基因(富集于代謝過程)下調,進一步損害代謝協調。FTO基因多態性通過調控m6A/m6Am水平與肥胖、2型糖尿病相關,FTO敲除小鼠可抵抗高脂飲食誘導的肥胖。
癌癥
腫瘤發生各階段均需細胞代謝重編程以確保生存和生長,而RNA修飾蛋白是響應外部信號的關鍵調控因子。NSUN2缺失抑制tRNA中m5C形成,是首個在體內證實抑制RNA修飾可增強腫瘤細胞化療敏感性的機制。單獨NSUN2缺失不致死,但增加tRNA片段化、降低全局蛋白合成并迫使腫瘤起始細胞進入靜止狀態,喪失上調m5C修飾的能力使其對細胞毒性應激高度敏感,5-氟尿嘧啶或順鉑處理后腫瘤再生被抑制。5-氮雜胞苷(5-azacytidine)抑制RNA和DNA的m5C形成常用于治療骨髓增生異常綜合征。
細胞質tRNA擺動位點的尿苷修飾同樣參與腫瘤發生,U34位的cm5U、mcm5U、mcm5s2U和ncm5U修飾由Elongator復合體介導,可促進WNT驅動腸腫瘤起始和乳腺癌轉移,同時增強糖酵解相關基因的密碼子依賴翻譯并促進黑色素瘤細胞化療耐藥。Elongator復合體成員(ELP1-ELP6)缺失在不同癌基因背景下可分別促進或抑制癌細胞存活,例如ELP3缺失通過激活p53依賴檢查點導致骨髓衰竭,但ELP3與p53同時失活則促進白血病發生。NSUN3在線粒體tRNA^Met的C34位形成m5C及其衍生物f5C,其缺失降低線粒體OXPHOS組分翻譯,嚴重損害代謝可塑性,導致線粒體m5C缺陷腫瘤無法轉移,提示抑制線粒體翻譯是靶向轉移的潛在策略。
rRNA修飾也通過重編程翻譯支持轉化表型。急性髓系白血病(acute myeloid leukaemia, AML)中特有的2′-O-Me rRNA特征通過重定向氨基酸轉運蛋白mRNA的最優密碼子使用,促進白血病干細胞惡性自我更新。該修飾由C/D box小核仁核糖核蛋白(snoRNP)復合體催化,提供了通過snoRNA反義寡核苷酸(ASO)靶向特定2′-O-Me位點破壞白血病干細胞基因表達程序的可能性。內部m6A修飾在多數癌癥中均有功能報道,首個METTL3抑制劑STM-2457已于2022年進入I期臨床試驗,但METTL3對非轉化細胞也至關重要,其抑制難以選擇性靶向癌細胞。
相比之下,靶向m6A reader蛋白YTHDF2是更有前景的替代策略,YTHDF2缺失選擇性根除白血病干細胞,通過增加m6A修飾的TNFR2 mRNA穩定性,上調白血病細胞的TNF誘導凋亡,但正常造血干細胞功能不受影響。然而長期YTHDF2缺失會導致造血干細胞耗竭,因促炎基因上調引發干細胞功能衰退。其他mRNA修飾如m1A和m5C也能增強癌細胞特定轉錄本的翻譯,但這些修飾同時在更高化學計量的tRNA中共存,抑制了精確分子機制的理解。

圖4:反密碼子tRNA修飾的細胞背景依賴性功能
RNA修飾的臨床應用
隨著對天然RNA修飾如何影響編碼和非編碼RNA分子機制的深入理解,治療機會不斷涌現,既包括糾正病理性異常修飾,也包括通過在臨床使用的RNA中引入天然或合成修飾來提升療效。
編碼RNA
特定核苷酸修飾穩定mRNA并增強翻譯的能力已被廣泛用于疫苗接種或治療性蛋白遞送。目前ClinicalTrials.gov數據庫中已列出超過450項使用mRNA疫苗的臨床研究,包括靶向感染、癌癥和遺傳病的個性化mRNA疫苗。治療性體外轉錄RNA應盡可能模擬天然成熟胞質mRNA,包含5′帽、poly(A)尾、UTR及內部核苷酸修飾,以增強翻譯并將外源RNA識別為"自身"而避免先天免疫降解。
外源RNA常被模式識別受體(pattern-recognition receptors, PRRs)識別,而特定核苷酸修飾可影響PRR識別并調節炎癥因子釋放。肌苷可阻止MDA5介導的免疫信號,某些核糖甲基化抑制TLR7下游的細胞因子產生。ψ或N1-甲基假尿苷(m1ψ)修飾的mRNA通過TLR7通路免疫原性低,且不易激活蛋白激酶R(protein kinase R, PKR),在PKR磷酸化缺失時eIF2α促進翻譯前起始復合體形成,使mRNA更穩定翻譯。ψ和m1ψ修飾還能幫助解析停滯核糖體并防止翻譯提前終止,提高核糖體密度,這些特性促成了COVID-19 mRNA疫苗的快速成功開發。原則上,任何影響RNA結構和功能的修飾都可應用于mRNA疫苗或蛋白替代療法,但其有效性和安全性信息仍有待研究。
小非編碼RNA
獲批的小非編碼RNA療法包括反義寡核苷酸(antisense oligonucleotides, ASOs),用于降低或增加蛋白水平或改善功能。ASO治療劑均經過化學修飾,如脊髓性肌萎縮癥(spinal muscular atrophy, SMA)治療藥物nusinersen,其2′-O-甲氧乙基修飾結合硫代磷酸骨架,含完全甲基化的m5C和m5U。ASO也已獲批用于杜氏肌營養不良和遺傳性轉甲狀腺素蛋白淀粉樣變性所致多發性神經病。RNA干擾通路編程使用的小干擾RNA(small interfering RNAs, siRNAs)是另一新興療法,patisiran和givosiran已獲批用于遺傳性轉甲狀腺素蛋白淀粉樣變性和急性肝卟啉癥,其特征是完全修飾的核苷酸序列,包括硫代磷酸酯、2′-O-Me、2′-MOE和2′-脫氧-2′-氟(2′-F)組合。
工程化tRNA在糾正提前終止密碼子方面潛力巨大。約10-15%的遺傳病由無義突變導致,人工tRNA可繞過終止信號摻入正確氨基酸。反密碼子編輯的抑制性tRNA(ACE-tRNAs)已在囊性纖維化跨膜調節因子(CFTR)基因無義突變中恢復通道功能,脂質納米顆粒遞送的工程化抑制tRNA(sup-tRNAs)可在小鼠和患者來源的鼻上皮中恢復功能性CFTR產生。另一種策略是通過工程化snoRNA將終止密碼子中的尿苷轉化為Ψ,從而恢復翻譯,該技術已在CFTR G542X無義突變和Hurler綜合征Idua基因W402X突變的小鼠模型中驗證有效,但如何特異性靶向選定轉錄本及組織遞送仍是待解決的問題。tRNA修飾通過提高含最優密碼子轉錄本的翻譯保真度、準確性和效率,還可用于上調蛋白合成,如m1G37修飾可穩定密碼子-反密碼子互作,而tRNA來源片段可通過抑制應激下蛋白合成成為潛在治療手段。
結論與未來展望
盡管迭代的檢測方法、分子技術和遺傳模型推動了對RNA修飾生理與病理功能的理解,但要將表觀轉錄組全面整合到臨床應用中,仍需克服許多局限和挑戰。
首要任務是推進RNA修飾的繪制和定量方法,目前缺乏可靠、穩定的高通量方法以在全基因組范圍同時檢測所有RNA修飾的類型。此外,其中大多數修飾不限于特定RNA類型,某些修飾蛋白同時靶向編碼和非編碼RNA,且不同RNA類型中個別修飾的化學計量差異顯著,使得解析修飾的RNA類型特異性功能極具挑戰性。頗具挑戰的是除tRNA和rRNA外,其他非編碼RNA的功能常不明確,難以闡明其修飾的重要性。未來在單細胞水平對所有RNA類型進行高靈敏度、可重復的修飾動態沉積和功能分析將提供關鍵信息。
其次,需要深入理解RNA修飾的調控網絡。RNA分子壽命直接依賴其修飾譜,但修飾一旦完成,其壽命可能超過相應修飾酶的表達。成熟哺乳動物tRNA半衰期約4天,而修飾酶常瞬時表達,導致修飾水平與修飾酶表達的相關性可能被扭曲。修飾功能常由特定reader蛋白介導,同一修飾在不同序列背景下可能因reader或eraser蛋白的存在與否而功能不同。
第三,靶向RNA修飾蛋白和RNA療法的藥物發現流程亟需優化。現有藥物常缺乏特異性,導致不良反應,需通過計算預測模型、體外高通量酶促實驗和細胞通路互作研究加以改進。RNA療法雖已利用修飾增強穩定性、效力和特異性,但其藥理性質可通過天然與合成化學修飾的組合及最優序列上下文和位置確定進一步優化。最終,結合單細胞水平的比較分析與健康及患病人群細胞中的先進分子、生化與細胞功能研究,將為RNA修飾進一步整合到臨床應用鋪平道路。
總之,當前挑戰包括開發單細胞分辨率修飾檢測技術、解析修飾酶動態網絡、提高靶向藥物特異性。未來需結合單細胞多組學與疾病模型,推動RNA修飾在分層治療中的應用。修飾化學特性的深入理解將優化RNA療法設計,如聯合天然/合成修飾提升藥物穩定性與靶向性。
參考文獻:
Delaunay S, Helm M, Frye M. RNA modifications in physiology and disease: towards clinical applications. Nat Rev Genet. 2023 Sep 15. doi: 10.1038/s41576-023-00645-2.
標簽:
RNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






