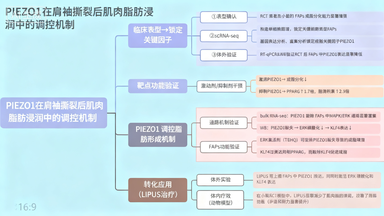
整合Bulk RNA-seq技術揭示PIEZO1在肌肉脂肪浸潤中的調控機制
肩袖撕裂(Rotator Cuff Tear, RCT)作為常見的肌肉骨骼疾病,其術后高再撕裂率與肌肉脂肪浸潤密切相關。成纖維/脂肪前體細胞(Fibrogenic/Adipogenic Progenitors, FAPs)作為表達PDGFRα的多能前體細胞,在病理狀態下具有向脂肪細胞分化的潛能,成為研究肌肉脂肪浸潤的關鍵靶點。
本研究旨在通過整合單細胞RNA測序(scRNA-seq)和Bulk RNA-seq技術,系統解析以下科學問題:RCT后FAPs成脂分化的分子機制、機械敏感離子通道PIEZO1在其中的調控作用,以及潛在的非侵入性治療策略。
二、Bulk RNA-seq在靶點驗證中的關鍵作用
差異表達基因的全局分析
通過Bulk RNA-seq技術,研究團隊對PIEZO1敲除(KO)與野生型(f/f)FAPs進行了全轉錄組分析。結果顯示,PIEZO1敲除導致大量基因表達改變,其中MAPK/ERK信號通路在KEGG富集分析中顯著富集。這一發現為后續機制研究提供了重要方向。
信號通路的系統性驗證
Western blot實驗證實,PIEZO1下調顯著抑制ERK磷酸化水平。通過使用特異性ERK激活劑TBHQ處理PIEZO1敲除FAPs,研究人員觀察到脂肪形成能力顯著減弱,脂滴形成減少,成脂關鍵標志物PPARG表達降低,這些證據共同確立了ERK作為PIEZO1下游效應分子的地位。
三、多組學技術協同揭示調控網絡
技術優勢的互補性整合
Bulk RNA-seq與scRNA-seq技術的協同應用構建了完整的分子調控網絡。scRNA-seq在單細胞分辨率下精準定位了FAPs中PIEZO1的表達下調,而Bulk RNA-seq則從群體細胞水平系統解析了PIEZO1調控的下游信號通路,兩者共同支撐了"PIEZO1-ERK-KLF4"調控軸的確立。
分子機制的深度解析
進一步機制研究表明,PIEZO1激活可促進轉錄因子KLF4的表達,而PIEZO1敲除或ERK抑制均會降低KLF4水平。分子水平上,KLF4作為轉錄因子可直接結合成脂關鍵基因PPARG的啟動子區域,抑制其轉錄活性,從而有效阻遏FAPs的成脂分化進程。
四、治療潛力的轉化研究
低強度脈沖超聲的干預效應
研究團隊探索了低強度脈沖超聲(LIPUS)作為非侵入性治療手段的潛力。體外實驗顯示,LIPUS處理可顯著上調FAPs中PIEZO1的表達,同時激活ERK磷酸化和促進KLF4表達。
體內功能驗證
在RCT小鼠模型中,LIPUS干預顯著改善了肌肉組織的病理表現:脂肪標志物Plin1陽性面積減少,甘油三酯含量顯著降低。更重要的是,LIPUS處理組小鼠在肩部步態參數和運動耐力方面均表現出明顯改善。
機制特異性驗證
通過使用PIEZO1抑制劑GsMTx4和ERK抑制劑U0126,研究人員證實了LIPUS的治療效果依賴于PIEZO1-ERK-KLF4信號通路的激活,進一步驗證了該通路在肌肉脂肪浸潤中的核心地位。
五、研究意義與技術展望
本研究通過巧妙整合Bulk RNA-seq與scRNA-seq技術,不僅揭示了PIEZO1通過ERK/KLF4信號通路調控FAPs成脂分化的新機制,更為肩袖撕裂后肌肉脂肪浸潤的臨床治療提供了潛在的非手術干預策略。
從技術層面而言,Bulk RNA-seq在通路水平的穩定檢測能力與scRNA-seq的單細胞分辨率形成完美互補,這種多組學整合策略為復雜疾病機制研究提供了有力工具。未來研究中,進一步結合表觀基因組學和蛋白質組學分析,將有望更全面地解析機械信號在組織修復和再生中的調控網絡。
六、樂備實(LabEx)助力固有淋巴細胞研究的多因子檢測產品| 技術名稱 | 核心原理 | 關鍵優勢 | 真核測序樣品要求 | 核心分析內容(部分) |
|---|---|---|---|---|
| Bulk 轉錄組測序 | 分析特定物種、組織或細胞在特定生理狀態下的所有 RNA(含 mRNA 和 ncRNA),可研究 lncRNA 調控網絡;mRNA-Seq 能量化基因表達、識別轉錄異構體等。 | 1. 動態范圍更廣,靈敏度更高,基因表達倍數變化測量更準確;
|
1. 樣本類型:total RNA;
|
差異表達分析、可變剪接分析、GO/KEGG 富集分析、lncRNA-mRNA 共表達分析等 |
樂備實是國內專注于提供高質量蛋白檢測以及組學分析服務的實驗服務專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務技術平臺已擴展到單細胞測序、空間多組學、流式檢測、超敏電化學發光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學等30多個,建立起了一套涵蓋基因、蛋白、細胞以及組織水平實驗的完整檢測體系。






