山大齊魯醫院聯合北大人民醫院揭示透明細胞腎細胞癌免疫逃逸機制
研究背景
癌癥細胞內在特征(如遺傳畸變和信號通路失調)在協調免疫景觀的組成和功能狀態方面發揮著關鍵作用,并影響腫瘤的進展和對免疫療法的反應。近期山東大學齊魯醫院陳守臻、史本康、張寧團隊聯合北京大學人民醫院韓博團隊在Advanced Science (IF 14.1)上發表文章“SMYD3 Promotes Immune Evasion in Clear Cell Renal Cell Carcinoma via SREBP1-Mediated Transactivation of CD47”,闡明了癌細胞內在的SMYD3-SREBP1-CD47軸在調節ccRCC免疫微環境中的關鍵作用,并提供了一種潛在的治療策略來操縱腫瘤免疫環境以促進抗腫瘤免疫。
· 維真助力 - 慢病毒·
基因信息
SMYD3:包含SET和MYND結構域的蛋白3
CD47:整合素相關蛋白
SREBP1:固醇調節元件結合蛋白1
病毒產品
Lv-shSmyd3(mouse)、Lv-shCd47(mouse)、Lv-shSMYD3(human)、Lv-shSREBP1(human)、Lv-Srebp1(mouse)、Lv-Cd47(mouse)、Lv-SREBP1(human)
實驗細胞
TK10 和 786-O cells
結果展示
1. ccRCC細胞SMYD3缺乏增強抗PD-1反應
作者發現SMYD3表達增加與ccRCC(透明細胞腎細胞癌)患者免疫浸潤不良和生存率降低呈正相關,并且高水平的SMYD3與不良預后相關,導致ccRCC TIME中Th2細胞浸潤增加。這些結果表明,SMYD3在調節ccRCC TME中的免疫細胞浸潤方面起著重要作用。為了進一步探索SMYD3在體內調節ICI療效中的作用,作者使用SMYD3敲低RENCA細胞系,在BALB/c小鼠中構建了原位同基因小鼠模型。發現Smyd3敲低恢復了抗PD-1治療的敏感性,減少了Th2細胞對RENCA腫瘤TME的浸潤。對RCC臨床試驗IMmotion151的數據分析表明,SMYD3的高表達與較低的ICI反應率有關,無反應組的Th2細胞浸潤比反應組更大,SMYD3表達也與Th2細胞浸潤呈正相關。進一步研究發現CD47是SMYD3靶標,介導ccRCC的免疫逃避。
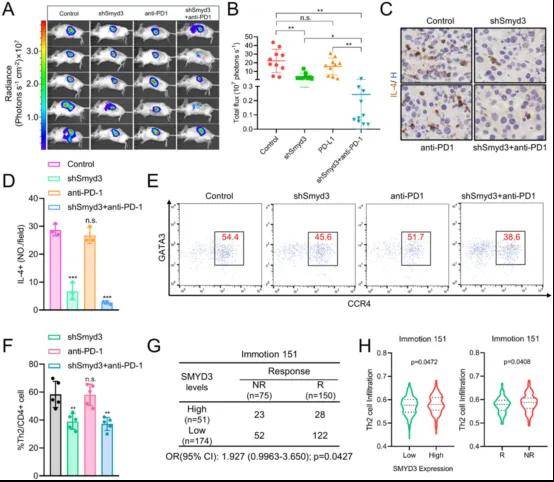 圖1 SMYD3的敲低可減少Th2細胞浸潤并增強抗PD-1作用
圖1 SMYD3的敲低可減少Th2細胞浸潤并增強抗PD-1作用
2. CD47缺乏會影響ccRCC中的腫瘤生長和Th2細胞的浸潤
鑒于CD47是SMYD3的下游效應分子,參與協調ccRCC中的抑制性免疫微環境,作者探討了ccRCC中CD47的表達與Th2細胞之間的相關性。發現CD47表達與Th2細胞的基因集呈正相關。免疫熒光檢測結果也證實高CD47表達水平與Th2細胞浸潤呈正相關。接下來作者探討了CD47對腫瘤生長和Th2細胞浸潤的影響,發現在原位同基因小鼠模型中敲除Cd47會損害腫瘤生長,在敲除Cd47的RENCA腫瘤中也觀察到Th2細胞浸潤較少。為了進一步探討SMYD3是否通過CD47促進ccRCC中Th2細胞的浸潤,作者在SMYD3敲低的RENCA細胞中過表達Cd47,發現Cd47的表達有效地逆轉了Smyd3敲低介導的腫瘤生長抑制,消除了Smyd3敲低誘導的IL-4蛋白水平降低和Th2細胞浸潤減少。
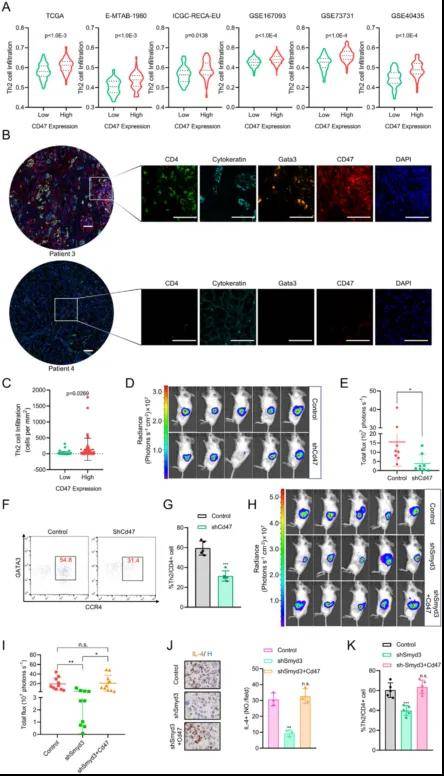
圖2 CD47促進ccRCC TME中Th2細胞浸潤
3. SMYD3通過SREBP1調節CD47的表達 促進ccRCC的免疫逃避
SREBP1是SMYD3的下游轉錄因子,能調節CD47表達,CD47是癌癥細胞表面表達的抑制性檢查點靶點,也是先天免疫系統中巨噬細胞的重要抗吞噬調節因子。因此作者試圖探索SMYD3在保護腫瘤細胞免受免疫系統清除中的作用,發現SMYD3敲低顯著增加TK10和786-O細胞的吞噬作用。為了確定SMYD3是否通過SREBP1的表達激活和CD47上調來驅動腫瘤免疫逃逸,作者在SMYD3敲低的786-O和TK10細胞中過表達SREBP1,發現SREBP1的過表達消除了SMYD3敲除引起的吞噬細胞對腫瘤細胞的清除,且當SREBP1過表達時,細胞的致瘤性增加、Th2細胞的浸潤模式與致瘤性相似。
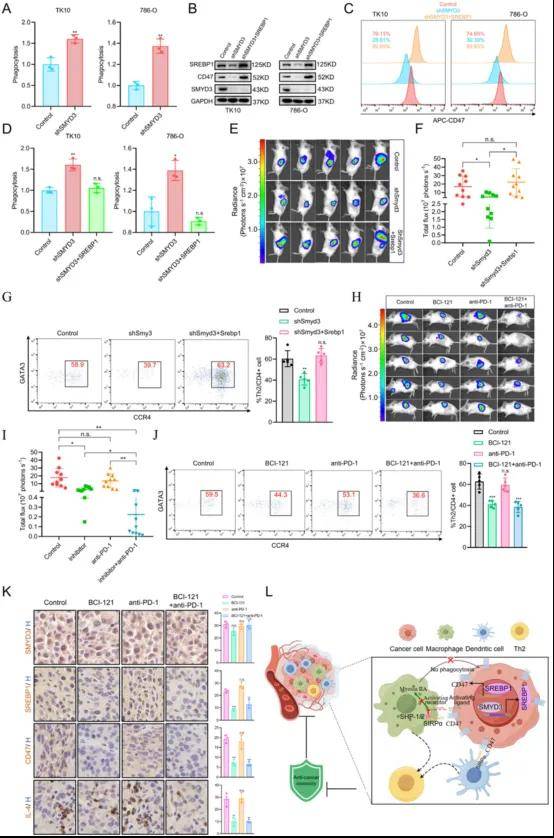 圖3 SMYD3保護癌癥細胞免受吞噬作用,SMYD3抑制增強了抗PD-1反應
圖3 SMYD3保護癌癥細胞免受吞噬作用,SMYD3抑制增強了抗PD-1反應
實驗結論
本研究闡明了癌癥細胞內在SMYD3-SREBP1-CD47軸在調節ccRCC免疫微環境中的關鍵作用,在機制上CD47是一種在腫瘤細胞上表達的先天免疫檢查點分子,是SMYD3的下游分子,可以抑制ccRCC中的抗腫瘤免疫。因此,阻斷SMYD3和PD-1的聯合治療可能是減少抗CD47治療引起的脫靶效應的有前景的方案。






