頂刊綜述解讀:RNA修飾系統(tǒng)作為疾病治療靶點的研究進展
近日,芝加哥大學華人科學家何川教授團隊在國際頂刊《Nature Reviews Drug Discovery》(IF=101.8) 發(fā)表題為 “RNA modification systems as therapeutic targets” 的綜述文章,全景式闡述了 RNA 修飾系統(tǒng)作為治療靶點的前沿進展。文章系統(tǒng)梳理了 RNA 修飾調(diào)控蛋白的細胞功能與疾病關聯(lián),重點聚焦 N6 - 甲基腺苷(m6A)通路,詳解了靶向 YTH reader 蛋白等抑制劑的開發(fā)突破,并展望了其他 RNA 修飾通路的靶標潛力。這一綜述不僅為癌癥治療開辟了靶向表觀遺傳調(diào)控的全新路徑,更推動免疫治療實現(xiàn)策略升級,同時為干細胞治療與再生醫(yī)學提供了創(chuàng)新性思路,標志著 RNA 修飾靶向療法已進入臨床轉(zhuǎn)化的關鍵階段。
 DOI:10.1038/s41573-025-01280-8
DOI:10.1038/s41573-025-01280-8
RNA修飾、調(diào)控蛋白及分子功能
在眾多RNA修飾中,N6-甲基腺苷(N6-methyladenosine, m6A)、N7-甲基鳥苷(N7-methylguanosine, m7G)、5-甲基胞苷(5-methylcytosine, m5C) 、N1-甲基腺苷(N1-methyladenosine, m1A)、假尿苷(Ψ)和2'-O-甲基化(2'-O-methylation, Nm)是調(diào)控基因表達和細胞生物學過程的關鍵化學標記。與表觀基因組修飾類似,RNA修飾在不改變DNA或RNA序列的情況下對基因表達存在關鍵作用。
RNA修飾可以在共轉(zhuǎn)錄或轉(zhuǎn)錄后添加,導致RNA結(jié)構(gòu)、加工、翻譯及降解的改變(表1)。這些功能由識別并結(jié)合修飾的RNA結(jié)合蛋白(RBPs,"readers")介導。除了RNA代謝和翻譯,RNA修飾還可以調(diào)控RNA:DNA雜合體形成,參與影響全局染色質(zhì)狀態(tài)和轉(zhuǎn)錄。
此外,基于RNA修飾作用的多種關鍵生物通路與疾病的關聯(lián)正在逐步解析,如RNA修飾調(diào)控癌癥中的致癌通路,STM2457是第一個設計用于抑制RNA修飾酶催化活性的小分子,它能抑制m6A writer酶METTL3,在抑制急性髓性白血病(AML)小鼠模型中植入和擴增,成功證明了靶向RNA修飾酶治療癌癥的潛力。這項研究開發(fā)的首個影響RNA修飾酶的候選藥物已進入臨床試驗。令人意外的,一些已獲批的藥物也被發(fā)現(xiàn)是RNA修飾的有效調(diào)控劑,如帕金森病藥物安托卡朋(antecapone)被發(fā)現(xiàn)能抑制m6A去甲基酶FTO。綜上,這些進展突顯了靶向RNA修飾治療疾病的潛力。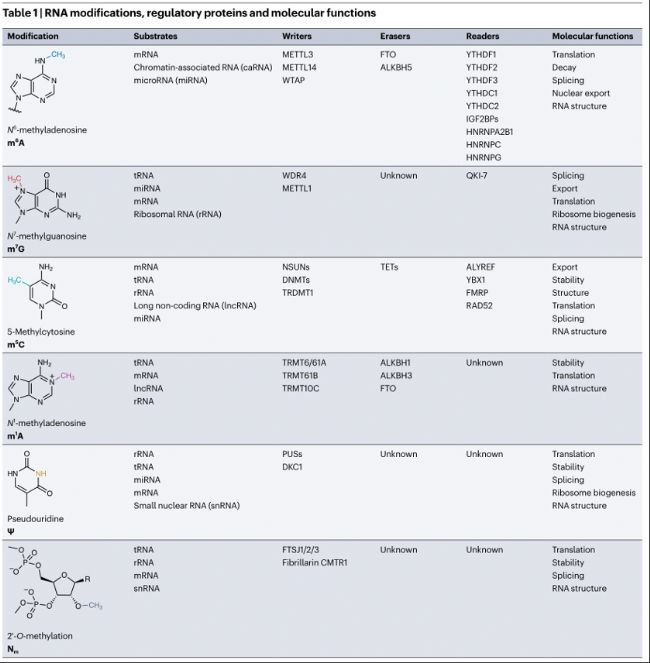
表1:RNA修飾、調(diào)控蛋白及分子功能
N6-甲基腺苷(m6A))
m6A是哺乳動物中最豐富的RNA修飾。平均每個哺乳動物轉(zhuǎn)錄本有三個m6A修飾,位于RRm6ACH(R=A/G;H=A/C/U)的共有序列中。m6A甲基化盡管發(fā)生在mRNA的各個區(qū)域,但在3'非翻譯區(qū)(UTR)和靠近終止密碼子處富集。m6A甲基化由"甲基轉(zhuǎn)移酶(writers)"METTL3和METTL14沉積,可被"去甲基化酶(erasers)"FTO和ALKBH5去除。m6A修飾的RNA通過與RNA結(jié)合蛋白來調(diào)控RNA代謝,包括加工、運輸、翻譯及穩(wěn)定性(圖1),這些調(diào)控功能已在多種生物系統(tǒng)中得到了廣泛研究,m6A調(diào)控多種過程,如干細胞分化、組織發(fā)育、信號通路、應激反應、神經(jīng)功能、病毒感染和代謝等,m6A失調(diào)與癌癥、免疫穩(wěn)態(tài)、代謝疾病和神經(jīng)紊亂相關。
METTL3、METTL14和調(diào)控亞基WTAP是沉積m6A的主要RNA甲基轉(zhuǎn)移酶"writers"復合體的關鍵組分,其中METTL3和METTL14形成核心穩(wěn)定的異源二聚體。METTL3表現(xiàn)出催化活性并結(jié)合甲基供體S-腺苷甲硫氨酸(SAM),而METTL14穩(wěn)定甲基轉(zhuǎn)移酶復合物以促進RNA結(jié)合和甲基化。
m6A mRNA甲基化可通過影響RNA翻譯和穩(wěn)定性影響許多致癌通路(圖2)。例如,約1.5%的子宮內(nèi)膜癌患者在METTL14中有R298P突變殘基,與鄰近正常組織相比,大部分子宮內(nèi)膜癌中METTL3下調(diào),導致m6A甲基化水平低。由此導致的PHLPP2 mRNA低甲基化降低了這種AKT激酶負調(diào)控因子的翻譯,而對mTORC2組分編碼mRNA的低甲基化抑制了mRNA衰變并增加mTORC2表達。結(jié)果,AKT通路被激活,刺激子宮內(nèi)膜癌的增殖和腫瘤發(fā)生。METTL14的純合R298P突變將其基序偏好從[G/A][G/A]ACU轉(zhuǎn)變?yōu)镚l[A][C/U]U。雖然METTL14變化確實導致mRNA整體甲基化減少,但在非經(jīng)典位點觀察到m6A甲基化增加。
p53通路也受m6A調(diào)控(圖2b)。METTL3-METTL14復合體甲基化編碼p53抑制因子MDM2的mRNA。METTL3和METTL14在AML中表達均升高。與健康個體相比,AML患者中MDM2 mRNA高度甲基化,增加了MDM2蛋白表達并抑制p53信號。METTL3還與MDM2競爭p53結(jié)合,從而穩(wěn)定p53。p53與METTL3互作促進METTL3介導的m6A甲基化,進而形成正反饋回路。
此外,調(diào)控m6A修飾或許能成為抗感染、調(diào)控免疫反應以及增強免疫治療效果的新策略(圖3)。
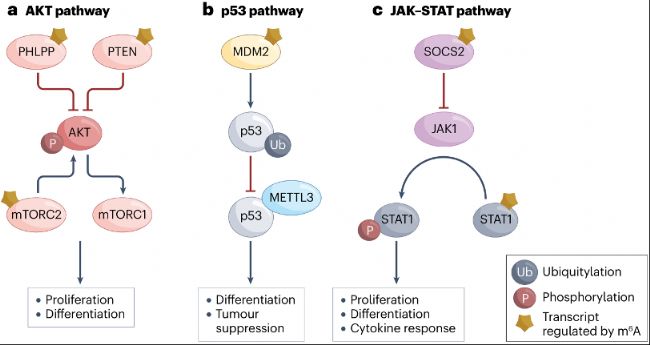
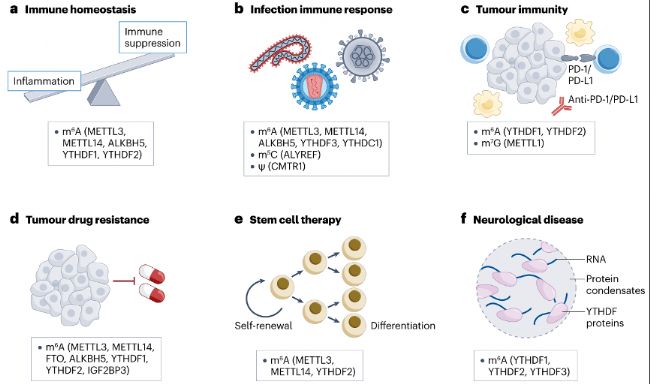
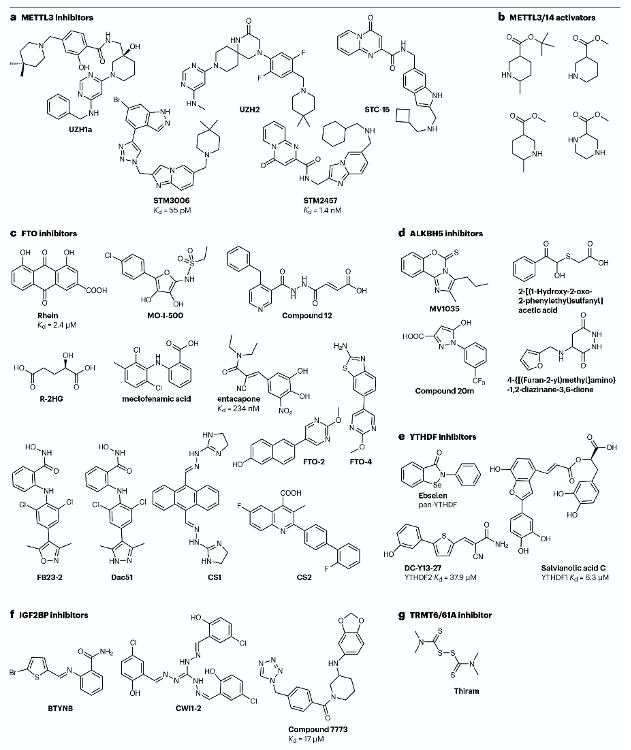
圖4:靶向RNA修飾“writer”、“eraser”和“reader”蛋白的抑制劑。
FTO(肥胖相關基因,fat-mass and obesity-associated gene)和ALKBH5(AlkB同源蛋白5)是m6A去甲基化酶,能去除mRNA上的m6A修飾。FTO在多種癌癥中過表達,包括AML、膠質(zhì)母細胞瘤和乳腺癌,與不良預后相關。FTO通過去甲基化致癌轉(zhuǎn)錄本如MYC、BCL2和CEBPA促進腫瘤發(fā)生。ALKBH5在缺氧條件下被誘導,在膠質(zhì)母細胞瘤干細胞、AML和乳腺癌中高表達,通過調(diào)控NANOG等干細胞因子維持癌癥干細胞特性。
ALKBH5也參與免疫細胞代謝。DEAD-box(DDX)解旋酶招募ALKBH5去甲基化m6A標記的抗病毒轉(zhuǎn)錄本,抑制病毒感染后I型干擾素的產(chǎn)生。雙鏈DNA或人巨細胞病毒觸發(fā)的I型干擾素產(chǎn)生也受ALKBH5調(diào)控。此外,ALKBH5可以通過m6A去甲基化上調(diào)α-酮戊二酸脫氫酶(OGDH)mRNA,促進先天免疫反應非依賴性病毒復制。ALKBH5在T細胞激活時上調(diào),并能調(diào)控CD4+ T細胞在自身免疫中的致病性。此外,ALKBH5在塑造腫瘤微環(huán)境(TME)中起關鍵作用,主要抑制抗癌免疫。
基于FTO在癌癥中的機制研究和可用的晶體結(jié)構(gòu),已開發(fā)出多種小分子抑制劑(圖4c)。例如,2012年通過基于結(jié)構(gòu)的高通量篩選,發(fā)現(xiàn)了天然產(chǎn)物大黃素(rhein)作為FTO抑制劑,其在體外與FTO活性位點競爭性結(jié)合,Kd為2.4 μM。大黃素在白血病細胞中的IC50為21 μM,其對TKI耐藥細胞的應用可恢復對TKI的敏感性。MO-I-500是另一種FTO抑制劑,其通過模擬維生素C的結(jié)構(gòu)來誘導一大類Fe(II)-依賴和2-氧戊二酸(2OG)-依賴雙加氧酶的活性。MO-I-500在體外對純化的FTO的IC50為8.7 μM,并在三陰性乳腺癌細胞中抑制其增殖。盡管大黃素和MO-I-500缺乏對FTO的選擇性,但2OG類似物compound 12顯示出對FTO約30倍的選擇性,其在HeLa細胞中的應用導致mRNA m6A劑量依賴性增加。另一種天然致癌代謝產(chǎn)物R-2HG也顯示出對FTO的廣泛抗腫瘤效果。
通過基于結(jié)構(gòu)的虛擬篩選,發(fā)現(xiàn)了ALKBH5抑制劑。例如,通過基于晶體結(jié)構(gòu)的虛擬篩選,發(fā)現(xiàn)了化合物3和化合物6,它們在體外對ALKBH5的抑制作用分別為IC50=0.84 μM和1.79 μM。最近,通過高通量熒光偏振測定法揭示了一類新的ALKBH5抑制劑,具有1-芳基-1H-吡唑骨架,其中化合物20m顯示出對ALKBH5超過1000倍的選擇性,IC50為0.021 μM。
YTH結(jié)構(gòu)域蛋白作為m6A reader蛋白及其抑制劑
m6A調(diào)控在很大程度上依賴于其結(jié)合蛋白。研究最深入的reader蛋白YTS521-B同源(YTH)結(jié)構(gòu)域的家族蛋白YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2。這些蛋白通過識別和結(jié)合m6A修飾的RNA來調(diào)控m6A修飾RNA命運。YTHDF1促進其m6A靶標轉(zhuǎn)錄本翻譯,YTHDF1在多種患者腫瘤中表達升高,并與不良預后相關。YTHDF2結(jié)合m6A修飾的mRNA,招募CCR4-NOT去腺苷酸酶復合體,并定位于RNA處理體以促進mRNA降解。YTHDF3可以調(diào)控m6A修飾RNA的翻譯和降解。
YTHDC1和YTHDC2是定位于細胞核的m6A“reader”蛋白。YTHDC1通過與剪切和出核因子SRSF3的互作調(diào)控pre-mRNA剪切和出核,其功能與多種疾病相關。YTHDC2調(diào)控m6A修飾RNA的翻譯和降解,并在調(diào)控精子發(fā)生中的有絲分裂到減數(shù)分裂的轉(zhuǎn)換中發(fā)揮作用。
非選擇性YTHDF抑制劑ebselen(圖4e)通過監(jiān)測化合物對YTH結(jié)構(gòu)域色氨酸熒光猝滅效應發(fā)現(xiàn)。Salvianolic acid C是首個YTHDF1靶向抑制劑,其與YTHDF1的結(jié)合親和力(Kd)為5-6μM。DC-Y13-27(圖4e)是通過篩選發(fā)現(xiàn)的YTHDF2抑制劑,其IC50為21.8 μM。這些抑制劑通過影響YTHDF家族蛋白的功能來調(diào)控m6A修飾RNA命運。
IGF2BP1、IGF2BP2和IGF2BP3是另一種m6A結(jié)合蛋白家族。這些蛋白通過穩(wěn)定m6A修飾RNA并促進其翻譯來發(fā)揮功能。例如,BTYNB是IGF2BP1的抑制劑,其通過阻止IGF2BP1與MYC mRNA的結(jié)合來抑制黑色素瘤和卵巢癌細胞增殖。CWI1-2是IGF2BP2的抑制劑,其通過阻止IGF2BP2與RNA的結(jié)合來抑制AML細胞增殖。
m7G的分布與功能
m7G修飾存在于各種RNA種類中,包括tRNA、mRNA和核糖體RNA(rRNA;表1)。在tRNA中,m7G甲基化高度保守,通常位于第46位。m7G與相鄰核苷酸相互作用產(chǎn)生正電荷并穩(wěn)定tRNA結(jié)構(gòu)以減少核糖體暫停,從而維持翻譯效率。在mRNA上,m7G在mRNA 5'端加帽過程中沉積,隨后m7G與帽結(jié)合復合體和翻譯起始因子eIF4E互作促進RNA剪切、出核和翻譯。哺乳動物RNA也可以有內(nèi)部m7G修飾,以帽m7G獨立機制調(diào)控翻譯。RBP quaking 7(QKI-7)已被表征為內(nèi)部m7G的reader蛋白之一。過表達QKI-7促進化療應激期間m7G標記mRNA在應激顆粒中的定位,并使癌細胞對阿霉素治療敏感。在miRNA上,內(nèi)部m7G修飾通過防止二級結(jié)構(gòu)促進miRNA加工。
m7G修飾的調(diào)控蛋白
在人類細胞中,METTL1及其輔助因子WD重復域4(WDR4)形成催化tRNA和某些mRNA上m7G的甲基轉(zhuǎn)移酶復合體。METTL1和WDR4通過增加tRNA m7G甲基化和tRNA豐度來驅(qū)動腫瘤進展。例如,在肝細胞癌(HCC)中,WDR4通過增加tRNA m7G甲基化和促進CCNB1轉(zhuǎn)錄本的翻譯來促進PI3K和AKT磷酸化以及P53的泛素化和降解。
高METTL1表達水平與癌癥患者的不良生存相關,敲低各種癌細胞系中的METTL1抑制細胞生長和腫瘤發(fā)生。Arg-TCT RNA和METTL1在AML和膠質(zhì)母細胞瘤細胞中都表現(xiàn)出致癌作用。METTL1通過tRNA m7G調(diào)控mRNA技術的致癌作用也在肺癌、頭頸部鱗狀細胞癌和肝癌中有報道。
METTL1也可能通過miRNA上的m7G修飾以調(diào)控加工,從而發(fā)揮腫瘤抑制作用,如一項肺癌的研究結(jié)果表明不同RNA種類上的m7G可能具有不同效應。METTL1過表達可以使腫瘤細胞對順鉑治療敏感。
m7G修飾的抑制劑
METTL1和WDR4的致癌作用使它們成為癌癥的潛在治療靶點,但目前尚無靶向METTL1或WDR4的抑制劑。設計靶向METTL1-SAM結(jié)合口袋關鍵殘基的小分子作為未來的研究方向,可能顯示出抑制效果,但需要具有選擇性以避免抑制其它基于SAM的酶。或者設計破壞METTL1-WDR4相互作用的抑制劑,以METTL1-WDR4復合物的晶體結(jié)構(gòu)為指導。在METTL1抑制對疾病結(jié)果不利的情況下,鑒定m7G結(jié)合蛋白可能揭示更多治療靶點。
5-甲基胞嘧啶(m5C)
m5C的分布與功能
m5C修飾廣泛存在于各種RNA種類中,包括mRNA、tRNA、rRNA、長鏈非編碼(lncRNA)和miRNA(表1)。NSUN家族蛋白和TRDMT1是m5C修飾的甲基轉(zhuǎn)移酶,這些修飾可增加tRNA和mRNA的穩(wěn)定性,調(diào)控蛋白合成。具體而言,NSUN2、NSUN6和TRDMT1甲基化tRNA m5C,調(diào)控密碼子識別從而調(diào)控蛋白合成。在rRNA中,m5C修飾的NSUN1和NSUN5對三級結(jié)構(gòu)和核糖體生物發(fā)生很重要。NSUN2、NSUN3和NSUN4介導的線粒體m5C RNA甲基化調(diào)控線粒體翻譯。mRNA在編碼序列中有豐富的m5C修飾,阻礙翻譯效率但增強mRNA從細胞核到細胞質(zhì)的出核。
m5C修飾的調(diào)控蛋白
NSUN2是研究最為廣泛的m5C甲基轉(zhuǎn)移酶。NSUN2表達和tRNA、mRNA和lncRNA上的m5C修飾在多種癌癥中上調(diào),并與不良預后相關。例如,在HCC細胞中,NSUN2高表達通過穩(wěn)定H19 lncRNA來促進腫瘤進展。已顯示其具有致癌功能。沉默NSUN2降低了RNA m5C總豐度并抑制HCC細胞的增殖、遷移和侵襲。由于其在甲基化tRNA中的活性,功能NSUN2的缺乏也導致tRNA不穩(wěn)定,并與智力障礙和細胞對應激反應的敏感化相關。
甲基轉(zhuǎn)移酶TRDMT1催化tRNA m5C甲基化,并在DNA損傷位點促進RNA在DNA:RNA雜合體上的甲基化。這些甲基化位點被m5C reader蛋白RAD52結(jié)合以啟動同源重組DNA修復通路。抑制TRDMT1-RAD52軸誘導凋亡,并使癌細胞對放療和PARP抑制劑敏感。靶向TRDMT1可以為同源重組缺陷癌癥提供替代治療策略。
除了RAD52和FMRP,m5C還被兩種reader蛋白ALYREF和YBX1富集。ALYREF結(jié)合mRNA m5C并促進其靶標的出核。它在HCC、膀胱癌、神經(jīng)母細胞瘤和膠質(zhì)母細胞瘤中高表達。在這些癌組織中,ALYREF似乎穩(wěn)定并維持甲基化致癌轉(zhuǎn)錄本如MYC和PKM2表達,敲低ALYREF抑制膠質(zhì)母細胞瘤細胞生長和體內(nèi)腫瘤形成。靶向ALYREF的小分子可能對各種癌癥,特別是MYC驅(qū)動的癌癥具有臨床價值。在病毒感染中,ALYREF出核m5C甲基化病毒RNA并增加逆轉(zhuǎn)錄病毒復制。因此,ALYREF抑制劑也可能具有阻礙病毒感染的潛力。
YBX1是另一種m5C結(jié)合蛋白,在膀胱癌中高度表達,且與膀胱癌進展呈正相關。YBX1通過招募RNA穩(wěn)定劑ELAVL1來穩(wěn)定m5C高度甲基化的致癌轉(zhuǎn)錄本HDGF促進腫瘤發(fā)生。
m5C修飾蛋白的臨床靶向潛力
由于NSUN2在多種癌癥中的表達上調(diào)和其對腫瘤進展的促進作用,使其成為潛在的治療靶點。然而,目前尚未有靶向NSUN2的抑制劑被開發(fā)出來。此外,TRDMT1在DNA損傷修復以及癌癥治療中的潛在作用也為其作為治療靶點提供了理論依據(jù),尤其是在同源重組缺陷型癌癥中,但目前同樣缺乏靶向TRDMT1的特異性抑制劑。
N1 -甲基腺苷(m1A)
m1A修飾的存在及其作用
m1A修飾存在于tRNA、mRNA、rRNA和lncRNA中(表1),其在tRNA上的存在有助于維持tRNA穩(wěn)定性以及調(diào)控翻譯的起始和延伸過程。在mRNA上,m1A修飾主要富集在5′非翻譯區(qū)(5′UTR),與替代翻譯起始位點相關。
m1A修飾酶及其與癌癥的關聯(lián)
TRMT6-TRMT61A復合體、TRMT61B以及TRMT10C是以各種RNA為底物的m1A甲基轉(zhuǎn)移酶(writers)。TRMT6、TRMT61A或TRMT61B的高表達與膠質(zhì)瘤患者的不良預后相關。此外,在肝細胞癌(HCC)中也觀察到TRMT6和TRMT61A mRNA的高表達以及m1A豐度增加。
具體而言,TRMT6-TRMT61A對PPARG mRNA的m1A58修飾確保其適當翻譯,PPARG調(diào)控膽固醇生物合成并激活Hedgehog信號。抑制TRMT6-TRMT61A通過調(diào)控PPARG翻譯抑制HCC腫瘤發(fā)生。
目前已鑒定出幾種m1A去甲基化酶(erasers),其中研究最多的是ALKBH1酶,在大多數(shù)tRNA中去甲基化m1A58。這種m1A58去甲基化導致起始甲硫氨酸t(yī)RNA降解,ALKBH1缺失增加起始甲硫氨酸t(yī)RNA穩(wěn)定性和翻譯效率。ALKBH1在患病組織中異常表達,但尚未深入研究其機制。在胰腺癌患者中,ALKBH1基因表達水平與不良預后呈負相關。ALKBH1表達水平也與心血管疾病相關;然而,這種關聯(lián)是否是m1A依賴的尚不清楚。
ALKBH3去甲基化DNA和RNA上的m1A,對rRNA、tRNA和mRNA有活性。由于ALKBH3缺失導致的tRNA上m1A積累減少了蛋白合成。敲低ALKBH3也抑制癌細胞增殖。在卵巢癌和乳腺癌中,ALKBH3水平升高,該蛋白去甲基化細胞因子CSF-1的mRNA。結(jié)果,CSF-1 mRNA的半衰期延長,CSF-1蛋白水平升高促進轉(zhuǎn)移和侵襲。ALKBH1和ALKBH3水平與膠質(zhì)瘤患者的不良生存相關。
總體而言,m1A依賴性RNA調(diào)控在細胞過程和疾病發(fā)病機制中具有作用,表明靶向m1A甲基化酶和去甲基化酶的潛力。未來開發(fā)靶向這些酶的選擇性和強效小分子抑制劑將能夠在各種治療領域驗證這些假設。
m1A相關抑制劑的應用前景
在篩選破壞TRMT6-TRMT61A復合物形成的抑制劑時,鑒定出抗菌藥物四甲基秋蘭姆二硫化物(thiram)(圖4g)。thiram抑制肝臟腫瘤生長并特異性降低m1A豐度,證明靶向m1A writers酶用于癌癥治療的潛力。
假尿苷(Ψ)
Ψ分布與功能
Ψ是尿苷的異構(gòu)體,是第一個被發(fā)現(xiàn)的RNA修飾,也是最豐富的RNA修飾。Ψ廣泛存在于rRNA和tRNA中(表1)。雖然豐度較低,Ψ也存在于其它RNA種類中,包括miRNA和mRNA。rRNA上的假尿苷主要分布在核糖體的功能區(qū)域,如肽酰轉(zhuǎn)移酶中心、解碼區(qū)域等。這些位點假尿苷的缺失會干擾翻譯或核糖體生物發(fā)生。tRNA和mRNA上的Ψ同樣調(diào)控翻譯。高度保守的tRNA假尿苷化,以及在反密碼子莖和環(huán)區(qū)域,調(diào)控與密碼子的堿基配對。mRNA終止密碼子UAA、UAG或UGA的假尿苷化導致終止密碼子通讀。snRNA中的假尿苷可以調(diào)控剪切。
Ψ修飾與疾病關聯(lián)
假尿苷化可以直接由假尿苷合成酶(PUS)酶催化,或由DKC1催化,DKC1由具有H/ACA motif的snoRNA引導。mRNA的假尿苷化在熱休克和應激反應中動態(tài)調(diào)控,但疾病刺激是否導致不同的假尿苷模式需要進一步研究。然而,研究支持修飾失調(diào)與疾病相關的觀點。
假尿苷化被認為與癌癥的發(fā)生和發(fā)展有關,如與MYC表達水平相關的snoRNA SCARNA15表達,其通過引導假尿苷化調(diào)控腫瘤抑制基因剪切和癌細胞生長。
Ψ修飾酶的抑制與治療潛力
通過監(jiān)測假尿苷水平,鑒定出小分子C17作為PUS7催化活性的抑制劑,C17能在納摩爾濃度下抑制膠質(zhì)母細胞瘤干細胞(GSC)的生長,并在小鼠中抑制腫瘤生長,這表明靶向PUS酶的抑制劑開發(fā)對于癌癥治療具有潛在的應用價值。
2′-O-甲基化(Nm)
Nm修飾分布及功能
Nm表示對任何一種核糖核苷酸的2′-羥基的甲基化,存在于tRNA、rRNA、snRNA、小非編碼RNA和mRNA中(表1)。與核堿基修飾不同,Nm不直接干擾Watson-Crick堿基配對。然而,Nm修飾保護RNA免受核酸酶活性,增強RNA-RNA互作,破壞RNA-蛋白質(zhì)互作并干擾RNA三級結(jié)構(gòu)。因此,Nm對調(diào)控RNA穩(wěn)定性、翻譯和剪切非常重要。
Nm修飾與疾病關聯(lián)
FTSJ1編碼的tRNA Nm甲基轉(zhuǎn)移酶與X連鎖智力障礙有關,而FBL(Fibrillarin)這種在rRNA甲基化中起作用的甲基轉(zhuǎn)移酶在多種癌癥中過表達,可能有助于腫瘤細胞的生長。
Nm修飾在區(qū)分自身和非自身轉(zhuǎn)錄本方面也起著重要的作用,例如,在mRNA生物合成過程中,由CMTR1和CMTR2這兩個帽子甲基轉(zhuǎn)移酶依次進行的Nm修飾能夠防止先天免疫反應對自身RNA的攻擊。
Nm修飾相關抑制劑的開發(fā)
盡管Nm修飾在多種疾病中具有重要意義,然而,靶向調(diào)控Nm修飾蛋白的抑制劑的開發(fā)仍然有限。開發(fā)具有選擇性的抑制劑有望為智力障礙、癌癥和病毒感染等疾病的治療提供新的應用方向。
機遇與挑戰(zhàn)
目前,越來越多的證據(jù)表明,模式生物上的多種RNA修飾在各類疾病中均具有顯著作用,這些發(fā)現(xiàn)為治療靶點開辟了一個新的道路,m6A修飾通路在癌癥中的作用及其在腫瘤微環(huán)境(TME)中的調(diào)控作用表明,其可能具有抗腫瘤益處,且有一定概率改善癌癥治療的效果,尤其是針對治療的耐藥性方面。
干細胞治療是另一個可能從抑制m6A效應蛋白的藥物中受益的領域,m6A修飾通過影響YTHDF2對轉(zhuǎn)錄本的快速降解來調(diào)控干細胞的自我更新和分化,靶向m6A通路可能為克服治療用干細胞擴增提供機會。
盡管RNA修飾作為治療靶點具有巨大潛力,但在將研究得出的小分子藥物應用于臨床仍面臨挑戰(zhàn),例如,靶向RNA修飾蛋白的小分子藥物可能需要在特定的時間窗口內(nèi)給藥,原因是RNA修飾的功能高度依賴于給藥背景。此外,RNA修飾和RNA結(jié)合蛋白通常具有相似的催化結(jié)構(gòu)域或結(jié)合口袋,這使得開發(fā)特異性抑制劑變得具有挑戰(zhàn)性,在設計小分子時需要考慮如何實現(xiàn)對特定底物結(jié)合域的干擾,以實現(xiàn)特異性抑制。
RNA治療領域的進展表明,了解不同RNA修飾功能可以對合成RNA分子進行加工,以實現(xiàn)某些化學和生物學特性。例如,包括m6A、Ψ、m5C和mRNA 5′端帽子上的m7G等在內(nèi)的多種RNA修飾可以減輕免疫原性,同時增加翻譯效率,這些RNA修飾的發(fā)現(xiàn)為RNA治療藥物的開發(fā)和優(yōu)化提供了重要的指導。
參考文獻:
Zhang L, Wei J, Zou Z, He C. RNA modification systems as therapeutic targets. Nat Rev Drug Discov. 2025 Sep 17. doi: 10.1038/s41573-025-01280-8.

RNA修飾、調(diào)控蛋白及分子功能
在眾多RNA修飾中,N6-甲基腺苷(N6-methyladenosine, m6A)、N7-甲基鳥苷(N7-methylguanosine, m7G)、5-甲基胞苷(5-methylcytosine, m5C) 、N1-甲基腺苷(N1-methyladenosine, m1A)、假尿苷(Ψ)和2'-O-甲基化(2'-O-methylation, Nm)是調(diào)控基因表達和細胞生物學過程的關鍵化學標記。與表觀基因組修飾類似,RNA修飾在不改變DNA或RNA序列的情況下對基因表達存在關鍵作用。
RNA修飾可以在共轉(zhuǎn)錄或轉(zhuǎn)錄后添加,導致RNA結(jié)構(gòu)、加工、翻譯及降解的改變(表1)。這些功能由識別并結(jié)合修飾的RNA結(jié)合蛋白(RBPs,"readers")介導。除了RNA代謝和翻譯,RNA修飾還可以調(diào)控RNA:DNA雜合體形成,參與影響全局染色質(zhì)狀態(tài)和轉(zhuǎn)錄。
此外,基于RNA修飾作用的多種關鍵生物通路與疾病的關聯(lián)正在逐步解析,如RNA修飾調(diào)控癌癥中的致癌通路,STM2457是第一個設計用于抑制RNA修飾酶催化活性的小分子,它能抑制m6A writer酶METTL3,在抑制急性髓性白血病(AML)小鼠模型中植入和擴增,成功證明了靶向RNA修飾酶治療癌癥的潛力。這項研究開發(fā)的首個影響RNA修飾酶的候選藥物已進入臨床試驗。令人意外的,一些已獲批的藥物也被發(fā)現(xiàn)是RNA修飾的有效調(diào)控劑,如帕金森病藥物安托卡朋(antecapone)被發(fā)現(xiàn)能抑制m6A去甲基酶FTO。綜上,這些進展突顯了靶向RNA修飾治療疾病的潛力。

表1:RNA修飾、調(diào)控蛋白及分子功能
N6-甲基腺苷(m6A))
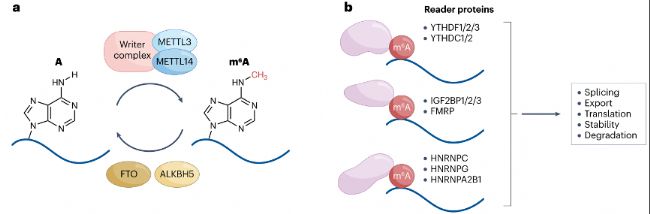
m6A是哺乳動物中最豐富的RNA修飾。平均每個哺乳動物轉(zhuǎn)錄本有三個m6A修飾,位于RRm6ACH(R=A/G;H=A/C/U)的共有序列中。m6A甲基化盡管發(fā)生在mRNA的各個區(qū)域,但在3'非翻譯區(qū)(UTR)和靠近終止密碼子處富集。m6A甲基化由"甲基轉(zhuǎn)移酶(writers)"METTL3和METTL14沉積,可被"去甲基化酶(erasers)"FTO和ALKBH5去除。m6A修飾的RNA通過與RNA結(jié)合蛋白來調(diào)控RNA代謝,包括加工、運輸、翻譯及穩(wěn)定性(圖1),這些調(diào)控功能已在多種生物系統(tǒng)中得到了廣泛研究,m6A調(diào)控多種過程,如干細胞分化、組織發(fā)育、信號通路、應激反應、神經(jīng)功能、病毒感染和代謝等,m6A失調(diào)與癌癥、免疫穩(wěn)態(tài)、代謝疾病和神經(jīng)紊亂相關。

圖1:m6A修飾及其調(diào)控蛋白。
- RNA m6A)甲基化由包含METTL3和METTL14的m6A“writers”復合體催化,且可被erasers蛋白FTO和ALKBH5去除。
- m6A修飾可被細胞核和細胞質(zhì)中的選擇性結(jié)合蛋白(“readers”)識別,包括YTHDF1/2/3、YTHDC1/2、IGF2BP1/2/3和FMRP。HNRNPA2B1、HNRNPC和HNRNPG可識別并結(jié)合因m6A甲基化而二級結(jié)構(gòu)弱化的RNA區(qū)域。通過這些reader蛋白,m6A修飾可調(diào)控RNA加工和代謝的諸多方面。
METTL3、METTL14和調(diào)控亞基WTAP是沉積m6A的主要RNA甲基轉(zhuǎn)移酶"writers"復合體的關鍵組分,其中METTL3和METTL14形成核心穩(wěn)定的異源二聚體。METTL3表現(xiàn)出催化活性并結(jié)合甲基供體S-腺苷甲硫氨酸(SAM),而METTL14穩(wěn)定甲基轉(zhuǎn)移酶復合物以促進RNA結(jié)合和甲基化。
m6A mRNA甲基化可通過影響RNA翻譯和穩(wěn)定性影響許多致癌通路(圖2)。例如,約1.5%的子宮內(nèi)膜癌患者在METTL14中有R298P突變殘基,與鄰近正常組織相比,大部分子宮內(nèi)膜癌中METTL3下調(diào),導致m6A甲基化水平低。由此導致的PHLPP2 mRNA低甲基化降低了這種AKT激酶負調(diào)控因子的翻譯,而對mTORC2組分編碼mRNA的低甲基化抑制了mRNA衰變并增加mTORC2表達。結(jié)果,AKT通路被激活,刺激子宮內(nèi)膜癌的增殖和腫瘤發(fā)生。METTL14的純合R298P突變將其基序偏好從[G/A][G/A]ACU轉(zhuǎn)變?yōu)镚l[A][C/U]U。雖然METTL14變化確實導致mRNA整體甲基化減少,但在非經(jīng)典位點觀察到m6A甲基化增加。
p53通路也受m6A調(diào)控(圖2b)。METTL3-METTL14復合體甲基化編碼p53抑制因子MDM2的mRNA。METTL3和METTL14在AML中表達均升高。與健康個體相比,AML患者中MDM2 mRNA高度甲基化,增加了MDM2蛋白表達并抑制p53信號。METTL3還與MDM2競爭p53結(jié)合,從而穩(wěn)定p53。p53與METTL3互作促進METTL3介導的m6A甲基化,進而形成正反饋回路。
此外,調(diào)控m6A修飾或許能成為抗感染、調(diào)控免疫反應以及增強免疫治療效果的新策略(圖3)。

圖2:受m6A調(diào)控的信號通路。
- m6A修飾通過多種機制調(diào)控AKT通路,進而影響細胞增殖與分化。在子宮內(nèi)膜癌中,因METTL14突變或METTL3表達下調(diào),PHLPP2轉(zhuǎn)錄本以及編碼mTORC2組分的轉(zhuǎn)錄本上m6A水平降低,導致PHLPP2翻譯減少,mTORC2組分轉(zhuǎn)錄本穩(wěn)定性增加,從而激活AKT信號通路。在急性髓性白血病(acute myelogenous leukemia,AML)中,METTL3表達升高使PTEN mRNA m6A甲基化增加,促進其轉(zhuǎn)錄本翻譯。PTEN表達升高抑制AKT信號通路,導致細胞存活與增殖。
- METTL3在調(diào)控p53通路中發(fā)揮相反作用。它使編碼E3泛素連接酶MDM2(p53的負向調(diào)控因子)的轉(zhuǎn)錄本發(fā)生甲基化。MDM2 mRNA的甲基化提高其翻譯效率,抑制p53信號通路,進而抑制細胞分化與凋亡。METTL3還與MDM2競爭p53結(jié)合位點,從而促進p53信號通路及其抑癌功能。
- 在JAK - STAT通路中,SOCS2、JAK1和STAT1的轉(zhuǎn)錄本受m6A甲基化調(diào)控。在肝癌細胞中,編碼JAK負向調(diào)控因子SOCS2的轉(zhuǎn)錄本發(fā)生甲基化,加速mRNA降解,激活JAK信號通路以支持細胞增殖。JAK1和STAT1 mRNA甲基化促進這些轉(zhuǎn)錄本降解,抑制JAK-STAT信號通路,導致細胞分化減少與細胞因子應答降低。

圖3:靶向RNA修飾的潛在治療應用。靶向RNA修飾效應蛋白具有極具前景的臨床價值。
- m6A甲基化及其效應蛋白(包括METTL3、METTL14、ALKBH5、YTHDF1和YTHDF2)已被報道有助于調(diào)控免疫細胞功能并維持穩(wěn)態(tài),且在自身免疫疾病中發(fā)生改變。
- 多種RNA修飾及其相應的效應蛋白參與對病毒感染的免疫反應。例如YTHDF3抑制抗病毒免疫反應并促進病毒感染。抑制YTHDF3可能是傳統(tǒng)抗病毒藥物的替代選擇。
- 靶向RNA修飾可能會使腫瘤對抗PD-1或抗PD-L1免疫治療具有高靈敏度。例如與YTHDF2抑制劑聯(lián)合使用可增強放療和抗PD - L1治療的療效。
- 調(diào)控m6A效應蛋白可能會使癌細胞對化療藥物高靈敏度。例如使用FTO抑制劑可能會使白血病細胞對酪氨酸激酶抑制劑(TKIs)敏感并克服藥物耐受性,提供比單獨TKI治療更好的療效。
- m6A甲基化效應蛋白如METTL3/14和YTHDF2,可能有助于在干細胞治療應用過程中維持干細胞的干性或促進其分化。靶向YTHDF2或相關因子的抑制劑可能會促進干細胞擴增,同時將惡性轉(zhuǎn)化的風險降至最低。
- YTHDF蛋白連同結(jié)合的RNA能夠形成與神經(jīng)性疾病相關的相分離凝聚體。靶向YTHDF蛋白可能會抑制凝聚體形成,從而利于疾病治療。

圖4:靶向RNA修飾“writer”、“eraser”和“reader”蛋白的抑制劑。
- 抑制METTL3的化合物。
- 激活m6A甲基轉(zhuǎn)移酶復合體的化合物。
- 抑制FTO的化合物。
- 抑制ALKBH5的化合物。
- 抑制YTHDF蛋白的化合物。
- 抑制IGF2BP蛋白的化合物。
- 靶向TRMT6/61A復合體的抑制劑。
FTO(肥胖相關基因,fat-mass and obesity-associated gene)和ALKBH5(AlkB同源蛋白5)是m6A去甲基化酶,能去除mRNA上的m6A修飾。FTO在多種癌癥中過表達,包括AML、膠質(zhì)母細胞瘤和乳腺癌,與不良預后相關。FTO通過去甲基化致癌轉(zhuǎn)錄本如MYC、BCL2和CEBPA促進腫瘤發(fā)生。ALKBH5在缺氧條件下被誘導,在膠質(zhì)母細胞瘤干細胞、AML和乳腺癌中高表達,通過調(diào)控NANOG等干細胞因子維持癌癥干細胞特性。
ALKBH5也參與免疫細胞代謝。DEAD-box(DDX)解旋酶招募ALKBH5去甲基化m6A標記的抗病毒轉(zhuǎn)錄本,抑制病毒感染后I型干擾素的產(chǎn)生。雙鏈DNA或人巨細胞病毒觸發(fā)的I型干擾素產(chǎn)生也受ALKBH5調(diào)控。此外,ALKBH5可以通過m6A去甲基化上調(diào)α-酮戊二酸脫氫酶(OGDH)mRNA,促進先天免疫反應非依賴性病毒復制。ALKBH5在T細胞激活時上調(diào),并能調(diào)控CD4+ T細胞在自身免疫中的致病性。此外,ALKBH5在塑造腫瘤微環(huán)境(TME)中起關鍵作用,主要抑制抗癌免疫。
基于FTO在癌癥中的機制研究和可用的晶體結(jié)構(gòu),已開發(fā)出多種小分子抑制劑(圖4c)。例如,2012年通過基于結(jié)構(gòu)的高通量篩選,發(fā)現(xiàn)了天然產(chǎn)物大黃素(rhein)作為FTO抑制劑,其在體外與FTO活性位點競爭性結(jié)合,Kd為2.4 μM。大黃素在白血病細胞中的IC50為21 μM,其對TKI耐藥細胞的應用可恢復對TKI的敏感性。MO-I-500是另一種FTO抑制劑,其通過模擬維生素C的結(jié)構(gòu)來誘導一大類Fe(II)-依賴和2-氧戊二酸(2OG)-依賴雙加氧酶的活性。MO-I-500在體外對純化的FTO的IC50為8.7 μM,并在三陰性乳腺癌細胞中抑制其增殖。盡管大黃素和MO-I-500缺乏對FTO的選擇性,但2OG類似物compound 12顯示出對FTO約30倍的選擇性,其在HeLa細胞中的應用導致mRNA m6A劑量依賴性增加。另一種天然致癌代謝產(chǎn)物R-2HG也顯示出對FTO的廣泛抗腫瘤效果。
通過基于結(jié)構(gòu)的虛擬篩選,發(fā)現(xiàn)了ALKBH5抑制劑。例如,通過基于晶體結(jié)構(gòu)的虛擬篩選,發(fā)現(xiàn)了化合物3和化合物6,它們在體外對ALKBH5的抑制作用分別為IC50=0.84 μM和1.79 μM。最近,通過高通量熒光偏振測定法揭示了一類新的ALKBH5抑制劑,具有1-芳基-1H-吡唑骨架,其中化合物20m顯示出對ALKBH5超過1000倍的選擇性,IC50為0.021 μM。
YTH結(jié)構(gòu)域蛋白作為m6A reader蛋白及其抑制劑
m6A調(diào)控在很大程度上依賴于其結(jié)合蛋白。研究最深入的reader蛋白YTS521-B同源(YTH)結(jié)構(gòu)域的家族蛋白YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2。這些蛋白通過識別和結(jié)合m6A修飾的RNA來調(diào)控m6A修飾RNA命運。YTHDF1促進其m6A靶標轉(zhuǎn)錄本翻譯,YTHDF1在多種患者腫瘤中表達升高,并與不良預后相關。YTHDF2結(jié)合m6A修飾的mRNA,招募CCR4-NOT去腺苷酸酶復合體,并定位于RNA處理體以促進mRNA降解。YTHDF3可以調(diào)控m6A修飾RNA的翻譯和降解。
YTHDC1和YTHDC2是定位于細胞核的m6A“reader”蛋白。YTHDC1通過與剪切和出核因子SRSF3的互作調(diào)控pre-mRNA剪切和出核,其功能與多種疾病相關。YTHDC2調(diào)控m6A修飾RNA的翻譯和降解,并在調(diào)控精子發(fā)生中的有絲分裂到減數(shù)分裂的轉(zhuǎn)換中發(fā)揮作用。
非選擇性YTHDF抑制劑ebselen(圖4e)通過監(jiān)測化合物對YTH結(jié)構(gòu)域色氨酸熒光猝滅效應發(fā)現(xiàn)。Salvianolic acid C是首個YTHDF1靶向抑制劑,其與YTHDF1的結(jié)合親和力(Kd)為5-6μM。DC-Y13-27(圖4e)是通過篩選發(fā)現(xiàn)的YTHDF2抑制劑,其IC50為21.8 μM。這些抑制劑通過影響YTHDF家族蛋白的功能來調(diào)控m6A修飾RNA命運。
IGF2BP1、IGF2BP2和IGF2BP3是另一種m6A結(jié)合蛋白家族。這些蛋白通過穩(wěn)定m6A修飾RNA并促進其翻譯來發(fā)揮功能。例如,BTYNB是IGF2BP1的抑制劑,其通過阻止IGF2BP1與MYC mRNA的結(jié)合來抑制黑色素瘤和卵巢癌細胞增殖。CWI1-2是IGF2BP2的抑制劑,其通過阻止IGF2BP2與RNA的結(jié)合來抑制AML細胞增殖。

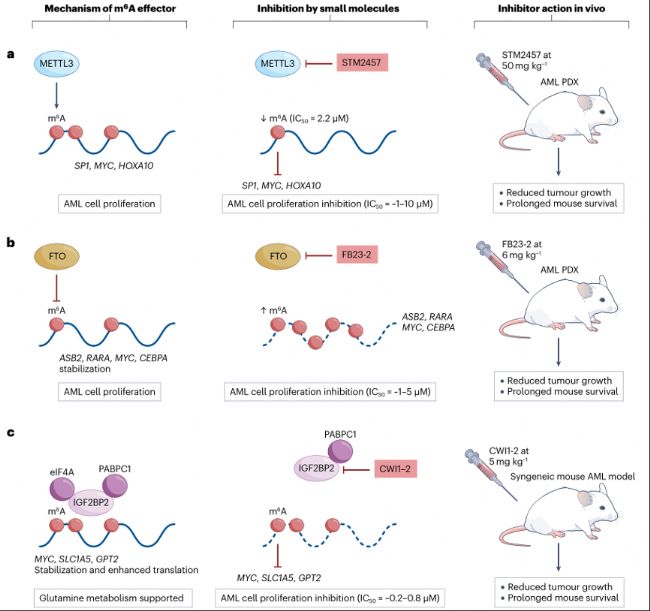
圖5:靶向m6A“writer”、“eraser”和“reader”蛋白的抑制劑可抑制小鼠AML。
- m6A“writer”METTL3可修飾SP1、MYC和HOXA10等轉(zhuǎn)錄本,促進其翻譯,從而支持急性髓系白血病(AML)細胞的存活與增殖。METTL3抑制劑STM2457能夠抑制這些轉(zhuǎn)錄本的甲基化,進而阻斷m6A介導的翻譯過程,抑制AML細胞的增殖。在患者來源異種移植(PDX)小鼠模型中,STM2457給藥可減少腫瘤生長,延長生存期。
- m6A“eraser”FTO可穩(wěn)定ASB2、RARA、MYC和CEBPA等轉(zhuǎn)錄本,從而促進AML細胞增殖。FTO抑制劑FB23-2可促進轉(zhuǎn)錄本上m6A積累,導致轉(zhuǎn)錄本降解。在小鼠PDX模型中,F(xiàn)B23-2給藥可減少腫瘤生長,延長生存期。
- m6A“reader”IGF2BP2可穩(wěn)定轉(zhuǎn)錄本并促進翻譯,以支持AML中的谷氨酰胺代謝。抑制劑CWI1-2可阻止IGF2BP2與RNA結(jié)合,減少其對致癌轉(zhuǎn)錄本的穩(wěn)定作用。在攜帶小鼠AML細胞系C1498的二次骨髓移植同種異體小鼠模型中,CWI1-2可減少腫瘤生長,延長生存期。
m7G的分布與功能
m7G修飾存在于各種RNA種類中,包括tRNA、mRNA和核糖體RNA(rRNA;表1)。在tRNA中,m7G甲基化高度保守,通常位于第46位。m7G與相鄰核苷酸相互作用產(chǎn)生正電荷并穩(wěn)定tRNA結(jié)構(gòu)以減少核糖體暫停,從而維持翻譯效率。在mRNA上,m7G在mRNA 5'端加帽過程中沉積,隨后m7G與帽結(jié)合復合體和翻譯起始因子eIF4E互作促進RNA剪切、出核和翻譯。哺乳動物RNA也可以有內(nèi)部m7G修飾,以帽m7G獨立機制調(diào)控翻譯。RBP quaking 7(QKI-7)已被表征為內(nèi)部m7G的reader蛋白之一。過表達QKI-7促進化療應激期間m7G標記mRNA在應激顆粒中的定位,并使癌細胞對阿霉素治療敏感。在miRNA上,內(nèi)部m7G修飾通過防止二級結(jié)構(gòu)促進miRNA加工。
m7G修飾的調(diào)控蛋白
在人類細胞中,METTL1及其輔助因子WD重復域4(WDR4)形成催化tRNA和某些mRNA上m7G的甲基轉(zhuǎn)移酶復合體。METTL1和WDR4通過增加tRNA m7G甲基化和tRNA豐度來驅(qū)動腫瘤進展。例如,在肝細胞癌(HCC)中,WDR4通過增加tRNA m7G甲基化和促進CCNB1轉(zhuǎn)錄本的翻譯來促進PI3K和AKT磷酸化以及P53的泛素化和降解。
高METTL1表達水平與癌癥患者的不良生存相關,敲低各種癌細胞系中的METTL1抑制細胞生長和腫瘤發(fā)生。Arg-TCT RNA和METTL1在AML和膠質(zhì)母細胞瘤細胞中都表現(xiàn)出致癌作用。METTL1通過tRNA m7G調(diào)控mRNA技術的致癌作用也在肺癌、頭頸部鱗狀細胞癌和肝癌中有報道。
METTL1也可能通過miRNA上的m7G修飾以調(diào)控加工,從而發(fā)揮腫瘤抑制作用,如一項肺癌的研究結(jié)果表明不同RNA種類上的m7G可能具有不同效應。METTL1過表達可以使腫瘤細胞對順鉑治療敏感。
m7G修飾的抑制劑
METTL1和WDR4的致癌作用使它們成為癌癥的潛在治療靶點,但目前尚無靶向METTL1或WDR4的抑制劑。設計靶向METTL1-SAM結(jié)合口袋關鍵殘基的小分子作為未來的研究方向,可能顯示出抑制效果,但需要具有選擇性以避免抑制其它基于SAM的酶。或者設計破壞METTL1-WDR4相互作用的抑制劑,以METTL1-WDR4復合物的晶體結(jié)構(gòu)為指導。在METTL1抑制對疾病結(jié)果不利的情況下,鑒定m7G結(jié)合蛋白可能揭示更多治療靶點。
5-甲基胞嘧啶(m5C)
m5C的分布與功能
m5C修飾廣泛存在于各種RNA種類中,包括mRNA、tRNA、rRNA、長鏈非編碼(lncRNA)和miRNA(表1)。NSUN家族蛋白和TRDMT1是m5C修飾的甲基轉(zhuǎn)移酶,這些修飾可增加tRNA和mRNA的穩(wěn)定性,調(diào)控蛋白合成。具體而言,NSUN2、NSUN6和TRDMT1甲基化tRNA m5C,調(diào)控密碼子識別從而調(diào)控蛋白合成。在rRNA中,m5C修飾的NSUN1和NSUN5對三級結(jié)構(gòu)和核糖體生物發(fā)生很重要。NSUN2、NSUN3和NSUN4介導的線粒體m5C RNA甲基化調(diào)控線粒體翻譯。mRNA在編碼序列中有豐富的m5C修飾,阻礙翻譯效率但增強mRNA從細胞核到細胞質(zhì)的出核。
m5C修飾的調(diào)控蛋白
NSUN2是研究最為廣泛的m5C甲基轉(zhuǎn)移酶。NSUN2表達和tRNA、mRNA和lncRNA上的m5C修飾在多種癌癥中上調(diào),并與不良預后相關。例如,在HCC細胞中,NSUN2高表達通過穩(wěn)定H19 lncRNA來促進腫瘤進展。已顯示其具有致癌功能。沉默NSUN2降低了RNA m5C總豐度并抑制HCC細胞的增殖、遷移和侵襲。由于其在甲基化tRNA中的活性,功能NSUN2的缺乏也導致tRNA不穩(wěn)定,并與智力障礙和細胞對應激反應的敏感化相關。
甲基轉(zhuǎn)移酶TRDMT1催化tRNA m5C甲基化,并在DNA損傷位點促進RNA在DNA:RNA雜合體上的甲基化。這些甲基化位點被m5C reader蛋白RAD52結(jié)合以啟動同源重組DNA修復通路。抑制TRDMT1-RAD52軸誘導凋亡,并使癌細胞對放療和PARP抑制劑敏感。靶向TRDMT1可以為同源重組缺陷癌癥提供替代治療策略。
除了RAD52和FMRP,m5C還被兩種reader蛋白ALYREF和YBX1富集。ALYREF結(jié)合mRNA m5C并促進其靶標的出核。它在HCC、膀胱癌、神經(jīng)母細胞瘤和膠質(zhì)母細胞瘤中高表達。在這些癌組織中,ALYREF似乎穩(wěn)定并維持甲基化致癌轉(zhuǎn)錄本如MYC和PKM2表達,敲低ALYREF抑制膠質(zhì)母細胞瘤細胞生長和體內(nèi)腫瘤形成。靶向ALYREF的小分子可能對各種癌癥,特別是MYC驅(qū)動的癌癥具有臨床價值。在病毒感染中,ALYREF出核m5C甲基化病毒RNA并增加逆轉(zhuǎn)錄病毒復制。因此,ALYREF抑制劑也可能具有阻礙病毒感染的潛力。
YBX1是另一種m5C結(jié)合蛋白,在膀胱癌中高度表達,且與膀胱癌進展呈正相關。YBX1通過招募RNA穩(wěn)定劑ELAVL1來穩(wěn)定m5C高度甲基化的致癌轉(zhuǎn)錄本HDGF促進腫瘤發(fā)生。
m5C修飾蛋白的臨床靶向潛力
由于NSUN2在多種癌癥中的表達上調(diào)和其對腫瘤進展的促進作用,使其成為潛在的治療靶點。然而,目前尚未有靶向NSUN2的抑制劑被開發(fā)出來。此外,TRDMT1在DNA損傷修復以及癌癥治療中的潛在作用也為其作為治療靶點提供了理論依據(jù),尤其是在同源重組缺陷型癌癥中,但目前同樣缺乏靶向TRDMT1的特異性抑制劑。
N1 -甲基腺苷(m1A)
m1A修飾的存在及其作用
m1A修飾存在于tRNA、mRNA、rRNA和lncRNA中(表1),其在tRNA上的存在有助于維持tRNA穩(wěn)定性以及調(diào)控翻譯的起始和延伸過程。在mRNA上,m1A修飾主要富集在5′非翻譯區(qū)(5′UTR),與替代翻譯起始位點相關。
m1A修飾酶及其與癌癥的關聯(lián)
TRMT6-TRMT61A復合體、TRMT61B以及TRMT10C是以各種RNA為底物的m1A甲基轉(zhuǎn)移酶(writers)。TRMT6、TRMT61A或TRMT61B的高表達與膠質(zhì)瘤患者的不良預后相關。此外,在肝細胞癌(HCC)中也觀察到TRMT6和TRMT61A mRNA的高表達以及m1A豐度增加。
具體而言,TRMT6-TRMT61A對PPARG mRNA的m1A58修飾確保其適當翻譯,PPARG調(diào)控膽固醇生物合成并激活Hedgehog信號。抑制TRMT6-TRMT61A通過調(diào)控PPARG翻譯抑制HCC腫瘤發(fā)生。
目前已鑒定出幾種m1A去甲基化酶(erasers),其中研究最多的是ALKBH1酶,在大多數(shù)tRNA中去甲基化m1A58。這種m1A58去甲基化導致起始甲硫氨酸t(yī)RNA降解,ALKBH1缺失增加起始甲硫氨酸t(yī)RNA穩(wěn)定性和翻譯效率。ALKBH1在患病組織中異常表達,但尚未深入研究其機制。在胰腺癌患者中,ALKBH1基因表達水平與不良預后呈負相關。ALKBH1表達水平也與心血管疾病相關;然而,這種關聯(lián)是否是m1A依賴的尚不清楚。
ALKBH3去甲基化DNA和RNA上的m1A,對rRNA、tRNA和mRNA有活性。由于ALKBH3缺失導致的tRNA上m1A積累減少了蛋白合成。敲低ALKBH3也抑制癌細胞增殖。在卵巢癌和乳腺癌中,ALKBH3水平升高,該蛋白去甲基化細胞因子CSF-1的mRNA。結(jié)果,CSF-1 mRNA的半衰期延長,CSF-1蛋白水平升高促進轉(zhuǎn)移和侵襲。ALKBH1和ALKBH3水平與膠質(zhì)瘤患者的不良生存相關。
總體而言,m1A依賴性RNA調(diào)控在細胞過程和疾病發(fā)病機制中具有作用,表明靶向m1A甲基化酶和去甲基化酶的潛力。未來開發(fā)靶向這些酶的選擇性和強效小分子抑制劑將能夠在各種治療領域驗證這些假設。
m1A相關抑制劑的應用前景
在篩選破壞TRMT6-TRMT61A復合物形成的抑制劑時,鑒定出抗菌藥物四甲基秋蘭姆二硫化物(thiram)(圖4g)。thiram抑制肝臟腫瘤生長并特異性降低m1A豐度,證明靶向m1A writers酶用于癌癥治療的潛力。
假尿苷(Ψ)
Ψ分布與功能
Ψ是尿苷的異構(gòu)體,是第一個被發(fā)現(xiàn)的RNA修飾,也是最豐富的RNA修飾。Ψ廣泛存在于rRNA和tRNA中(表1)。雖然豐度較低,Ψ也存在于其它RNA種類中,包括miRNA和mRNA。rRNA上的假尿苷主要分布在核糖體的功能區(qū)域,如肽酰轉(zhuǎn)移酶中心、解碼區(qū)域等。這些位點假尿苷的缺失會干擾翻譯或核糖體生物發(fā)生。tRNA和mRNA上的Ψ同樣調(diào)控翻譯。高度保守的tRNA假尿苷化,以及在反密碼子莖和環(huán)區(qū)域,調(diào)控與密碼子的堿基配對。mRNA終止密碼子UAA、UAG或UGA的假尿苷化導致終止密碼子通讀。snRNA中的假尿苷可以調(diào)控剪切。
Ψ修飾與疾病關聯(lián)
假尿苷化可以直接由假尿苷合成酶(PUS)酶催化,或由DKC1催化,DKC1由具有H/ACA motif的snoRNA引導。mRNA的假尿苷化在熱休克和應激反應中動態(tài)調(diào)控,但疾病刺激是否導致不同的假尿苷模式需要進一步研究。然而,研究支持修飾失調(diào)與疾病相關的觀點。
假尿苷化被認為與癌癥的發(fā)生和發(fā)展有關,如與MYC表達水平相關的snoRNA SCARNA15表達,其通過引導假尿苷化調(diào)控腫瘤抑制基因剪切和癌細胞生長。
Ψ修飾酶的抑制與治療潛力
通過監(jiān)測假尿苷水平,鑒定出小分子C17作為PUS7催化活性的抑制劑,C17能在納摩爾濃度下抑制膠質(zhì)母細胞瘤干細胞(GSC)的生長,并在小鼠中抑制腫瘤生長,這表明靶向PUS酶的抑制劑開發(fā)對于癌癥治療具有潛在的應用價值。
2′-O-甲基化(Nm)
Nm修飾分布及功能
Nm表示對任何一種核糖核苷酸的2′-羥基的甲基化,存在于tRNA、rRNA、snRNA、小非編碼RNA和mRNA中(表1)。與核堿基修飾不同,Nm不直接干擾Watson-Crick堿基配對。然而,Nm修飾保護RNA免受核酸酶活性,增強RNA-RNA互作,破壞RNA-蛋白質(zhì)互作并干擾RNA三級結(jié)構(gòu)。因此,Nm對調(diào)控RNA穩(wěn)定性、翻譯和剪切非常重要。
Nm修飾與疾病關聯(lián)
FTSJ1編碼的tRNA Nm甲基轉(zhuǎn)移酶與X連鎖智力障礙有關,而FBL(Fibrillarin)這種在rRNA甲基化中起作用的甲基轉(zhuǎn)移酶在多種癌癥中過表達,可能有助于腫瘤細胞的生長。
Nm修飾在區(qū)分自身和非自身轉(zhuǎn)錄本方面也起著重要的作用,例如,在mRNA生物合成過程中,由CMTR1和CMTR2這兩個帽子甲基轉(zhuǎn)移酶依次進行的Nm修飾能夠防止先天免疫反應對自身RNA的攻擊。
Nm修飾相關抑制劑的開發(fā)
盡管Nm修飾在多種疾病中具有重要意義,然而,靶向調(diào)控Nm修飾蛋白的抑制劑的開發(fā)仍然有限。開發(fā)具有選擇性的抑制劑有望為智力障礙、癌癥和病毒感染等疾病的治療提供新的應用方向。
機遇與挑戰(zhàn)
目前,越來越多的證據(jù)表明,模式生物上的多種RNA修飾在各類疾病中均具有顯著作用,這些發(fā)現(xiàn)為治療靶點開辟了一個新的道路,m6A修飾通路在癌癥中的作用及其在腫瘤微環(huán)境(TME)中的調(diào)控作用表明,其可能具有抗腫瘤益處,且有一定概率改善癌癥治療的效果,尤其是針對治療的耐藥性方面。
干細胞治療是另一個可能從抑制m6A效應蛋白的藥物中受益的領域,m6A修飾通過影響YTHDF2對轉(zhuǎn)錄本的快速降解來調(diào)控干細胞的自我更新和分化,靶向m6A通路可能為克服治療用干細胞擴增提供機會。
盡管RNA修飾作為治療靶點具有巨大潛力,但在將研究得出的小分子藥物應用于臨床仍面臨挑戰(zhàn),例如,靶向RNA修飾蛋白的小分子藥物可能需要在特定的時間窗口內(nèi)給藥,原因是RNA修飾的功能高度依賴于給藥背景。此外,RNA修飾和RNA結(jié)合蛋白通常具有相似的催化結(jié)構(gòu)域或結(jié)合口袋,這使得開發(fā)特異性抑制劑變得具有挑戰(zhàn)性,在設計小分子時需要考慮如何實現(xiàn)對特定底物結(jié)合域的干擾,以實現(xiàn)特異性抑制。
RNA治療領域的進展表明,了解不同RNA修飾功能可以對合成RNA分子進行加工,以實現(xiàn)某些化學和生物學特性。例如,包括m6A、Ψ、m5C和mRNA 5′端帽子上的m7G等在內(nèi)的多種RNA修飾可以減輕免疫原性,同時增加翻譯效率,這些RNA修飾的發(fā)現(xiàn)為RNA治療藥物的開發(fā)和優(yōu)化提供了重要的指導。
參考文獻:
Zhang L, Wei J, Zou Z, He C. RNA modification systems as therapeutic targets. Nat Rev Drug Discov. 2025 Sep 17. doi: 10.1038/s41573-025-01280-8.
標簽:
RNA甲基化
- 單細胞擬時序分析技術的核心特征、原理、分析步驟及應用場景
- 現(xiàn)貨型新生抗原疫苗聯(lián)合ICI在晚期纖維板層型肝癌中展現(xiàn)治療潛力
- 解鎖細胞年齡的密碼:端粒檢測如何成為健康管理新視角?
- 多組學分析揭示DNA低甲基化定義人組織調(diào)節(jié)性T細胞的表觀遺傳適應性
- Polysome Profiling—解析翻譯調(diào)控機制的金標準
- Ribo-seq—檢測正在翻譯的RNA信息 連接轉(zhuǎn)錄組學與蛋白質(zhì)組學的橋梁
- Science:利用大規(guī)模并行核糖體分析發(fā)現(xiàn)泛病毒ORF
- 微量WGBS揭示DNA甲基化調(diào)控斑馬魚造血干細胞發(fā)育的表觀遺傳機制
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






