CircABCA1通過調(diào)節(jié)膽固醇代謝和促進(jìn)M2巨噬細(xì)胞極化的機(jī)制
透明細(xì)胞腎細(xì)胞癌(ccRCC)對(duì)外源性膽固醇輸入的依賴意味著代謝易感性,這種易感性代表了一種潛在的途徑,可以作為ccRCC的一種新的治療方法。環(huán)狀RNA(circRNA)是癌癥中新興的調(diào)節(jié)因子,但其在ccRCC脂質(zhì)代謝和腫瘤微環(huán)境重塑中的作用尚不清楚。
2025年7月19日,重慶醫(yī)科大學(xué)肖斌、陸軍軍醫(yī)大學(xué)王永權(quán)、重慶大學(xué)李薇共同通訊在Molecular Cancer在線發(fā)表題為“CircABCA1 promotes ccRCC by reprogramming cholesterol metabolism and facilitating M2 macrophage polarization through IGF2BP3-mediated stabilization of SCARB1 mRNA”的研究論文。研究揭示了CircABCA1通過調(diào)節(jié)膽固醇代謝和促進(jìn)M2巨噬細(xì)胞極化,在促進(jìn)ccRCC進(jìn)展中起著至關(guān)重要的作用,可能是ccRCC治療的潛在治療靶點(diǎn)。

· 維真助力——SCARB1雙熒光素酶質(zhì)粒 ·
感染細(xì)胞:ccRCC細(xì)胞
使用劑量:800ng
研究結(jié)果分享
1、circABCA1上調(diào)可以調(diào)節(jié)ccRCC的存活和遷移并維持ccRCC中的高CHO水平
作者發(fā)現(xiàn)ccRCC組織中三油甘脂(TG)和膽固醇脂(CE)發(fā)生顯著變化,對(duì)ccRCC脂質(zhì)代謝相關(guān)環(huán)狀RNA進(jìn)行篩選鑒定,發(fā)現(xiàn)circABCA1與膽固醇代謝相關(guān)。臨床研究中表明,在大部分ccRCC患者中circABCA1的表達(dá)升高。細(xì)胞實(shí)驗(yàn)發(fā)現(xiàn)敲低circABCA1抑制了ccRCC細(xì)胞的增殖和遷移。作者進(jìn)一步探討circABCA1在脂質(zhì)代謝中的潛在作用,對(duì)轉(zhuǎn)染si-circABCA1的ccRCC細(xì)胞進(jìn)行了RNA-seq分析,差異基因分析表明circABCA1可能主要參與膽固醇(CHO)代謝的調(diào)節(jié)。總膽固醇(T-CHO)水平在circABCA1敲低后下調(diào),但circABCA1的高表達(dá)可以提高ccRCC細(xì)胞中的CHO水平。以上結(jié)果表明,circABCA1與腫瘤分期和遠(yuǎn)處轉(zhuǎn)移呈正相關(guān),并作為一種潛在的癌基因,可提高ccRCC中的CHO水平。
感染細(xì)胞:ccRCC細(xì)胞
使用劑量:800ng
研究結(jié)果分享
1、circABCA1上調(diào)可以調(diào)節(jié)ccRCC的存活和遷移并維持ccRCC中的高CHO水平
作者發(fā)現(xiàn)ccRCC組織中三油甘脂(TG)和膽固醇脂(CE)發(fā)生顯著變化,對(duì)ccRCC脂質(zhì)代謝相關(guān)環(huán)狀RNA進(jìn)行篩選鑒定,發(fā)現(xiàn)circABCA1與膽固醇代謝相關(guān)。臨床研究中表明,在大部分ccRCC患者中circABCA1的表達(dá)升高。細(xì)胞實(shí)驗(yàn)發(fā)現(xiàn)敲低circABCA1抑制了ccRCC細(xì)胞的增殖和遷移。作者進(jìn)一步探討circABCA1在脂質(zhì)代謝中的潛在作用,對(duì)轉(zhuǎn)染si-circABCA1的ccRCC細(xì)胞進(jìn)行了RNA-seq分析,差異基因分析表明circABCA1可能主要參與膽固醇(CHO)代謝的調(diào)節(jié)。總膽固醇(T-CHO)水平在circABCA1敲低后下調(diào),但circABCA1的高表達(dá)可以提高ccRCC細(xì)胞中的CHO水平。以上結(jié)果表明,circABCA1與腫瘤分期和遠(yuǎn)處轉(zhuǎn)移呈正相關(guān),并作為一種潛在的癌基因,可提高ccRCC中的CHO水平。
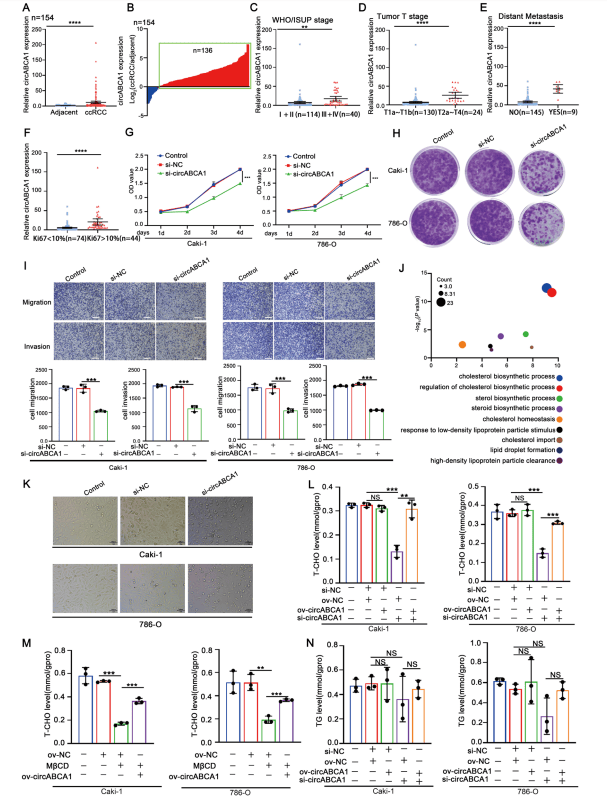
圖1. circABCA1上調(diào)可以調(diào)節(jié)ccRCC的存活和遷移并維持ccRCC中的高CHO水平
2、SCARB1依賴性膽固醇調(diào)節(jié)介導(dǎo)了si-circABCA1的ccRCC抑制作用
作者研究發(fā)現(xiàn)SCARB1是ccRCC細(xì)胞中circABCA1的下游靶點(diǎn),circABCA1以依賴于SCARB1的方式調(diào)節(jié)T-CHO水平。circABCA1正向調(diào)節(jié)SCARB1的表達(dá),circABCA1敲低顯著抑制了ccRCC細(xì)胞的增殖和遷移。重要的是SCARB1過表達(dá)有效地挽救了si-circABCA1誘導(dǎo)的腫瘤抑制表型。在體內(nèi),皮下腫瘤異種移植物的生長(zhǎng)速度和重量受到circABCA1敲低的抑制,并通過SCARB1過表達(dá)得到恢復(fù);在肝轉(zhuǎn)移模型中,敲低circABCA1導(dǎo)致轉(zhuǎn)移結(jié)節(jié)的數(shù)量和大小減少。挽救實(shí)驗(yàn)表明,SCARB1的過表達(dá)恢復(fù)了si-circABCA1抑制的遷移能力。以上結(jié)果表明敲低circABCA1通過調(diào)節(jié)SCARB1在體外和體內(nèi)抑制ccRCC的增殖和遷移。進(jìn)一步研究發(fā)現(xiàn)circABCA1與IGF2BP3結(jié)合調(diào)節(jié)SCARB1的表達(dá)和隨后的HDL攝取,通過SCARB1雙熒光素酶、RNA下拉等實(shí)驗(yàn)進(jìn)行機(jī)制研究,發(fā)現(xiàn)在ccRCC細(xì)胞中高表達(dá)的circABCA1誘導(dǎo)更多的SCARB1 mRNA與IGF2BP3結(jié)合,并在空間上增加了它們相互結(jié)合的可能性,因此更多的SCARB1信使核糖基酸3'UTR被circABCA1和IGF2BP3連接,有效地促進(jìn)了SCARB1水平的增加。
作者研究發(fā)現(xiàn)SCARB1是ccRCC細(xì)胞中circABCA1的下游靶點(diǎn),circABCA1以依賴于SCARB1的方式調(diào)節(jié)T-CHO水平。circABCA1正向調(diào)節(jié)SCARB1的表達(dá),circABCA1敲低顯著抑制了ccRCC細(xì)胞的增殖和遷移。重要的是SCARB1過表達(dá)有效地挽救了si-circABCA1誘導(dǎo)的腫瘤抑制表型。在體內(nèi),皮下腫瘤異種移植物的生長(zhǎng)速度和重量受到circABCA1敲低的抑制,并通過SCARB1過表達(dá)得到恢復(fù);在肝轉(zhuǎn)移模型中,敲低circABCA1導(dǎo)致轉(zhuǎn)移結(jié)節(jié)的數(shù)量和大小減少。挽救實(shí)驗(yàn)表明,SCARB1的過表達(dá)恢復(fù)了si-circABCA1抑制的遷移能力。以上結(jié)果表明敲低circABCA1通過調(diào)節(jié)SCARB1在體外和體內(nèi)抑制ccRCC的增殖和遷移。進(jìn)一步研究發(fā)現(xiàn)circABCA1與IGF2BP3結(jié)合調(diào)節(jié)SCARB1的表達(dá)和隨后的HDL攝取,通過SCARB1雙熒光素酶、RNA下拉等實(shí)驗(yàn)進(jìn)行機(jī)制研究,發(fā)現(xiàn)在ccRCC細(xì)胞中高表達(dá)的circABCA1誘導(dǎo)更多的SCARB1 mRNA與IGF2BP3結(jié)合,并在空間上增加了它們相互結(jié)合的可能性,因此更多的SCARB1信使核糖基酸3'UTR被circABCA1和IGF2BP3連接,有效地促進(jìn)了SCARB1水平的增加。
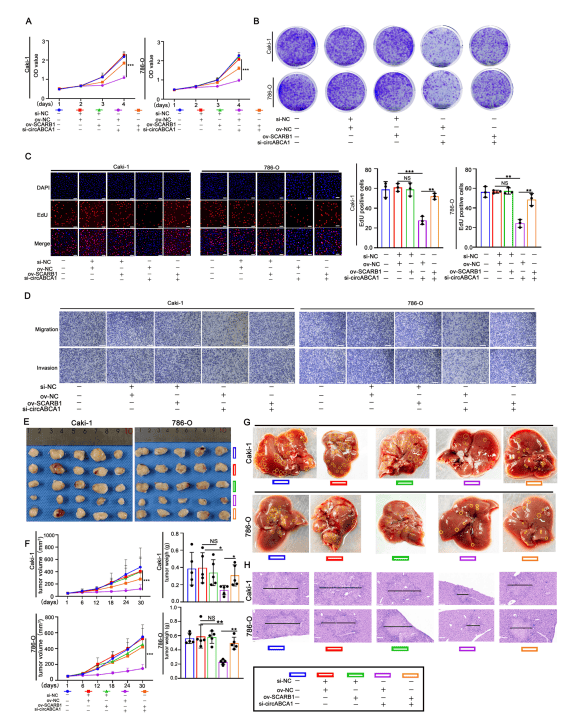
圖2. 敲低circABCA1以SCARB1依賴的方式抑制ccRCC的遷移和增殖
3、CircABCA1通過IGF1R/PI3K/AKT/mTOR級(jí)聯(lián)以CHO依賴的方式調(diào)節(jié)自噬
作者研究了si-circABCA1通過下調(diào)SCARB1增加CHO外排的機(jī)制,發(fā)現(xiàn)si-circABCA1誘導(dǎo)的SCARB1下調(diào)促進(jìn)了親脂性,導(dǎo)致游離膽固醇(FC)水平升高,隨后CHO流出量增加,這導(dǎo)致ccRCC細(xì)胞中T-CHO水平降低。鑒于si-circABCA1促進(jìn)自噬,作者通過測(cè)量LC3B/LC3A和P62水平的比值來(lái)評(píng)估自噬的活性,發(fā)現(xiàn)circABCA1和SCARB1都通過CHO調(diào)節(jié)來(lái)調(diào)節(jié)自噬,下調(diào)CHO水平會(huì)導(dǎo)致ccRCC細(xì)胞中更高的自噬。此外ccRCC細(xì)胞中脂質(zhì)的破壞抑制了IGF1R/PI3K/AKT/mTOR的磷酸化,進(jìn)而調(diào)控自噬水平,這可能是si-circABCA1-SCARB1發(fā)揮作用的潛在機(jī)制。
作者研究了si-circABCA1通過下調(diào)SCARB1增加CHO外排的機(jī)制,發(fā)現(xiàn)si-circABCA1誘導(dǎo)的SCARB1下調(diào)促進(jìn)了親脂性,導(dǎo)致游離膽固醇(FC)水平升高,隨后CHO流出量增加,這導(dǎo)致ccRCC細(xì)胞中T-CHO水平降低。鑒于si-circABCA1促進(jìn)自噬,作者通過測(cè)量LC3B/LC3A和P62水平的比值來(lái)評(píng)估自噬的活性,發(fā)現(xiàn)circABCA1和SCARB1都通過CHO調(diào)節(jié)來(lái)調(diào)節(jié)自噬,下調(diào)CHO水平會(huì)導(dǎo)致ccRCC細(xì)胞中更高的自噬。此外ccRCC細(xì)胞中脂質(zhì)的破壞抑制了IGF1R/PI3K/AKT/mTOR的磷酸化,進(jìn)而調(diào)控自噬水平,這可能是si-circABCA1-SCARB1發(fā)揮作用的潛在機(jī)制。
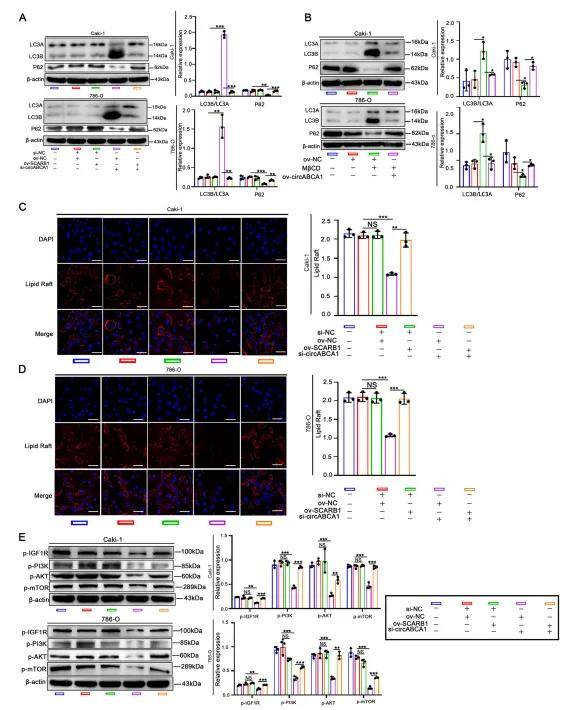
圖3.CircABCA1通過IGF1R/PI3K/AKT/mTOR級(jí)聯(lián)以CHO依賴的方式調(diào)節(jié)自噬
4、Si-circABCA1抑制M2巨噬細(xì)胞極化,并以SCARB1依賴的方式發(fā)揮其抗腫瘤作用
CHO也被報(bào)道在巨噬細(xì)胞極化中起著重要作用,實(shí)驗(yàn)表明CHO可能通過促進(jìn)M1樣極化但抑制M2樣極化來(lái)重塑巨噬細(xì)胞極化,而M2巨噬細(xì)胞的浸潤(rùn)可能會(huì)改善ccRCC的預(yù)后。高水平的circABCA1使ccRCC能夠從腫瘤微環(huán)境中競(jìng)爭(zhēng)性攝取CHO,使用Transwell試驗(yàn)建立了ccRCC細(xì)胞和M2樣巨噬細(xì)胞的共培養(yǎng)系統(tǒng),證實(shí)了si-circABCA1可以將腫瘤微環(huán)境中的M2巨噬細(xì)胞重塑為M1樣極化。進(jìn)一步研究發(fā)現(xiàn)circABCA1通過以SCARB1依賴的方式促進(jìn)膽固醇從腫瘤微環(huán)境中攝取ccRCC,促進(jìn)M2巨噬細(xì)胞極化和隨后的促腫瘤作用。
CHO也被報(bào)道在巨噬細(xì)胞極化中起著重要作用,實(shí)驗(yàn)表明CHO可能通過促進(jìn)M1樣極化但抑制M2樣極化來(lái)重塑巨噬細(xì)胞極化,而M2巨噬細(xì)胞的浸潤(rùn)可能會(huì)改善ccRCC的預(yù)后。高水平的circABCA1使ccRCC能夠從腫瘤微環(huán)境中競(jìng)爭(zhēng)性攝取CHO,使用Transwell試驗(yàn)建立了ccRCC細(xì)胞和M2樣巨噬細(xì)胞的共培養(yǎng)系統(tǒng),證實(shí)了si-circABCA1可以將腫瘤微環(huán)境中的M2巨噬細(xì)胞重塑為M1樣極化。進(jìn)一步研究發(fā)現(xiàn)circABCA1通過以SCARB1依賴的方式促進(jìn)膽固醇從腫瘤微環(huán)境中攝取ccRCC,促進(jìn)M2巨噬細(xì)胞極化和隨后的促腫瘤作用。
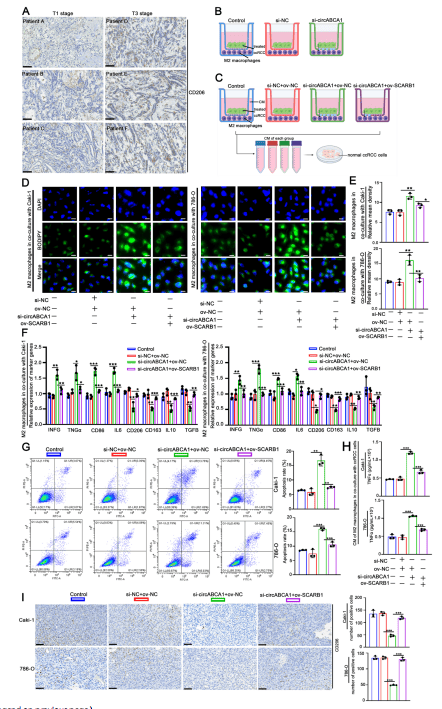
圖4. Si-circABCA1抑制M2巨噬細(xì)胞極化,并以SCARB1依賴的方式發(fā)揮其抗腫瘤作用
結(jié)論
本研究鑒定出一種新型的脂質(zhì)代謝相關(guān)circRNA-circABCA1,在ccRCC中上調(diào),與腫瘤分期和遠(yuǎn)處轉(zhuǎn)移呈正相關(guān)。在功能上,circABCA1 通過形成circABCA1-IGF2BP3-SCARB1 mRNA三元復(fù)合物來(lái)增強(qiáng)SCARB1 mRNA的半衰期,從而增加SCARB1的表達(dá)和隨后的膽固醇攝取。CircABCA1以SCARB1依賴的方式促進(jìn)ccRCC在體外和體內(nèi)的增殖和遷移。此外,circABCA1通過以SCARB1依賴性方式促使膽固醇從腫瘤微環(huán)境中攝取 ccRCC來(lái)促進(jìn)M2巨噬細(xì)胞極化和隨后的促腫瘤作用。本研究加深了對(duì)ccRCC發(fā)病機(jī)制的理解,并為針對(duì)circABCA1-IGF2BP3-SCARB1軸的精確治療開辟了途徑。
本研究鑒定出一種新型的脂質(zhì)代謝相關(guān)circRNA-circABCA1,在ccRCC中上調(diào),與腫瘤分期和遠(yuǎn)處轉(zhuǎn)移呈正相關(guān)。在功能上,circABCA1 通過形成circABCA1-IGF2BP3-SCARB1 mRNA三元復(fù)合物來(lái)增強(qiáng)SCARB1 mRNA的半衰期,從而增加SCARB1的表達(dá)和隨后的膽固醇攝取。CircABCA1以SCARB1依賴的方式促進(jìn)ccRCC在體外和體內(nèi)的增殖和遷移。此外,circABCA1通過以SCARB1依賴性方式促使膽固醇從腫瘤微環(huán)境中攝取 ccRCC來(lái)促進(jìn)M2巨噬細(xì)胞極化和隨后的促腫瘤作用。本研究加深了對(duì)ccRCC發(fā)病機(jī)制的理解,并為針對(duì)circABCA1-IGF2BP3-SCARB1軸的精確治療開辟了途徑。
- 增強(qiáng)AAV對(duì)腎臟組織的感染效率的方法分享
- 文獻(xiàn):AAA中內(nèi)皮細(xì)胞在單細(xì)胞水平上的異質(zhì)性和轉(zhuǎn)錄特征
- 鄰位連接技術(shù)(PLA)的原理、實(shí)驗(yàn)流程及在生命科學(xué)研究中的應(yīng)用
- 衰老標(biāo)志的因果關(guān)系:端粒/rDNA才是根本因素?
- 蛋白質(zhì)結(jié)構(gòu)預(yù)測(cè)的技術(shù)變革、新挑戰(zhàn)與發(fā)展方向
- 空間多組學(xué)助力揭示膠質(zhì)瘤中三級(jí)淋巴結(jié)構(gòu)的臨床意義
- CZ CELLxGENE Discover生物數(shù)據(jù)庫(kù)使用步驟介紹
- CosMx SMI空間原位技術(shù)助力無(wú)需組織解離實(shí)現(xiàn)單細(xì)胞的多靶標(biāo)檢測(cè)
- 上海生物芯片推出SMI WTX與空間蛋白聯(lián)合檢測(cè)方案
- 樂備實(shí)蛋白檢測(cè)拼板、趨化因子檢測(cè)多重年終福利開啟
- 上海生物芯片即將推出"血管化器官芯片"產(chǎn)品和服務(wù)
- 生物芯片推出WTX與多平臺(tái)蛋白組檢測(cè)技術(shù)解決方案
- 樂備實(shí)全線服務(wù)產(chǎn)品大促,滿減來(lái)襲,拼板滿10送1
- 國(guó)內(nèi)首批CosMx SMI WTX高通量轉(zhuǎn)錄組實(shí)測(cè)數(shù)據(jù)出爐
- Bruker發(fā)布GeoMx® DPA,實(shí)現(xiàn)1200+種蛋白質(zhì)空間表達(dá)
- SBC芯空一號(hào)產(chǎn)品中的關(guān)鍵技術(shù)平臺(tái)SMI完成重大升級(jí)
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






