兩大小鼠模型在免疫治療領域作為先行軍的應用
免疫療法代表了癌癥治療方法的重大飛躍,但是仍有部分患者因藥物有效率低無法得到有效的治療。合適的臨床前藥效研究模型,可以加速免疫藥物研發和開發新型治療組合,最大程度減少臨床試驗失敗。基因人源化小鼠和免疫系統人源化小鼠可謂嚙齒動物界的“兩大神獸”,深受藥物研究者的青睞。為了更大限度的模擬人體疾病與免疫系統的相互作用,研究者在免疫缺陷小鼠體內移植入人造血干細胞或功能性的淋巴細胞,使其具有人的免疫功能,稱為免疫系統人源化小鼠/免疫系統重建小鼠。它在腫瘤免疫治療藥物的研發與臨床前評估方面也頗有前景。
免疫系統人源化小鼠模型分類
表1 不同免疫系統人源化小鼠模型的特點
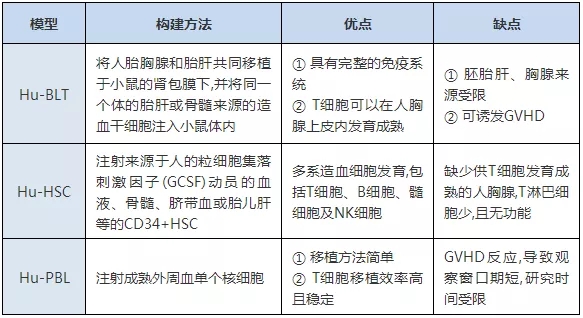
注:Hu-PBL:人外周血淋巴細胞;Hu-PBL/PBMC:人外周血單核細胞;Hu-Hu-CD34+HSC:人造血干細胞;Hu-BLT:人骨髓、肝臟、胸腺;GVHD:移植物抗宿主病
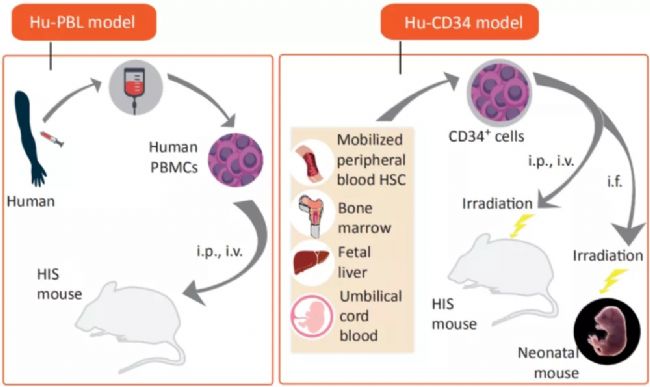
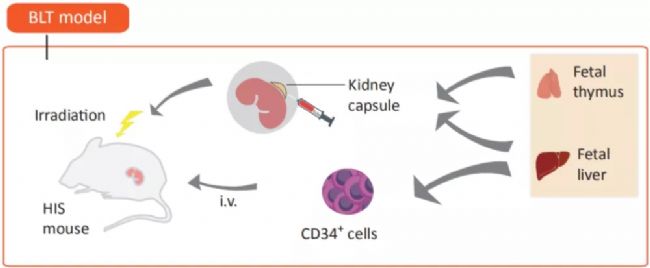
免疫系統人源化小鼠模型在腫瘤免疫治療中的應用
免疫系統人源化小鼠模型在免疫治療和免疫研究中,特別是在腫瘤治療上有重要作用,能夠研究人免疫細胞介導的人體組織免疫排斥,評估藥物的治療潛力,也可以針對患者腫瘤提供治療方案預測。多種新型療法如細胞治療、免疫檢查點抑制劑治療以及與其他免疫療法組合等,都可以此作為臨床前評價模型。
應用于細胞治療藥物的藥效和早期毒性評估
1)CAR-T治療中的應用
CAR-T療法是應用患者自身的T淋巴細胞,經嵌合抗原受體修飾,體外擴增后再次回輸入患者體內,從而識別并攻擊自身的腫瘤細胞。2017年美國食品藥品監督管理局(FDA)批準了首項針對B細胞急性淋巴母細胞性白血病的CAR-T治療,但是CAR-T在實體腫瘤的治療中應用較少。目前免疫系統人源化小鼠模型已應用于各種CAR設計的抗腫瘤藥效評估。
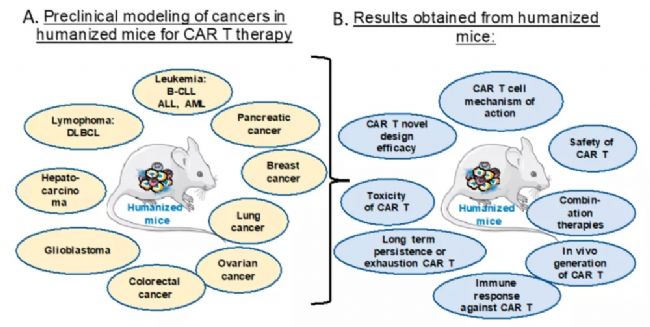
圖2. CAR-T細胞治療在免疫系統人源化腫瘤小鼠模型的臨床前評估[3]
Daniel Abate-Daga等利用Hu-PBL模型評估 PSCA CAR-T細胞藥效(圖3),表明對胰腺癌患者有治療潛力。2020年 Precigen公司在AACR年會上公布了PRGN-3005 UltraCAR-TTM的臨床前結果,其對SK-OV-3卵巢癌模型有明顯的特異性抗腫瘤作用。
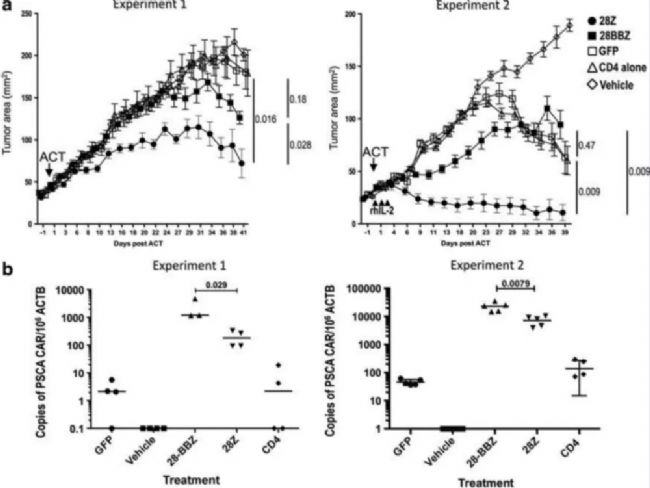
圖3. PSCA CARs 有效治療建立的腫瘤模型[4]
2)NK細胞治療中的應用
Neuroblastoma Model.Liu等分離臍帶血來源的NK細胞,經CAR轉導(編碼抗CD19、IL-15(NK細胞持久性的關鍵細胞因子)和iC9自殺基因),利用免疫系統人源化小鼠評估發現其對Raji淋巴瘤具有較強的抗腫瘤效果;且在CAR-NK細胞具有毒性的情況下,能夠通過激活自殺基因快速消除體內的CAR-NK細胞。該藥物正在進行臨床實驗(NCT03690310)[6]。
腫瘤免疫抗體藥物研究中的應用
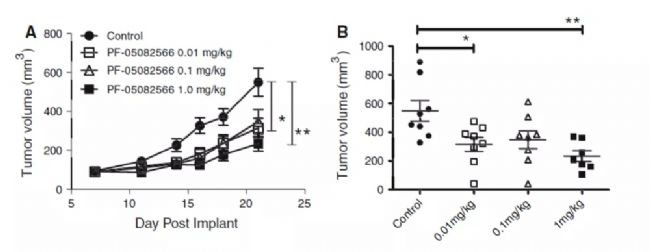
圖4. PF-05082566在體內抑制PC3前列腺腫瘤生長
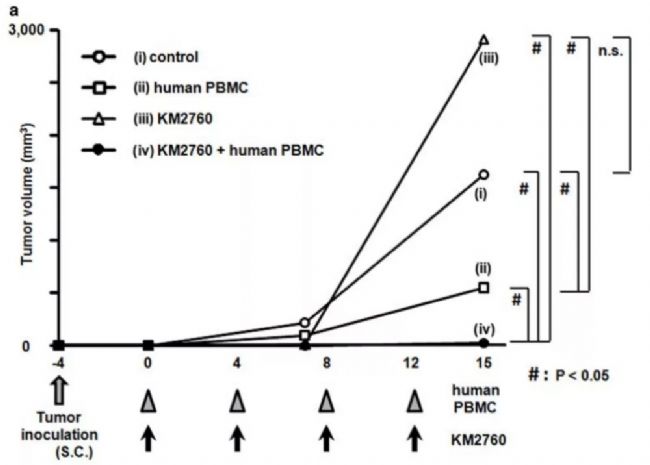
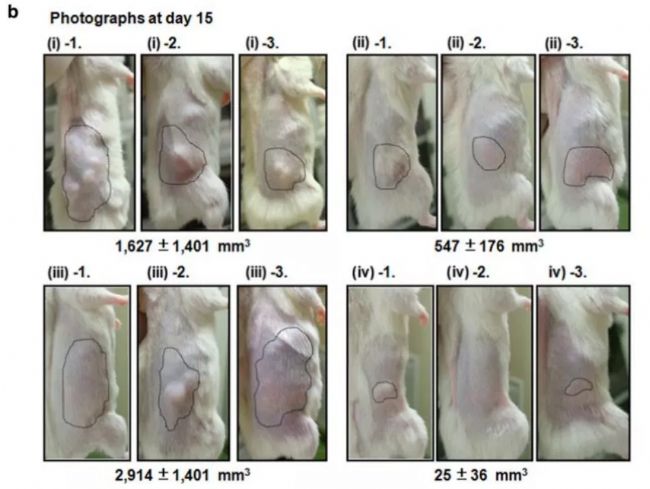
圖5.KM2760在Hu-PBMC CTCL模型體內有良好抗腫瘤活性[8]
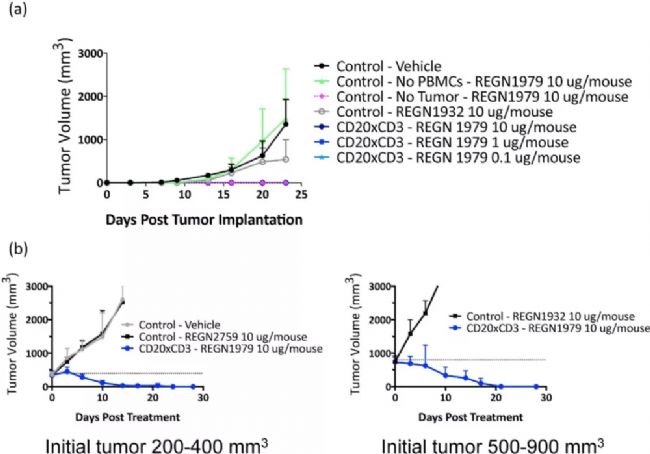
圖6.REGN1979抑制小鼠體內腫瘤生長[9]
免疫聯合治療中的應用
Suarez等[11]在轉移性腎透明細胞癌(ccRCC)的人源化小鼠模型中使用CAR-T細胞和免疫檢查點抑制劑進行聯合治療。這些靶向人抗碳酸酐酶IX(CAIX)的CAR-T細胞經改造后可分泌人抗PD-L1抗體,阻斷PD-1和PD-L1相互作用。與僅使用CAR-T細胞處理組相比,聯合免疫檢查點阻斷方法可有效增強抗腫瘤效力,可觀察到PD-1、TIM-3和LAG-3表達降低。Wege等[12]的研究表明,曲妥珠單抗和IL-15聯合使用可誘導HER2陽性乳腺腫瘤的消除,但也會導致與T細胞過度活化相關的致命副作用。免疫系統人源化小鼠模型是免疫聯合治療的優質評價模型,展現出更多治療結果以及副作用預示,為免疫聯合治療方法開發提供更有效的依據。
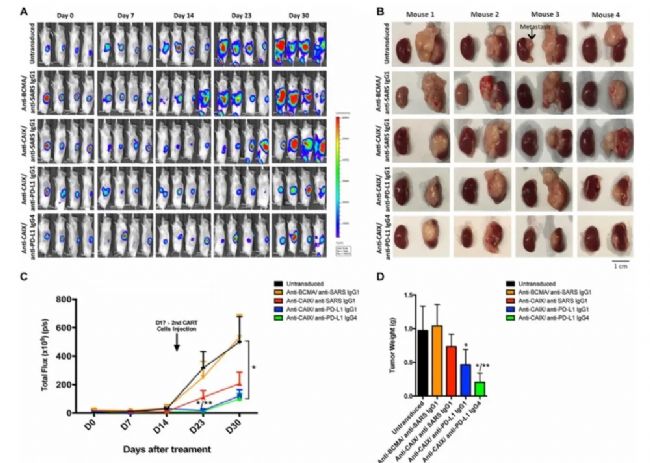
圖7. 分泌PD-L1抗體的CAR-T細胞在人原位ccRCC模型中的抗腫瘤作用
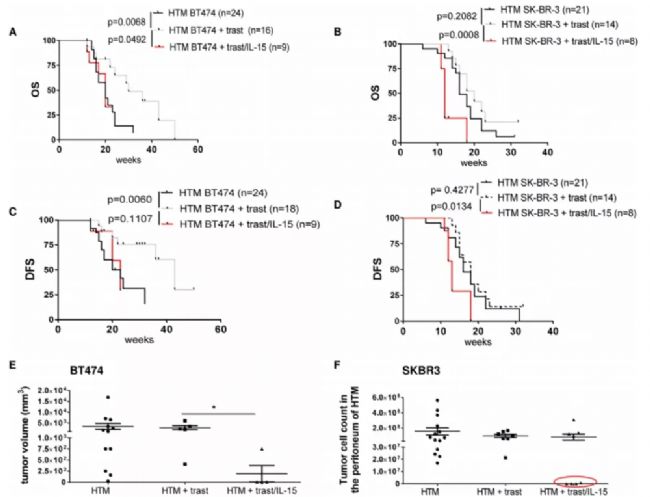
圖8.基于人HSC重建的HER2陽性乳腺癌小鼠模型研究IL-15和曲妥珠單抗聯合治療
免疫治療已經成為目前癌癥研究的熱門方向,免疫系統人源化小鼠模型是評估新療法、研究聯合治療方法以及指導個性化免疫治療的有效工具。展示了更多癌癥免疫治療的基本機制,并且為臨床前藥效研究提供數據。雖然目前免疫系統人源化小鼠無法全面展示人免疫系統的反應機制,但隨著模型的不斷優化升級,將成為腫瘤免疫治療領域不可或缺的重要工具。
參考文獻
[1] 郭文文,喬天運,張彩勤,等. 免疫系統人源化小鼠模型的構建及其在腫瘤治療研究中的應用[J]. 中國比較醫學雜志, 2019,29(11): 98-104.
[2] De La Rochere P, Guil-Luna S, Decaudin D, et al. Humanized mice for the study of immuno-oncology [J]. Trends Immunol, 2018, 39(9): 748-763.
[3] Mhaidly, Rana, Verhoeyen, Els, et al. Humanized Mice Are Precious Tools for Preclinical Evaluation of CAR T and CAR NK Cell Therapies [J]. Cancers, 2020, 12(7), 1915.
[4] Abate-Daga D, Lagisetty KH, Tran E, et al. A novel chimeric antigen receptor against prostate stem cell antigen mediates tumor destruction in a humanized mouse model of pancreatic cancer[J]. Hum Gene Ther, 2014, 25(12): 1003-1012.
[5] Richman Sarah A, Nunez-Cruz Selene, Moghimi Babak, et al. High-affinity GD2-specific CAR T cells induce fatal encephalitis in a preclinical neuroblastoma model [J]. Cancer Immunology Research, canimm, 2017, 0211.2017.
[6]Liu E, Tong Y, Dotti G, et al. Cord blood NK cells engineered to express IL-15 and a CD19-targeted CAR show long-term persistence and potent anti-tumor activity [J]. Leukemia, 2018, 32, 520–531.
[7]Timothy S. Fisher, Cris Kamperschroer, Theodore Oliphant, et al. Targeting of 4-1BB by monoclonal antibody PF-05082566 enhances T-cell function and promotes anti-tumor activity [J].Cancer Immunol Immunother, 2012 , 61(10), 1721–1733.
[8]Asahi Ito, Takashi Ishida, Hiroki Yano, et al. Defucosylated anti-CCR4 monoclonal antibody exercises potent ADCC-mediated antitumor effect in the novel tumor-bearing humanized NOD/Shi-scid, IL-2Rgamma(null) mouse model[J]. Cancer Immunol,2009, 58:1195–1206
[9]Smith Eric J., Olson Kara, Haber Lauric J., et al. A novel, native-format bispecific antibody triggering T-cell killing of B-cells is robustly active in mouse tumor models and cynomolgus monkeys [J]. Scientific Reports, 2016, 5(1), 17943–17943.
[10]Meraz IM, Majidi M, Meng F, et al. An improved patientderived xenograft humanized mouse model for evaluation of lung cancer immune responses [ J]. Cancer Immunol Res, 2019, 7(8): 1267-1279.
[11] Suarez ER, Chang DK, Sun J, et al. Chimeric antigen receptor T cells secreting anti-PD-L1 antibodies more effectively regress renal cell carcinoma in a humanized mouse model [ J ].Oncotarget, 2016, 7(23): 34341-34355.
[12]Anja K Wege1, Florian Weber, Alexander Kroemer, et al.IL-15 enhances the anti-tumor activity of trastuzumab against breast cancer cells but causes fatal side effects in humanized tumor mice (HTM). Oncotarget , 2017, 8:2731–2744






