IF 52.7文獻分享:香港大學團隊揭秘骨質疏松新治療靶點
間充質干細胞(MSCs)位于骨髓基質內,是一種非造血性多能干細胞,可分化為多種細胞類型,包括成骨細胞或脂肪細胞。骨髓間充質干細胞(BMMSCs)作為一種多能干細胞,因其在再生醫學和組織工程中的重要意義而備受關注。隨著年齡的增長或骨質疏松,骨髓脂肪生成增加,并與骨量的喪失呈負相關。骨髓脂肪細胞來源于多能的骨髓間充質干細胞,可分化為脂肪或骨。BMMSCs是機械敏感細胞,但機械負荷如何在體內調節骨髓脂肪生成及其對骨重建的影響仍然知之甚少。
2025年10月28日,香港大學徐愛民、王柏樂教授聯合法國國家科學研究中心分子與細胞藥理學研究所Eric Honoré在國際知名期刊Signal Transduction and Targeted Therapy(IF=52.7)上發表了文章 “Piezo1 activation suppresses bone marrow adipogenesis to prevent osteoporosis by inhibiting a mechanoinflammatory autocrine loop”。研究發現BMMSCs中Piezo1的激活通過阻止CCL2-Lcn2炎癥自分泌環路來抑制骨髓脂肪生成以維持骨強度,從而揭示了之前未知的機械轉導、炎癥和細胞命運決定之間的聯系。

· 維真助力 - 慢病毒·
病毒產品:Lv-PDGFRα-klf2-eGFP,Lv-PDGFRα-eGFP
感染細胞:WT或Piezo1敲除的BMMSCs
MOI:40
感染時間:72h
實驗動物:雄性PDGFRα-Piezo1 KO小鼠及其同窩WT小鼠
注射方式:兩側脛骨內注射
病毒用量:1.25×10^6 TU per side
病毒產品:Lv-PDGFRα-klf2-eGFP,Lv-PDGFRα-eGFP
感染細胞:WT或Piezo1敲除的BMMSCs
MOI:40
感染時間:72h
實驗動物:雄性PDGFRα-Piezo1 KO小鼠及其同窩WT小鼠
注射方式:兩側脛骨內注射
病毒用量:1.25×10^6 TU per side
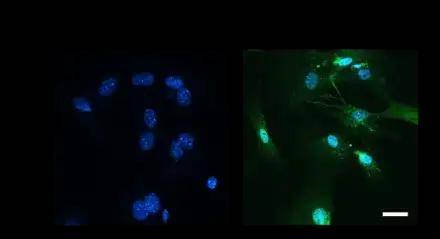
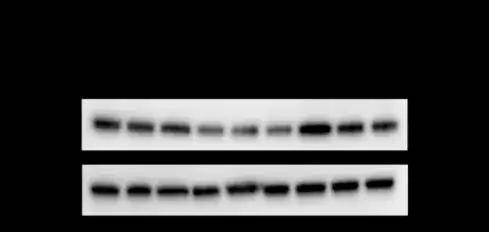
GFP熒光以及WB證實慢病毒介導Klf2在BMMSCs過表達
研究結果分享
1、PIEZO1基因缺失的骨髓間充質干細胞優先分化為脂肪細胞而不是成骨細胞
研究人員為探索Piezo1在脂肪組織的發育和功能中的潛在作用,利用血小板衍生生長因子受體α(PDGFRα)-Cre小鼠構建脂肪祖細胞Piezo1基因缺失模型。結果表明PDGFRα+細胞中的Piezo1缺失會削弱成骨作用,增加骨髓脂肪含量,但對周圍脂肪組織沒有明顯影響。接下來,研究人員探索了Piezo1對骨髓間充質干細胞在體外的成骨和成脂能力影響,發現Piezo1 KO BMMSCs的成骨能力比WT BMMSCs低得多,而成脂能力增加,提示Piezo1基因缺失后,骨髓間充質干細胞優先分化為脂肪細胞。考慮到Piezo1在小鼠骨髓間充質干細胞中的重要作用,通過Piezo1激活/抑制進一步研究了Piezo1在人骨髓間充質干細胞(HBMMSCs)中的作用,Yoda1激活Piezo1顯著抑制脂肪生成,但促進成骨。相反,通過GsMTx4抑制Piezo1增加了脂肪生成,但抑制了成骨。此外,研究人員通過骨髓移植實驗證實了PDGFRα-Piezo1 KO小鼠骨體積減少和骨髓脂肪增加完全是由于骨髓間充質干細胞中Piezo1缺失所致。
1、PIEZO1基因缺失的骨髓間充質干細胞優先分化為脂肪細胞而不是成骨細胞
研究人員為探索Piezo1在脂肪組織的發育和功能中的潛在作用,利用血小板衍生生長因子受體α(PDGFRα)-Cre小鼠構建脂肪祖細胞Piezo1基因缺失模型。結果表明PDGFRα+細胞中的Piezo1缺失會削弱成骨作用,增加骨髓脂肪含量,但對周圍脂肪組織沒有明顯影響。接下來,研究人員探索了Piezo1對骨髓間充質干細胞在體外的成骨和成脂能力影響,發現Piezo1 KO BMMSCs的成骨能力比WT BMMSCs低得多,而成脂能力增加,提示Piezo1基因缺失后,骨髓間充質干細胞優先分化為脂肪細胞。考慮到Piezo1在小鼠骨髓間充質干細胞中的重要作用,通過Piezo1激活/抑制進一步研究了Piezo1在人骨髓間充質干細胞(HBMMSCs)中的作用,Yoda1激活Piezo1顯著抑制脂肪生成,但促進成骨。相反,通過GsMTx4抑制Piezo1增加了脂肪生成,但抑制了成骨。此外,研究人員通過骨髓移植實驗證實了PDGFRα-Piezo1 KO小鼠骨體積減少和骨髓脂肪增加完全是由于骨髓間充質干細胞中Piezo1缺失所致。
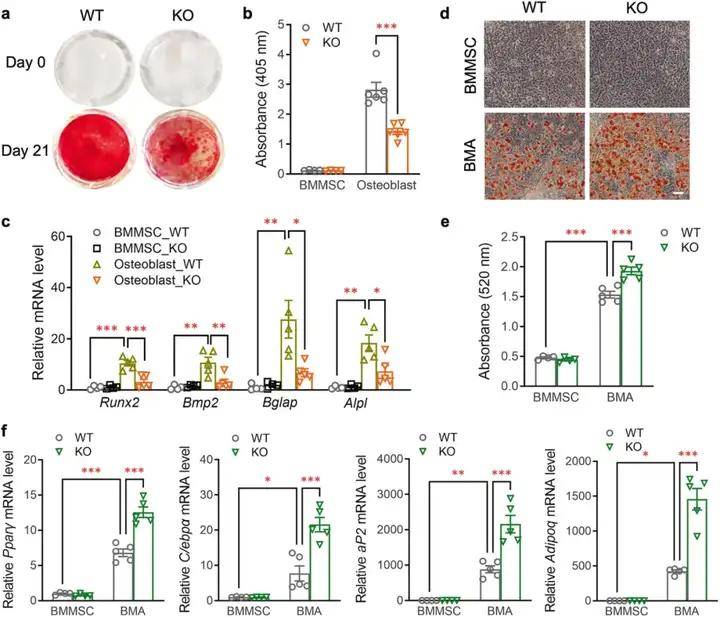
圖1.PIEZO1基因缺失的骨髓間充質干細胞優先分化為脂肪細胞而不是成骨細胞
2、PIEZO1缺失增強CCL2-CCR2信號促進Lcn2表達和分泌
大量證據表明,骨髓間充質干細胞來源的自分泌因子在決定骨髓間充質干細胞的譜系定向方面具有重要意義。研究人員進一步探究了Piezo1下游調控BMMSCs成骨或成脂作用的分泌因子,篩選發現了在Piezo1缺失的BMMSCs中顯著增加的促炎細胞因子lipocalin-2 (Lcn2)和Ccl2。接下來研究人員探討了Piezo1缺失是如何上調BMMSCs中Lcn2的表達和分泌。qPCR分析和Olink數據顯示,Piezo1 KO BMMSC中Ccl2的表達和分泌水平均大幅升高。Ccl2已被證明通過其自分泌作用在腫瘤細胞中誘導 Lcn2,為了研究 Lcn2 水平是否通過 Ccl2 的 Piezo1 依賴性自分泌作用進行調節,研究人員首先確認了 BMMSC 中 Ccl2 受體 CCR2 的表達,并發現它在 Piezo1 KO BMMSC 中顯著上調,此外重組小鼠CCL2蛋白能地將BMMSCs的分化潛能從成骨轉變為成脂,并增加了WT BMMSCs中Lcn2的表達和分泌,而CCR2拮抗劑INCB3344可逆轉Piezo1 KO BMMSCs 的上述表型,表明CCL2-CCR2信號促進成脂抑骨。進一步研究表明Piezo1 通過抑制 Ccl2 誘發的 NF-κB 激活來抑制 Lcn2 表達和分泌。
大量證據表明,骨髓間充質干細胞來源的自分泌因子在決定骨髓間充質干細胞的譜系定向方面具有重要意義。研究人員進一步探究了Piezo1下游調控BMMSCs成骨或成脂作用的分泌因子,篩選發現了在Piezo1缺失的BMMSCs中顯著增加的促炎細胞因子lipocalin-2 (Lcn2)和Ccl2。接下來研究人員探討了Piezo1缺失是如何上調BMMSCs中Lcn2的表達和分泌。qPCR分析和Olink數據顯示,Piezo1 KO BMMSC中Ccl2的表達和分泌水平均大幅升高。Ccl2已被證明通過其自分泌作用在腫瘤細胞中誘導 Lcn2,為了研究 Lcn2 水平是否通過 Ccl2 的 Piezo1 依賴性自分泌作用進行調節,研究人員首先確認了 BMMSC 中 Ccl2 受體 CCR2 的表達,并發現它在 Piezo1 KO BMMSC 中顯著上調,此外重組小鼠CCL2蛋白能地將BMMSCs的分化潛能從成骨轉變為成脂,并增加了WT BMMSCs中Lcn2的表達和分泌,而CCR2拮抗劑INCB3344可逆轉Piezo1 KO BMMSCs 的上述表型,表明CCL2-CCR2信號促進成脂抑骨。進一步研究表明Piezo1 通過抑制 Ccl2 誘發的 NF-κB 激活來抑制 Lcn2 表達和分泌。
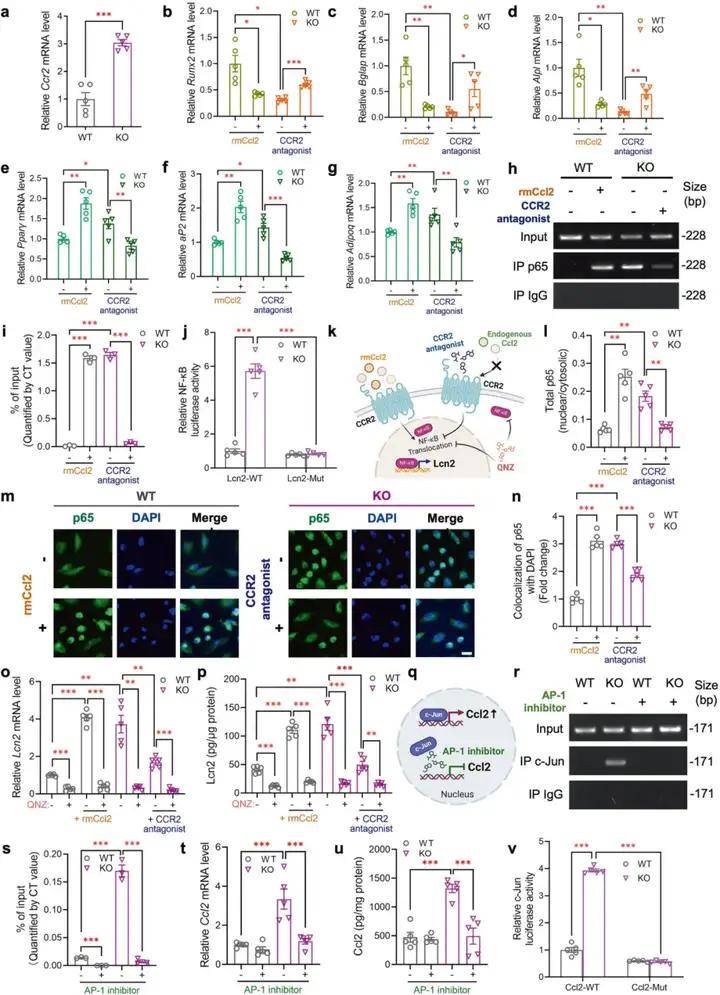
圖2. PIEZO1通過抑制CCl2誘導的NF-κB的活化而抑制Lcn2的表達和分泌
3、體內過表達KLF2或下調CCL2/Lcn2逆轉PDGFRα-Piezo1 KO小鼠骨量和骨髓肥胖變化
為了驗證KLF2-CCL2-Lcn2軸作為Piezo1的下游信號效應器,參與調控骨髓間充質干細胞命運,研究人員利用慢病毒在小鼠體內過表達KLF2或下調CCL2/Lcn2,并在體外BMMSCs已證實該策略的有效性,以及慢病毒脛骨內注射的特異性轉導。在PDGFRα+BMMSCs中恢復KLF2的表達逆轉了Piezo1 KO小鼠的骨體積減少、骨小梁數量減少、骨密度降低、ALP染色的成骨細胞減少、骨小梁分離增加和BMA增加。同樣,在Piezo1缺陷的PDGFRα+BMMSCs中,CCL2或Lcn2被敲低到與WT BMMSCs相當的水平,能減輕Piezo1 KO小鼠的骨丟失和骨髓肥胖癥。此外,CCL2基因敲低降低了Lcn2的表達和分泌,而KLF2過表達抑制了KO BMMSCs中CCL2和Lcn2的表達和分泌,進一步支持了KLF2-CCL2-Lcn2信號軸介導Piezo1缺乏引起的小鼠骨丟失和骨髓肥胖的觀點。
為了驗證KLF2-CCL2-Lcn2軸作為Piezo1的下游信號效應器,參與調控骨髓間充質干細胞命運,研究人員利用慢病毒在小鼠體內過表達KLF2或下調CCL2/Lcn2,并在體外BMMSCs已證實該策略的有效性,以及慢病毒脛骨內注射的特異性轉導。在PDGFRα+BMMSCs中恢復KLF2的表達逆轉了Piezo1 KO小鼠的骨體積減少、骨小梁數量減少、骨密度降低、ALP染色的成骨細胞減少、骨小梁分離增加和BMA增加。同樣,在Piezo1缺陷的PDGFRα+BMMSCs中,CCL2或Lcn2被敲低到與WT BMMSCs相當的水平,能減輕Piezo1 KO小鼠的骨丟失和骨髓肥胖癥。此外,CCL2基因敲低降低了Lcn2的表達和分泌,而KLF2過表達抑制了KO BMMSCs中CCL2和Lcn2的表達和分泌,進一步支持了KLF2-CCL2-Lcn2信號軸介導Piezo1缺乏引起的小鼠骨丟失和骨髓肥胖的觀點。
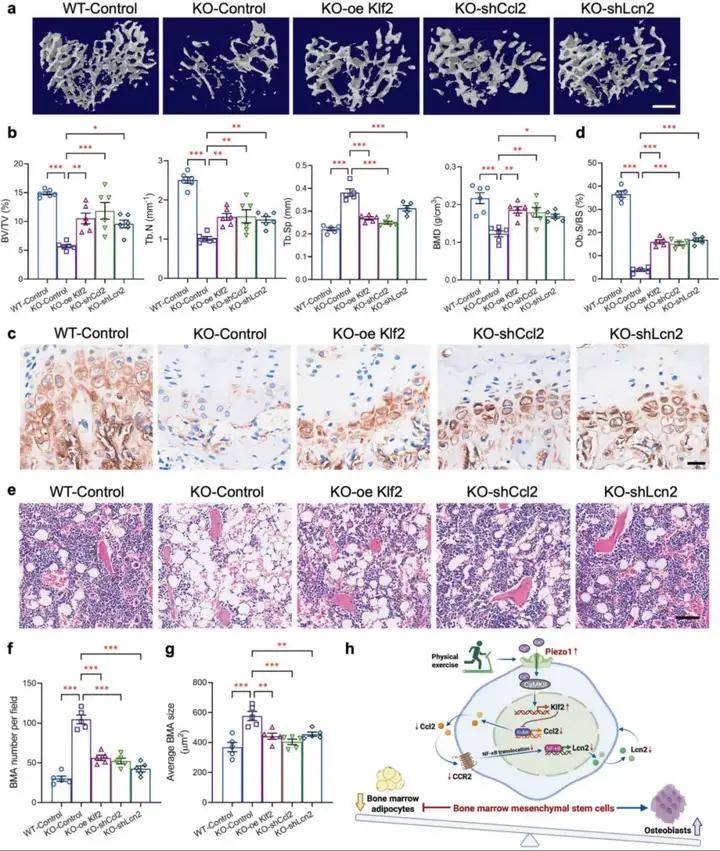
圖3. 體內驗證Piezo1-KLF2-CCL2-Lcn2信號軸在調控骨髓間充質干細胞成骨和成脂
結論
本研究發現機械傳感器Piezo1通過CaMKII/KLF2調節c-jun-CCL2-NF-κB-Lcn2炎癥軸,從而平衡骨髓間充質干細胞的脂肪成骨潛能。機械卸載或Piezo1失活會破壞這種平衡,導致BMMSCs中CCL2-Lcn2自分泌環路過度激活,并促進骨髓脂肪生成,進而導致與衰老或肥胖相關的骨骼和/或代謝疾病。運動通過Piezo1開放和下游激活CaMKII/KLF2途徑來抑制這種自分泌炎癥環路,從而在增加骨密度和減少BMA方面發揮其健康益處。這些數據揭示了機械控制的炎癥在決定骨髓間充質干細胞細胞命運中的關鍵作用,并提出了以Piezo1-c-JunCcl2-NF-κB-Lcn2軸為靶點,作為基于骨髓間充質干細胞治療衰老和肥胖相關慢性疾病的一種有前途的策略的可能性。
本研究發現機械傳感器Piezo1通過CaMKII/KLF2調節c-jun-CCL2-NF-κB-Lcn2炎癥軸,從而平衡骨髓間充質干細胞的脂肪成骨潛能。機械卸載或Piezo1失活會破壞這種平衡,導致BMMSCs中CCL2-Lcn2自分泌環路過度激活,并促進骨髓脂肪生成,進而導致與衰老或肥胖相關的骨骼和/或代謝疾病。運動通過Piezo1開放和下游激活CaMKII/KLF2途徑來抑制這種自分泌炎癥環路,從而在增加骨密度和減少BMA方面發揮其健康益處。這些數據揭示了機械控制的炎癥在決定骨髓間充質干細胞細胞命運中的關鍵作用,并提出了以Piezo1-c-JunCcl2-NF-κB-Lcn2軸為靶點,作為基于骨髓間充質干細胞治療衰老和肥胖相關慢性疾病的一種有前途的策略的可能性。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






