B10通過激活PD-1促進(jìn)骨髓來源巨噬細(xì)胞(BMDM)的極化和促解炎功能
B10 Promotes Polarization and Pro-Resolving Functions of Bone Marrow Derived Macrophages (BMDM) Through PD-1 Activation
Keywords: B10 cells; PD-1; SPMs; macrophage; regulatory B cell.
調(diào)節(jié)性B細(xì)胞(B regs )通過免疫調(diào)節(jié)細(xì)胞因子抑制過度炎癥。值得注意的是,分泌白介素-10(IL-10)的調(diào)節(jié)性B細(xì)胞稱為B10細(xì)胞(B-10),通過IL-10的生成在調(diào)節(jié)免疫反應(yīng)中發(fā)揮關(guān)鍵作用。研究已表明,B-10抑制CD8+ T細(xì)胞增殖,B-10效應(yīng)細(xì)胞的功能可通過MHC classII和CD40與CD4+ T細(xì)胞同源相互作用增強(qiáng)。
巨噬細(xì)胞也是調(diào)節(jié)炎癥狀態(tài)的主要角色。一般來說,促炎巨噬細(xì)胞(M1表型)有促炎介質(zhì)的產(chǎn)生,抵抗微生物病原體并激活適應(yīng)性免疫反應(yīng)。相比之下,促解炎巨噬細(xì)胞(M2表型)極化以防止宿主過度炎癥反應(yīng)并促進(jìn)組織修復(fù)過程。巨噬細(xì)胞還通過中性粒細(xì)胞凋亡中的吞噬作用和特異性促解炎介質(zhì)(SPMs)的分泌對(duì)炎癥的緩解做出關(guān)鍵貢獻(xiàn)。
為了闡明B-10與巨噬細(xì)胞之間的相互作用,研究已探討了兩種細(xì)胞類型之間潛在的配體-受體聯(lián)系。有趣的是,人類CD19+ CD24+ CD38+ B細(xì)胞(B regs 的一個(gè)子集)表現(xiàn)出程序性細(xì)胞死亡配體1(PD-L1)的表達(dá)升高。另一方面,觀察到表達(dá)程序性細(xì)胞死亡受體1(PD-1)的巨噬細(xì)胞表現(xiàn)出M2功能。PD-L1/PD-1軸是參與負(fù)向免疫調(diào)控的關(guān)鍵配體-受體信號(hào)通路。因此,表達(dá)PD-L1的B-10和表達(dá)PD-1的巨噬細(xì)胞之間的串?dāng)_可能通過PD-L1/PD-1的結(jié)合促進(jìn)其炎癥消退功能。
點(diǎn)擊了解:仿生多細(xì)胞動(dòng)態(tài)共培養(yǎng)系統(tǒng)
基于此,美國諾瓦東南大學(xué)牙科學(xué)院口腔科學(xué)與轉(zhuǎn)化研究系團(tuán)隊(duì)探討了B-10是否能通過PD-L1/PD-1連接增強(qiáng)巨噬細(xì)胞促解炎功能。研究表明,B-10增強(qiáng)了M2型巨噬細(xì)胞極化,上調(diào)了PD-1表達(dá),并促進(jìn)了吞噬細(xì)胞活性和特異性SPMs產(chǎn)生等促解炎功能。這種對(duì)巨噬細(xì)胞促解炎功能的誘導(dǎo)需要細(xì)胞間的接觸,尤其是通過PD-1激活。研究成果發(fā)表于 CELLS 期刊題為“B10 Promotes Polarization and Pro-Resolving Functions of Bone Marrow Derived Macrophages (BMDM) Through PD-1 Activation”。

首先,研究了B-10細(xì)胞通過直接細(xì)胞間相互作用影響巨噬細(xì)胞極化的能力。對(duì)BMDMs與B-10進(jìn)行共培養(yǎng),建立四個(gè)實(shí)驗(yàn)組:?jiǎn)为?dú)M0巨噬細(xì)胞(M0)、初始B細(xì)胞與巨噬細(xì)胞(M0 + B)、間接共培養(yǎng)的B-10細(xì)胞與巨噬細(xì)胞(Tr M0 + B-10)、直接共培養(yǎng)的B-10細(xì)胞與巨噬細(xì)胞(M0 + B-10)。共培養(yǎng)48小時(shí)后,流式細(xì)胞術(shù)評(píng)估了各組M1巨噬細(xì)胞(F4/80+/CD86+)和M2巨噬細(xì)胞(F4/80+/CD206+/CD163+)的比例,發(fā)現(xiàn) F4/80+ CD86+ 細(xì)胞的比例在所有條件下無顯著變化。相比之下,與M0組相比,M0 + B-10組中F4/80+ CD206+ CD163+ 細(xì)胞的比例和出現(xiàn)頻率均顯著升高,其他兩組未檢測(cè)到顯著變化。這些結(jié)果表明,B-10細(xì)胞通過細(xì)胞間直接接觸增強(qiáng)M2巨噬細(xì)胞的極化,而不影響M1巨噬細(xì)胞的分化。
隨后,評(píng)估了B-10細(xì)胞與BMDMs共培養(yǎng)是否能增強(qiáng)PD-1表達(dá)。與單獨(dú)M0組相比,M0+B組的PD-1蛋白或mRNA水平未見顯著變化,然而,M0 + B-10組的PD-1表面蛋白和 Pdcd1 mRNA表達(dá)顯著增加,Tr M0 + B-10 組PD-1蛋白水平未顯著增加,但Pdcd1基因表達(dá)明顯下降。這些結(jié)果表明,巨噬細(xì)胞中B-10細(xì)胞對(duì)PD-1的上調(diào)需要直接的細(xì)胞間接觸。
M2巨噬細(xì)胞可進(jìn)一步細(xì)分為四個(gè)亞群:M2a、M2b、M2c和M2d。如前所述,B-10細(xì)胞通過細(xì)胞間直接接觸促進(jìn)M2巨噬細(xì)胞極化。為探究共培養(yǎng)巨噬細(xì)胞中哪些M2亞群相關(guān)的細(xì)胞因子上調(diào),評(píng)估了Il10及多種M2亞群標(biāo)志物的mRNA表達(dá)水平,包括M2a相關(guān)標(biāo)記物Il1rn和Arg1,M2b相關(guān)標(biāo)記物Il1β、Il6、Ccl1,M2c相關(guān)標(biāo)志物Tgfβ,以及M2d相關(guān)標(biāo)記物Vegfα。與M0組相比,M0+B組細(xì)胞因子表達(dá)無顯著差異,Tr M0 + B10組Arg1 mRNA表達(dá)顯著升高(圖1 C),M0 + B-10組在Il10、Il1rn、Arg1、Il6和Ccl1的mRNA水平上顯著升高(圖1 A-C、E、F)。 此外,在比較Tr M0 + B-10和M0 + B-10組時(shí),后者中M2a相關(guān)基因和M2b相關(guān)基因水平顯著升高(圖1 A-C、E、F)。這些結(jié)果表明,直接細(xì)胞間接觸是B-10細(xì)胞調(diào)控M2a和M2b巨噬細(xì)胞因子表達(dá)的關(guān)鍵機(jī)制。

圖1 B-10細(xì)胞增強(qiáng)巨噬細(xì)胞中的M2相關(guān)細(xì)胞因子。
吞噬活性是巨噬細(xì)胞活性的一個(gè)關(guān)鍵促解炎方面,因此,接下來評(píng)估了B-10細(xì)胞是否增強(qiáng)了這一功能。流式細(xì)胞術(shù)數(shù)據(jù)顯示,M0 + B組吞噬細(xì)胞比例無變化,Tr M0 + B-10組的吞噬活性顯著增強(qiáng),而M0 + B-10組表現(xiàn)出顯著更高的吞噬活性。免疫熒光染色結(jié)果顯示,Tr M0 + B-10組和M0 + B-10組的pHrodo™ 生物顆粒陽性細(xì)胞顯著增加,且后者觀察到更多的陽性細(xì)胞。這些結(jié)果表明,B-10細(xì)胞主要通過直接相互作用增強(qiáng)巨噬細(xì)胞吞噬功能。
被B-10細(xì)胞極化的巨噬細(xì)胞通過直接細(xì)胞間接觸表現(xiàn)出PD-1表達(dá)增加和向M2表型轉(zhuǎn)變的趨勢(shì)。然而,該過程中具體的配體-受體相互作用仍不明確。因此,實(shí)驗(yàn)研究了B-10細(xì)胞是否通過巨噬細(xì)胞上的PD-1和B-10細(xì)胞上的PD-L1調(diào)節(jié)促解炎巨噬細(xì)胞的極化。PD-1在PD-1 KO BMDMs 中被降低(圖2 A、B),Pg.-LPS和CpG刺激可增強(qiáng)B-10細(xì)胞上的PD-L1表達(dá)(圖2 C、D)。共培養(yǎng)48小時(shí)后,流式細(xì)胞術(shù)評(píng)估以下各組的M1和M2表型標(biāo)志物:WT M0、WT M0 + B、WT M0 + B10、PD-1 KO M0、PD-1 KO M0 + B,以及PD-1 KO M0 + B10。數(shù)據(jù)顯示,與單獨(dú)PD-1 KO M0相比,WT M0 + B組或WT M0 + B10組F4/80+ CD86+ 細(xì)胞的比例沒有一致的增加,PD-1 KO M0 + B組或 PD-1 KO M0 + B10 組也沒有一致的增加(圖2 E、F)。雖然F4/80+、CD206+和CD163+ 三陽性細(xì)胞數(shù)量在WT M0 + B中與WT M0無顯著差異,但在WT M0 + B10組中顯著增加(圖2 G、H)。然而,與單獨(dú)PD-1 KO M0組相比,PD-1 KO M0 + B組或PD-1 KO M0 + B10組無統(tǒng)計(jì)學(xué)差異(圖2 G、H)。這表明,B-10細(xì)胞與巨噬細(xì)胞之間的PD-L1/PD-1軸對(duì)于誘導(dǎo)M2型巨噬細(xì)胞極化至關(guān)重要。
接著,檢測(cè)了PD-L1/PD-1連接在調(diào)控M2相關(guān)細(xì)胞因子表達(dá)中的作用。野生型(WT)巨噬細(xì)胞與初始B細(xì)胞共孵育,細(xì)胞因子mRNA水平與WT M0對(duì)照組無顯著變化。相比之下,與B-10培養(yǎng)的WT BMDM 組M2a和M2b的基因表達(dá)顯著升高。相反,使用初始B細(xì)胞培養(yǎng)的PD-1 KO巨噬細(xì)胞相比PD-1 KO M0對(duì)照組,CCL1 mRNA水平顯著下降。在與B-10細(xì)胞培養(yǎng)的PD-1 KO巨噬細(xì)胞中,Tgfβ和Vegfα的mRNA水平顯著降低,而Il10、Il6和Ccl1 mRNA水平顯著升高。這說明,B-10細(xì)胞與巨噬細(xì)胞之間的PD-L1/PD-1相互作用主要增強(qiáng)了M2a相關(guān)細(xì)胞因子的產(chǎn)生,而M2b相關(guān)細(xì)胞因子表達(dá)似乎不受PD-L1/PD-1信號(hào)傳導(dǎo)的影響。
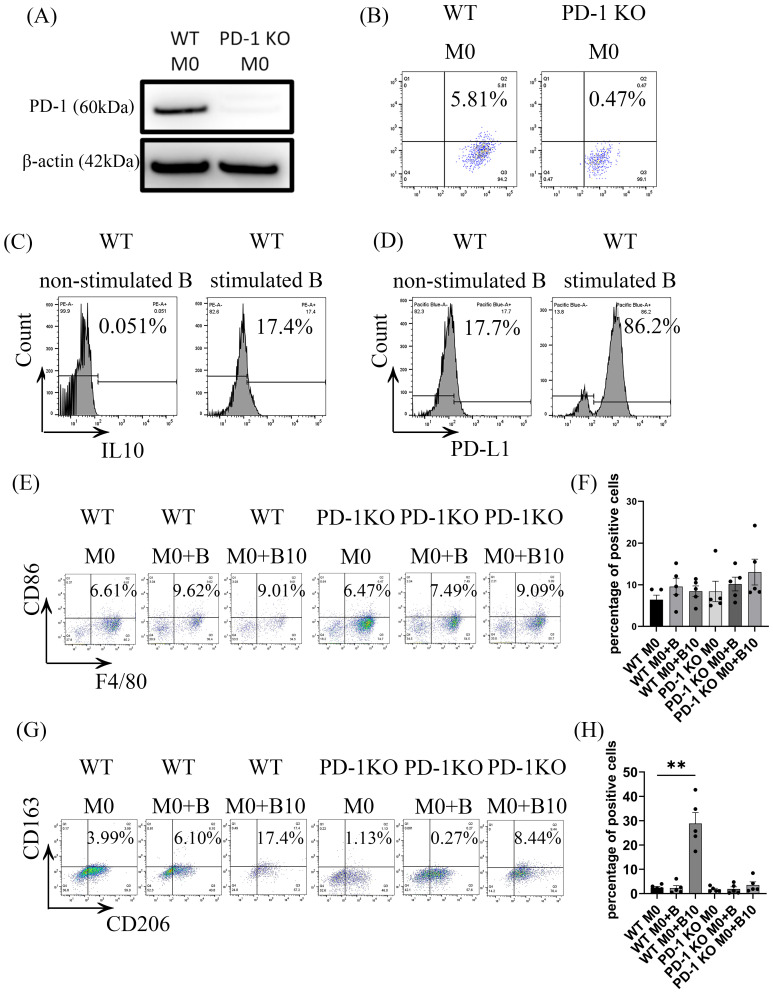
圖2 B-10細(xì)胞通過PD-L1/PD-1連接誘導(dǎo)巨噬細(xì)胞從M0 到M2極化。
進(jìn)一步地,通過在共培養(yǎng)實(shí)驗(yàn)中使用PD-1 KO巨噬細(xì)胞,實(shí)驗(yàn)探討了PD-L1/PD-1信號(hào)對(duì)巨噬細(xì)胞中B-10誘導(dǎo)吞噬作用的影響。與B-10細(xì)胞共培養(yǎng)的WT巨噬細(xì)胞中,吞噬巨噬細(xì)胞的比例顯著增加,但在 WT BMDMs和初始B淋巴細(xì)胞共培養(yǎng)條件下則無顯著增加。相比之下,將PD-1 KO BMDM與初始B淋巴細(xì)胞或B-10共培養(yǎng),吞噬細(xì)胞的比例降低。這些數(shù)據(jù)表明,B-10主要通過PD-L1/PD-1連接促進(jìn)巨噬細(xì)胞吞噬能力。
最后,為評(píng)估B-10細(xì)胞是否通過PD-L1/PD-1信號(hào)驅(qū)動(dòng)SPMs合成,利用液相色譜-串聯(lián)質(zhì)譜(LC-MS/MS)分析了脂質(zhì)組學(xué)。主成分分析(PCA)以二維(圖3 A)和三維(圖3 B)格式呈現(xiàn),揭示了兩個(gè)集群之間不同的SPM特征。一個(gè)簇包括WT M0、WT M0 + B、PD-1 KO M0和PD-1 KO M0 + B,另一個(gè)則包括WT M0 + B10和PD-1 KO M0 + B10,B-10共培養(yǎng)條件與其他組明顯區(qū)分開(圖3 A、B)。熱圖分析顯示,有四個(gè)SPMs——18-羧基二醇LXB4、AT-RvD4、15-腎上腺素LXA4和RvD2——在共培養(yǎng)過程中B-10存在時(shí)明顯高于其他組(圖3 C)。火山圖分析發(fā)現(xiàn),RvD2(圖3 E、H)和15-epi LXA4(圖3 E、I)在WT M0 + B-10中顯著上調(diào)(圖3 D-G)。值得注意的是,這些升高的SPMs(RvD2和15-epi LXA4)在PD-1 KO M0 + B組和PD-1 KO M0 + B10組中缺失(圖3 F、G)。
此外,由于SPM通路涉及15-脂氧酶(15-LOX),因此研究了Alox15基因表達(dá)。與單獨(dú)WT M0相比,WT M0 + B中 Alox15 mRNA水平未顯著變化,但在 WT M0 + B-10中顯著增加,PD-1 KO M0、PD-1 KO M0 + B 和 PD-1 KO M0 + B10 組之間未檢測(cè)到差異(圖3 J)。這些發(fā)現(xiàn)表明,B-10細(xì)胞主要通過PD-L1/PD-1信號(hào)促進(jìn)RvD2和15-epi LXA4的合成,以及Alox15基因表達(dá)。

圖3 B-10細(xì)胞通過PD-L1/PD-1相互作用刺激專門的促解炎介質(zhì)(SPM)合成。
總之,該研究表明,小鼠原級(jí)骨髓來源巨噬細(xì)胞中PD-L1/PD-1的結(jié)合增加了PD-1+ M2巨噬細(xì)胞的數(shù)量,并增強(qiáng)了其吞噬活性和特定SPMs(RvD2和15-epi LXA4)的產(chǎn)生。基于這些觀察,產(chǎn)生IL-10并表達(dá)PD-L1的B-10細(xì)胞有望作為一種新型免疫調(diào)節(jié)療法。特別是,B-10細(xì)胞促進(jìn)與炎癥緩解相關(guān)的巨噬細(xì)胞功能的能力,可能有助于開發(fā)靶向療法。
參考文獻(xiàn):Memida T, Cao G, Dalir Abdolahinia E, Ruiz S, Huang S, Hassantash S, Shindo S, Okamoto M, Yamashita S, Nakamura S, Suzuki M, Kawai T, Han X. B10 Promotes Polarization and Pro-Resolving Functions of Bone Marrow Derived Macrophages (BMDM) Through PD-1 Activation. Cells. 2025 Jun 7;14(12):860. doi: 10.3390/cells14120860. PMID: 40558486; PMCID: PMC12191351.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/40558486/
圖片來源:所有圖片均來源于參考文獻(xiàn)
小編旨在分享、學(xué)習(xí)、交流生物科學(xué)等領(lǐng)域的研究進(jìn)展。如有侵權(quán)或引文不當(dāng)請(qǐng)聯(lián)系小編修正。如有任何的想法以及建議,歡迎聯(lián)系小編。感謝各位的瀏覽以及關(guān)注!進(jìn)入官網(wǎng)www.naturethink.com或關(guān)注“Naturethink”公眾號(hào),了解更多相關(guān)內(nèi)容。
點(diǎn)擊了解:仿生多細(xì)胞動(dòng)態(tài)共培養(yǎng)系統(tǒng)
- B10通過激活PD-1促進(jìn)骨髓來源巨噬細(xì)胞(BMDM)的極化和促解炎功能
- 巨噬細(xì)胞機(jī)械免疫調(diào)節(jié)血管生成和成骨作用影響骨折愈合的再生環(huán)境
- 抑制內(nèi)皮細(xì)胞 Scarb1 可減輕壓力超負(fù)荷誘導(dǎo)的心力衰竭進(jìn)展
- 機(jī)器視覺三維成像技術(shù)簡(jiǎn)介(二)
- 應(yīng)用案例:PPLN驅(qū)動(dòng)的寬帶量子合成器實(shí)現(xiàn)超快壓縮光脈沖源的關(guān)鍵突破
- 達(dá)格列凈對(duì)拉伸誘導(dǎo)創(chuàng)傷性腦損傷模型中胰島素信號(hào)和神經(jīng)元存活的影響
- 急性剪切力在靜脈內(nèi)皮細(xì)胞和人大隱靜脈誘導(dǎo)TWIST介導(dǎo)內(nèi)皮間充質(zhì)轉(zhuǎn)化
- 機(jī)械應(yīng)力誘導(dǎo)心臟成纖維細(xì)胞早衰






