空間組學解析胰腺導管腺癌的靜脈侵犯特征

文章背景
胰腺導管腺癌(PDAC)是最致命的實體瘤之一,患者在確診時往往已發生遠處轉移。研究顯示,約90%的原發胰腺癌存在微觀靜脈侵犯(Venous Invasion, VI),這是腫瘤細胞進入血液、播散至肝臟的關鍵步驟。但令人困惑的是,雖然VI與轉移高度相關,卻并非所有VI的患者都會復發或轉移。
本研究由美國約翰霍普金斯大學團隊完成,首次利用空間轉錄組(GeoMx DSP)和空間蛋白組學(PhenoCycler),系統解析了人類PDAC樣本中靜脈侵犯區域的分子特征,為理解腫瘤血管入侵及轉移提供了全新的空間視角。
研究設計
團隊采用 GeoMx DSP Whole Transcriptome Atlas平臺,利用SMA(α-SMA)標記血管平滑肌層,Desmin標記靜脈平滑肌細胞,PanCK標記腫瘤上皮細胞,實現了對靜脈侵犯部位腫瘤細胞的特異性空間捕獲與全轉錄組分析。
對8位未經治療的 PDAC患者的95個組織區域進行空間轉錄組測序,涵蓋以下四類組織區:
● 正常胰腺導管(ND)
● 胰腺癌間質區(PDAC)
● 神經侵犯區(PNI)
● 靜脈侵犯區(VI)
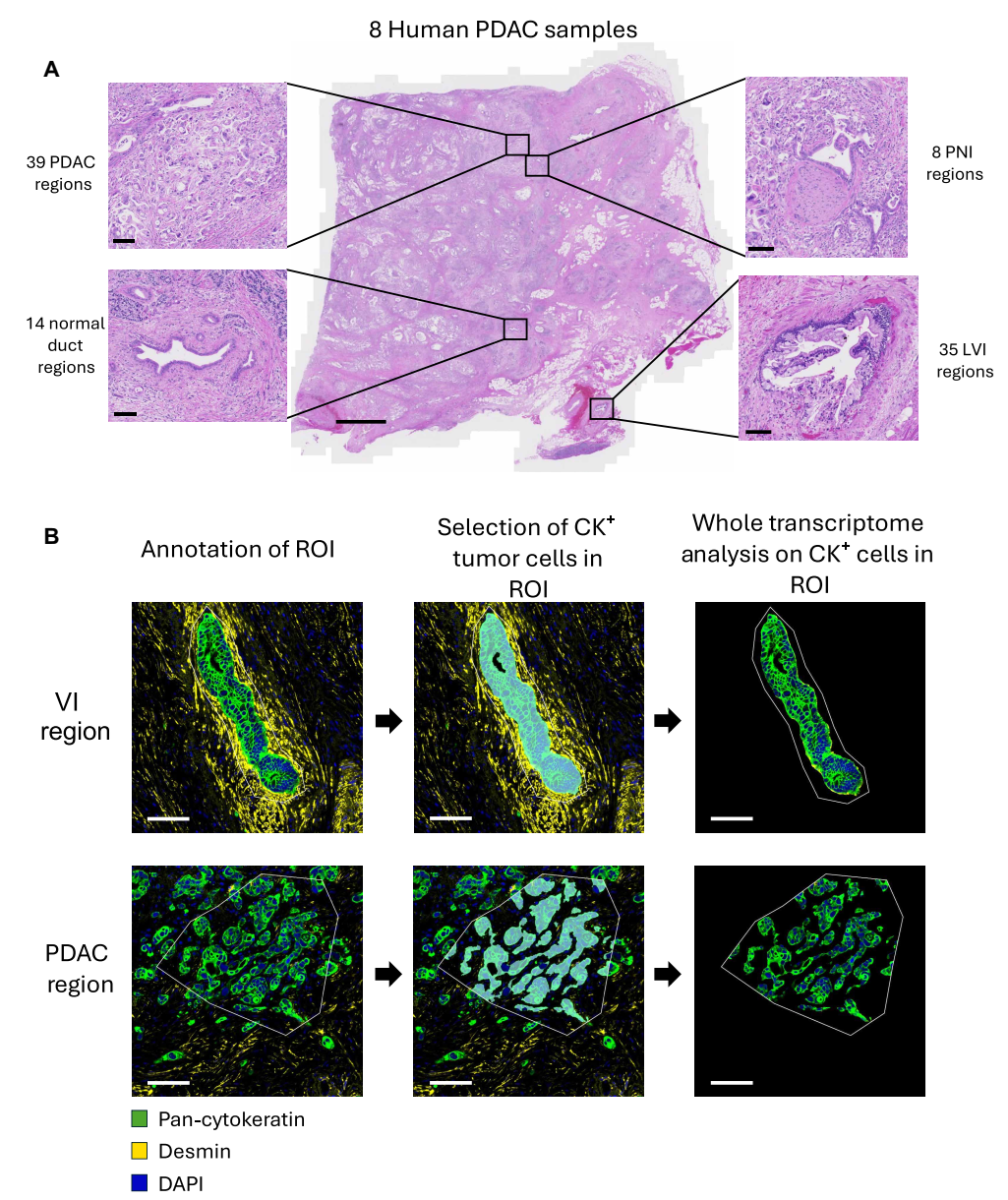
空間轉錄組學對間質和靜脈中的PDAC進行分析
主要發現
1、VI區腫瘤細胞呈上皮化趨勢,分子特征更接近正常導管
主成分分析顯示,VI區腫瘤細胞的基因表達更靠近正常導管,而非腫瘤間質區。VI區上調的基因富集于上皮分化與胰腺外分泌功能相關通路,包括 CFTR、AMY1A、REG1B、GP2 等典型良性上皮標志基因。相反,EMT、侵襲和基質相關基因顯著下調。這些結果表明,靜脈內的腫瘤細胞反而呈現出更上皮化的狀態,提示它們可能通過保持上皮特性的方式實現集體入侵,而非單細胞遷移。
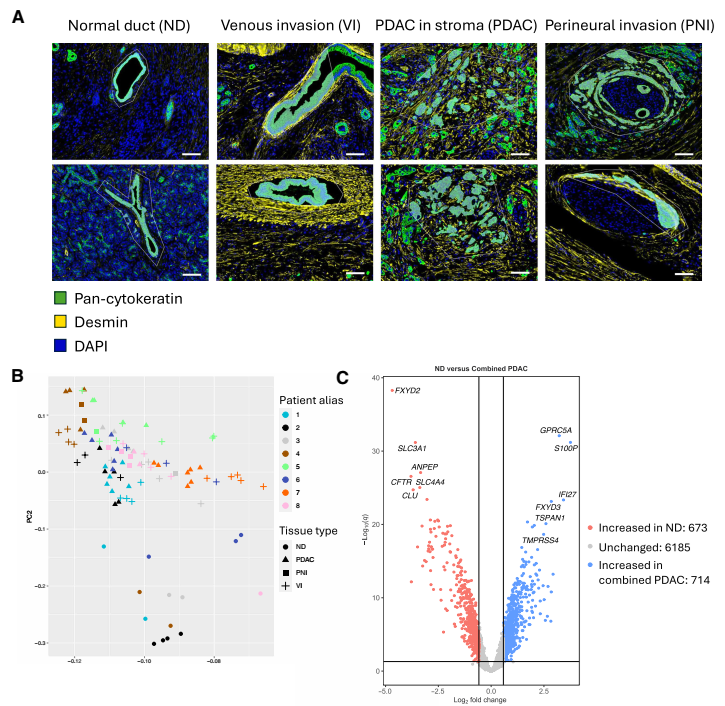 正常胰腺管的轉錄組譜與所有癌癥樣本的轉錄組譜不同
正常胰腺管的轉錄組譜與所有癌癥樣本的轉錄組譜不同
2、VI表達譜對應經典型,而間質PDAC更偏基底型
根據Moffitt亞型分類分析,VI 區富集Classical subtype(GATA6⁺, epithelial-like)基因特征,而PDAC間質區富集Basal-like subtype(KRT17⁺, mesenchymal-like)特征。同一患者體內的不同區域也呈現出這一趨勢:靜脈內癌細胞呈經典型、上皮樣;而間質區癌細胞呈基底型、間充質樣。這一結果揭示了胰腺癌內部存在顯著的空間亞型異質性。
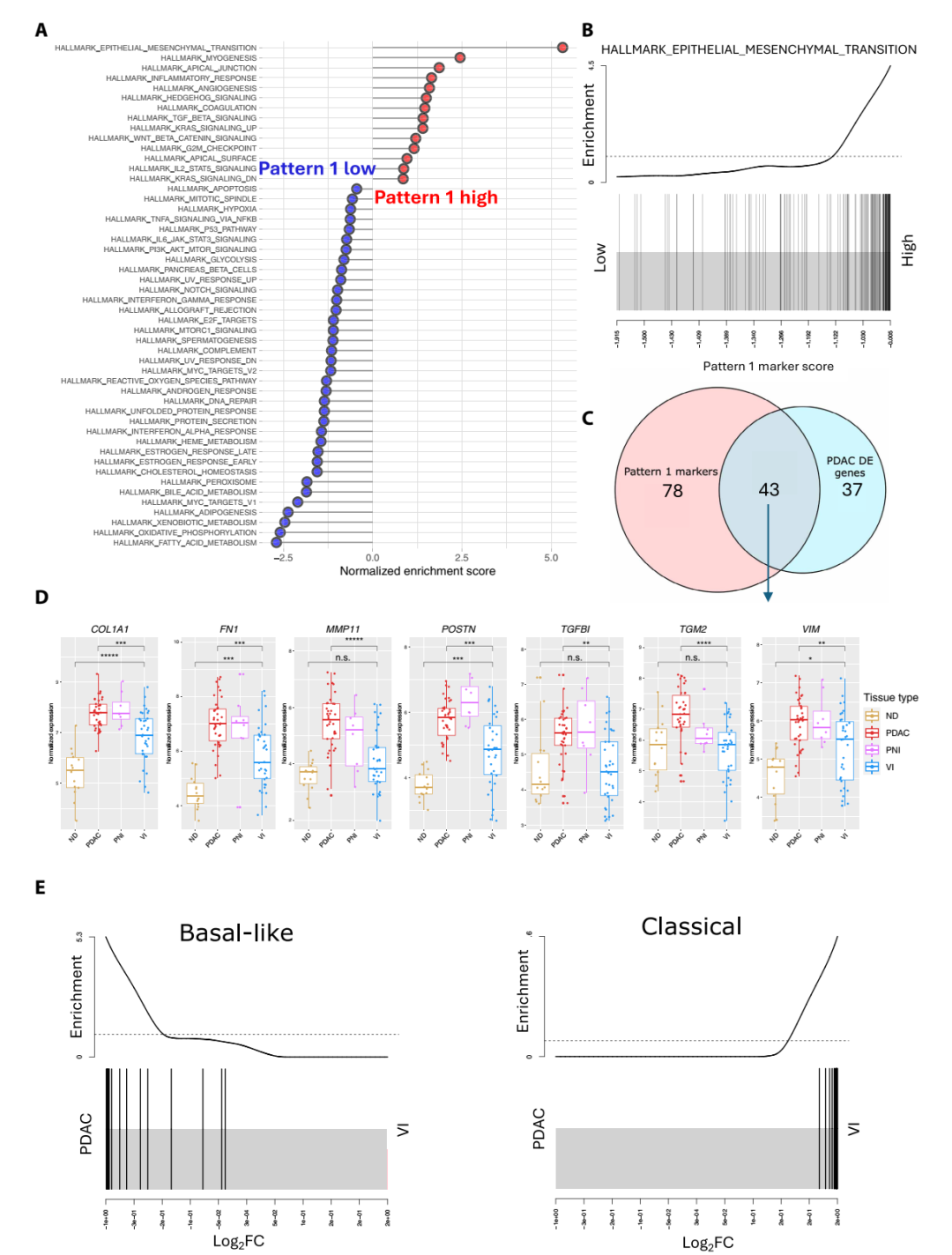 VI表達譜對應經典型,間質PDAC偏基底型
VI表達譜對應經典型,間質PDAC偏基底型
3、不同形態學類型的VI,對應不同的分子特征
研究者進一步將VI分為三類:
VI–IN-like(上皮樣):保留血管結構,形成新腔道
VI–destructive(破壞型):破壞血管壁、伴纖維化
VI–conventional(常規型):腫瘤團塊位于血管腔內
結果發現VI–IN-like富集MYC及氧化磷酸化通路,分子特征偏上皮樣、經典型,而VI–destructive富集EMT與TGFβ通路,更接近基底型、間充質表型。即便存在p53、SMAD4、CDKN2A 等驅動基因差異,這種形態–分子對應關系依然成立。
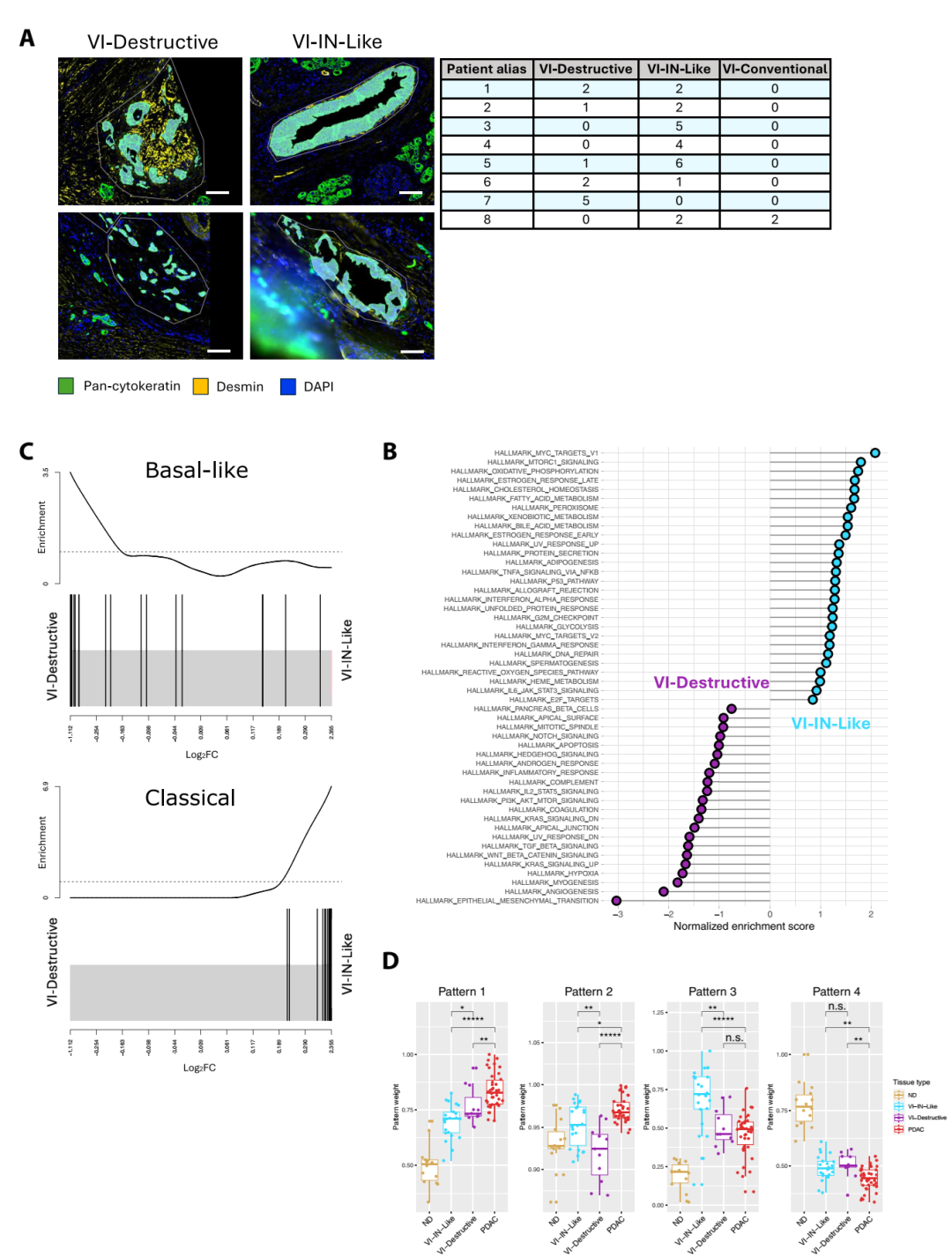 VI的形態亞型對應于獨特的轉錄組特征
VI的形態亞型對應于獨特的轉錄組特征
4、靜脈侵犯并非轉移中間態
當研究團隊將這些VI特征與公開的轉移性PDAC RNA-seq 數據進行比對時,發現轉移灶更接近PDAC間質區,而非靜脈侵犯區。循環腫瘤細胞(CTC)中則同時存在VI和PDAC的特征基因。這意味著,靜脈侵犯中的癌細胞可能代表一種獨立的上皮化侵襲狀態,并非直接等同于轉移播散的分子前體。
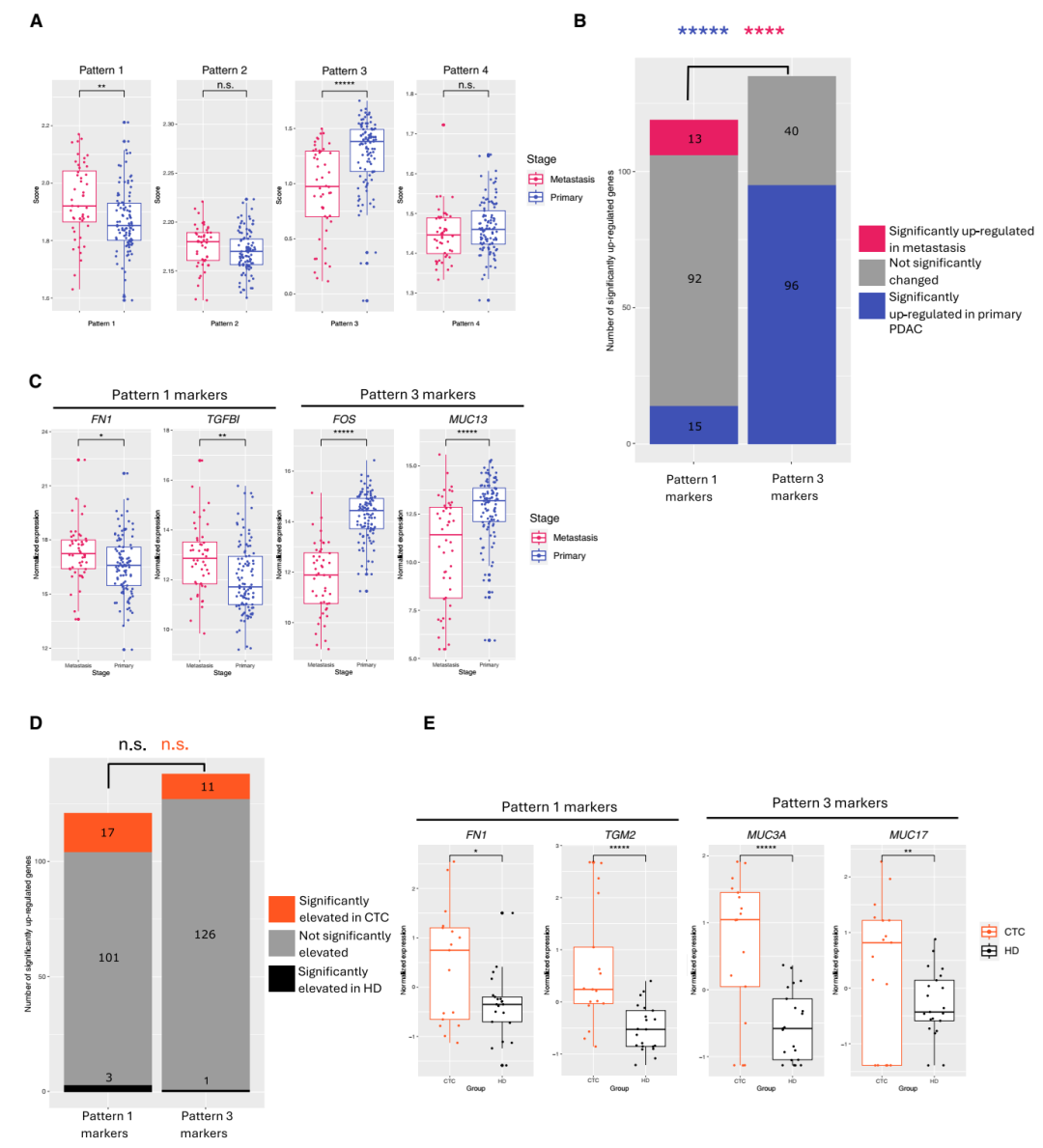 轉移性PDAC與PDAC的相似性大于與VI的相似性
轉移性PDAC與PDAC的相似性大于與VI的相似性
5、蛋白組驗證:VI- IN-like富集CLDN18.2、GATA6、TFF1
在PhenoCycler空間蛋白組分析中,研究者檢測了9個蛋白標志物。結果顯示經典型標志物 GATA6、CLDN18.2、TFF1在VI–IN-like區高表達,基底型標志物KRT17、S100A2在PDAC與VI–destructive中更高。VI 標志蛋白MUC13、CEACAM5則顯著富集于靜脈侵犯區域。這一空間蛋白驗證進一步證實了靜脈侵犯存在形態-分子耦合的細胞狀態異質性。
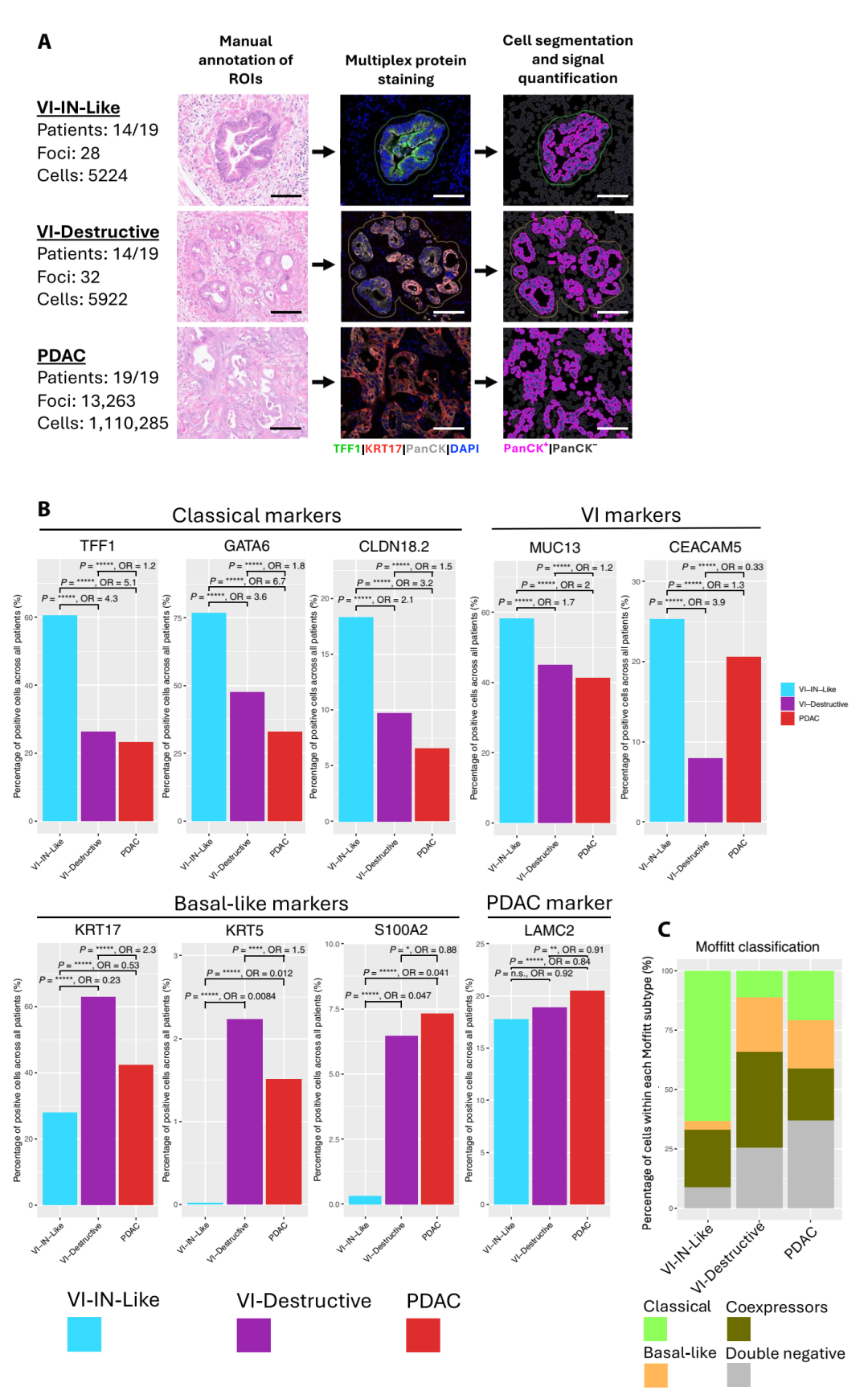 VI-IN-Like顯示PDAC和VI-Destructive之間的蛋白質水平差異表達
VI-IN-Like顯示PDAC和VI-Destructive之間的蛋白質水平差異表達
文章小結
這項研究首次通過空間多組學技術,系統刻畫了胰腺癌靜脈侵犯(VI)的分子特征。研究發現VI區腫瘤細胞呈現上皮化、經典型特征,而非侵襲性更高的基底型。不同形態學類型的VI(IN-like與destructive)對應不同分子狀態。靜脈侵犯并不等同于轉移,而是一個獨立的空間生物學階段。這項研究為理解 PDAC血行靜脈轉移的早期分子事件提供了新視角,并為未來基于空間分型的預后評估與靶向治療策略奠定了基礎。






