USP10去泛素化與自噬偶聯(lián)致心臟鈉通道降解并引發(fā)心律失常的機(jī)制研究
簡(jiǎn)介:
SCN5A基因編碼Nav1.5通道,Nav1.5通道負(fù)責(zé)心肌細(xì)胞動(dòng)作電位(AP)的除極和傳導(dǎo),該通道維持心臟正常的電生理功能。Nav1.5的功能缺失變異會(huì)降低鈉電流密度(INa),并導(dǎo)致心臟傳導(dǎo)阻滯或Brugada綜合征等心律失常。目前對(duì)Nav1.5功能的調(diào)控機(jī)制尚未完全闡明。
基于此,武漢大學(xué)中南醫(yī)院心內(nèi)科魯志兵教授團(tuán)隊(duì)與華中科技大學(xué)生命科學(xué)與技術(shù)學(xué)院王擎教授團(tuán)隊(duì)合作,在Cardiovascular Research發(fā)表題為“Coupling of USP10 de-ubiquitination and chaperone-mediated autophagy causes cardiac sodium channel degradation and cardiac arrhythmias”的研究論文。

本研究旨在鑒定與Nav1.5相互作用的新型蛋白質(zhì)(去泛素化酶USP10),并闡明其對(duì)Nav1.5及心律失常的調(diào)控機(jī)制。
結(jié)論:
作者發(fā)現(xiàn)了一種新型伴侶介導(dǎo)的自噬(CMA)介導(dǎo)的通路,通過與USP10介導(dǎo)的Nav1.5 K430位點(diǎn)去泛素化作用相結(jié)合,調(diào)控Nav1.5的降解,從而導(dǎo)致內(nèi)向鈉電流密度降低和心臟傳導(dǎo)異常。敲低USP10可緩解Scn5a+/−小鼠的心律失常,為治療內(nèi)向鈉電流減少相關(guān)的心律失常提供了新治療策略。
研究結(jié)果:
1. 將USP10鑒定為一種新型Nav1.5-interacting 蛋白,降低心臟鈉電流密度及Nav1.5蛋白表達(dá)
為鑒定Nav1.5的新調(diào)控機(jī)制,研究人員以其胞質(zhì)區(qū)域?yàn)楂C物蛋白,通過GST下拉實(shí)驗(yàn)篩選小鼠心臟蛋白裂解液中的互作蛋白,在−130 kDa位置鑒定出去泛素化酶USP10,質(zhì)譜分析及內(nèi)源性Co-IP實(shí)驗(yàn)均證實(shí)二者互作。進(jìn)一步通過構(gòu)建USP10不同結(jié)構(gòu)域表達(dá)質(zhì)粒,結(jié)合Co-IP和GST下拉實(shí)驗(yàn),明確Nav1.5與USP10的USP結(jié)構(gòu)域而非N端相互作用,純化蛋白實(shí)驗(yàn)驗(yàn)證了該互作的直接性。免疫熒光染色顯示,USP10與Nav1.5在心肌細(xì)胞中共定位。綜上,USP10通過其USP結(jié)構(gòu)域與Nav1.5直接互作。
研究運(yùn)用全細(xì)胞膜片鉗技術(shù)探究USP10對(duì)Nav1.5的調(diào)控:在NRCMs、HEK293/Nav1.5細(xì)胞系及hESC-CMs中,過表達(dá)USP10均顯著降低INa密度,NRCMs中失活曲線偏移而激活曲線無變化,HEK293/Nav1.5中該調(diào)控可被USP10 C424A突變消除,敲低USP10則INa密度升高。表達(dá)檢測(cè)顯示,USP10過表達(dá)降低Nav1.5蛋白總量及質(zhì)膜表達(dá),不影響Scn5a mRNA水平,敲低則提升其蛋白表達(dá),證實(shí)USP10下調(diào)Nav1.5蛋白表達(dá)與INa密度。此外,研究發(fā)現(xiàn)心衰患者心臟中USP10蛋白表達(dá)較健康組顯著增加。
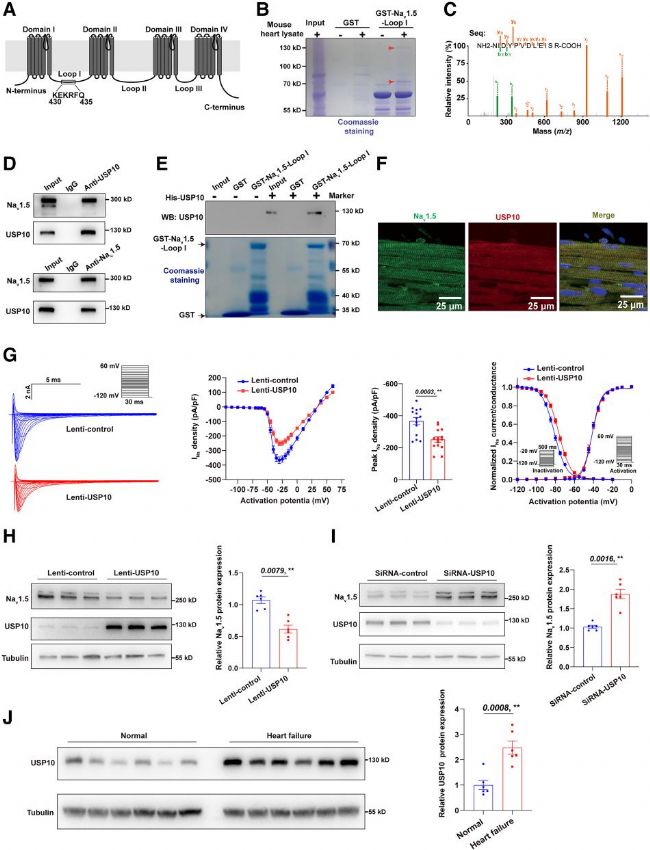
圖1. USP10被鑒定為Nav1.5的新型負(fù)調(diào)控蛋白
2. USP10過表達(dá)導(dǎo)致自發(fā)性心臟傳導(dǎo)異常,并誘導(dǎo)小鼠出現(xiàn)室性心動(dòng)過速
研究通過AAV9病毒遞送系統(tǒng)在小鼠心臟過表達(dá)USP10,經(jīng)qPCR、Western blot及免疫熒光驗(yàn)證,確認(rèn)USP10成功過表達(dá)且感染效率超85%。遙測(cè)心電圖顯示,過表達(dá)小鼠P波持續(xù)時(shí)間、PR及QRS間期顯著延長(zhǎng),出現(xiàn)自發(fā)性竇性停搏和房室傳導(dǎo)阻滯,對(duì)照組無此現(xiàn)象;光學(xué)標(biāo)測(cè)證實(shí)其竇性及起搏模式下激活時(shí)間延長(zhǎng)、傳導(dǎo)速度降低。程序性電刺激實(shí)驗(yàn)表明,過表達(dá)小鼠室性心動(dòng)過速(VT)誘發(fā)率高,對(duì)照組未誘發(fā)。此外,氟卡尼未誘發(fā)VT,兩組6個(gè)月均無自發(fā)性死亡,心功能無顯著差異,綜上USP10過表達(dá)導(dǎo)致小鼠心臟傳導(dǎo)阻滯并誘發(fā)VT。
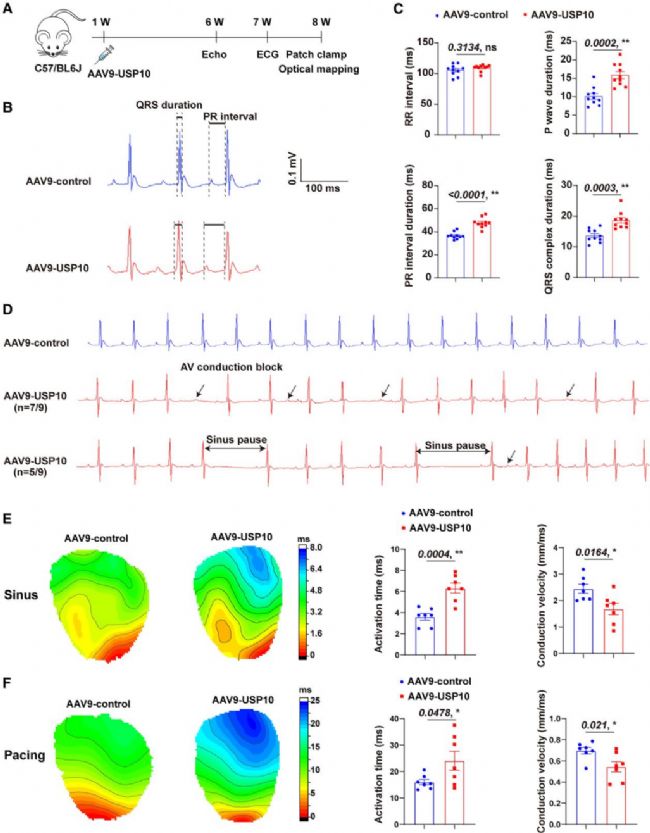
圖2. USP10過表達(dá)導(dǎo)致小鼠心臟傳導(dǎo)阻滯
3. USP10過表達(dá)改變了小鼠INa和ICa-L的密度和APD持續(xù)時(shí)間
研究分離USP10過表達(dá)的小鼠成年心室心肌細(xì)胞,檢測(cè)其離子通道電流與動(dòng)作電位:全細(xì)胞電壓鉗顯示,小鼠心肌細(xì)胞INa密度顯著降低且失活閾正向偏移,晚INa無變化,ICa-L密度降低但激活/失活特性不變,Ito、IK1、Iss無組間差異;在表達(dá)人源鉀通道的HEK293細(xì)胞中,USP10也不影響人類Ito、IKr特性。動(dòng)作電位檢測(cè)發(fā)現(xiàn),靜息膜電位無差異,但APA、Vmax、APD90和APD50均降低,提示INa降低與傳導(dǎo)異常相關(guān),ICa-L減少或致APD降低。此外,USP10過表達(dá)顯著降低小鼠心臟Nav1.5蛋白表達(dá),而相關(guān)心律失常離子通道基因mRNA表達(dá)無差異。
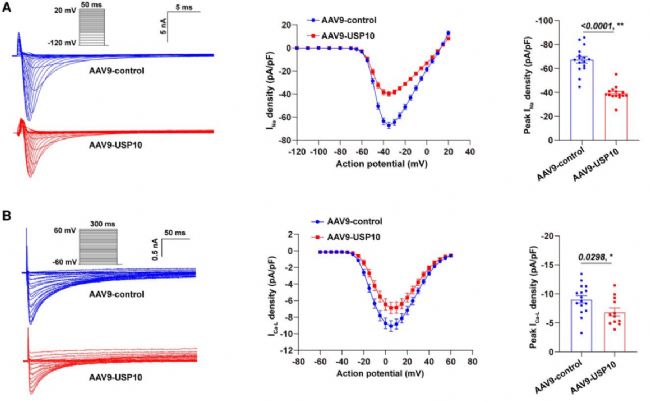
圖3. USP10過表達(dá)改變小鼠離子通道特性
4. 敲低USP10可恢復(fù)Scn5a+/−小鼠的鈉電流減少及心律失常
研究利用CRISPR-Cas9構(gòu)建Scn5a+/−小鼠并注射AAV9-shRNA-USP10或?qū)φ蛰d體,發(fā)現(xiàn)Scn5a+/−小鼠Nav1.5蛋白表達(dá)、INa 及 ICa-L 密度均顯著降低,Ito、IK1、Iss 電流無差異。注射AAV9-shRNA-USP10后,小鼠Nav1.5蛋白表達(dá)、INa 密度回升,ICa-L 密度恢復(fù)至野生型水平,AP參數(shù)也恢復(fù)正常。遙測(cè)心電圖顯示其傳導(dǎo)異常改善,室性早搏消失,證實(shí)體內(nèi)敲低USP10可通過恢復(fù)INa和ICa-L密度,減輕Scn5a+/−小鼠的心臟傳導(dǎo)異常。
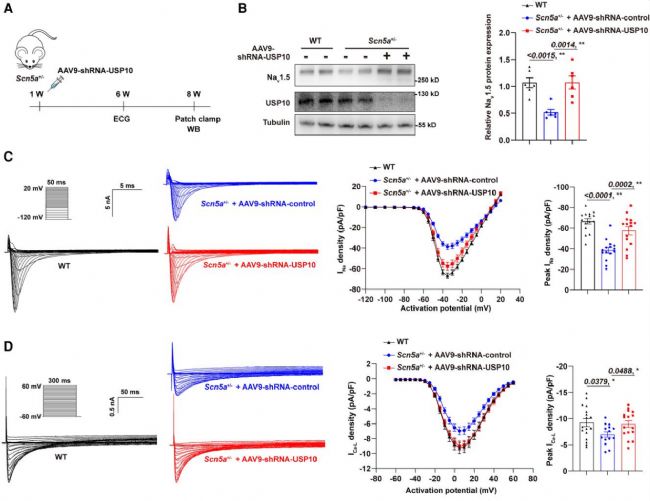
圖4. USP10基因敲除恢復(fù)了Scn5a雜合敲除小鼠中降低的INa和ICal-L
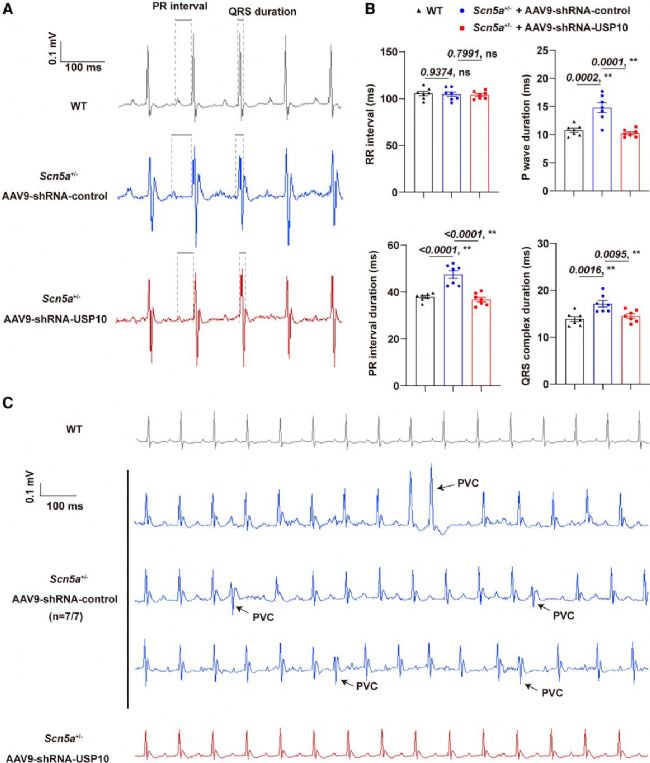
圖5. 使用shRNA敲低USP10可減輕Scn5a+/−小鼠的心律失常
5. USP10通過CMA促進(jìn)Nav1.5降解,Nav1.5基序EKRFQ431—435位于環(huán)I中,參與CMA介導(dǎo)的Nav1.5降解
研究探究USP10降低Nav1.5蛋白表達(dá)的機(jī)制:USP10不影響Scn5a的轉(zhuǎn)錄與翻譯,而是通過降低Nav1.5蛋白穩(wěn)定性促進(jìn)其降解。蛋白酶體抑制劑MG132無作用,巨自噬抑制劑亦不影響,僅自噬抑制劑氯喹可阻斷該效應(yīng),且抑制CMA關(guān)鍵分子LAMP2A或HSC70能阻礙USP10功能,證實(shí)依賴CMA途徑。Co-IP顯示Nav1.5與HSC70相互作用,其環(huán)I的EKRFQ431-435基序?yàn)殛P(guān)鍵結(jié)合位點(diǎn),該基序突變可阻斷互作、恢復(fù)Nav1.5表達(dá)及INa密度,表明Nav1.5是CMA底物,此基序介導(dǎo)其CMA降解。
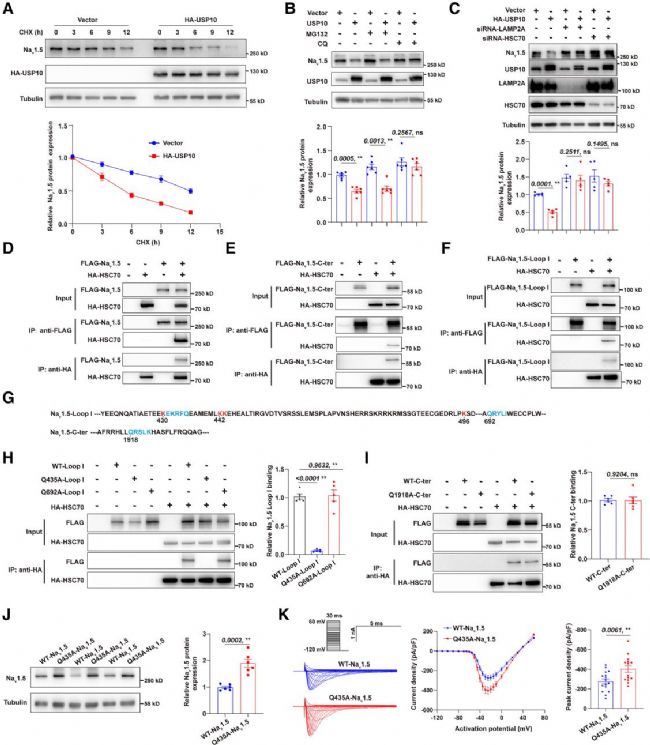
圖6. USP10通過分子伴侶介導(dǎo)的自噬促進(jìn)Nav1.5降解
6. USP10介導(dǎo)的Nav1.5 K430位點(diǎn)去泛素化促進(jìn)Nav1.5的CMA降解
研究探究USP10促進(jìn)Nav1.5的CMA降解機(jī)制:因Nav1.5的 EKRFQ431-435基序緊鄰USP10結(jié)合位點(diǎn)K430,推測(cè)其影響 Nav1.5與HSC70的結(jié)合,實(shí)驗(yàn)證實(shí)過表達(dá)USP10可顯著增強(qiáng)二者結(jié)合。進(jìn)一步發(fā)現(xiàn)USP10 能降低Nav1.5泛素化水平,經(jīng)突變實(shí)驗(yàn)驗(yàn)證,K430是其去泛素化的關(guān)鍵位點(diǎn),K430R突變可阻斷該作用,還能抑制USP10對(duì)Nav1.5表達(dá)及INa密度的下調(diào)效應(yīng),揭示了去泛素化與 CMA偶聯(lián)降解Nav1.5的新機(jī)制。
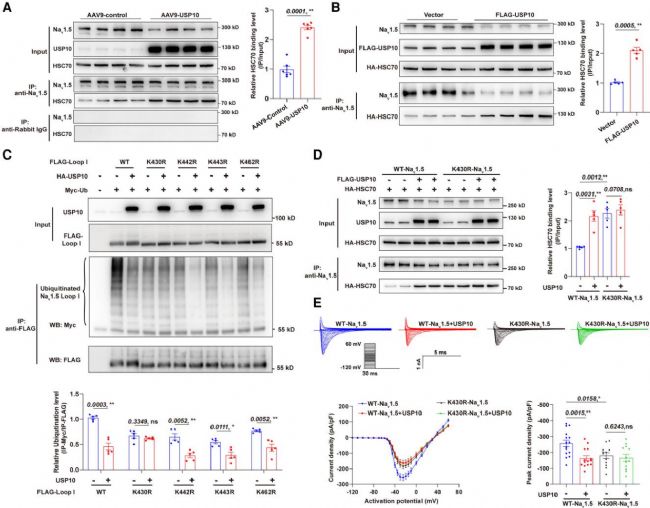
圖7. USP10對(duì)Nav1.5 K430位點(diǎn)的去泛素化作用增強(qiáng)了CMA介導(dǎo)的Nav1.5降解
- 文獻(xiàn)解讀:針對(duì)沙地行走的膝關(guān)節(jié)外骨骼技術(shù)的研發(fā)
- USP10去泛素化與自噬偶聯(lián)致心臟鈉通道降解并引發(fā)心律失常的機(jī)制研究
- 突破設(shè)備協(xié)同壁壘,實(shí)時(shí)自適應(yīng)控制的外骨骼輔助康復(fù)集成系統(tǒng)的研發(fā)
- 微波輻射誘導(dǎo)iPSC-CMs中NF-κB介導(dǎo)的自主炎癥反應(yīng)的時(shí)間研究
- 使用HD-MEA技術(shù)實(shí)現(xiàn)高通量神經(jīng)網(wǎng)絡(luò)篩查以及神經(jīng)元功能性結(jié)構(gòu)解析
- 功能性近紅外光譜fNIRS在揭示精神疲勞神經(jīng)生物標(biāo)志研究中的應(yīng)用
- JAMA子刊文獻(xiàn)解讀:經(jīng)皮耳迷走神經(jīng)刺激治療慢性失眠障礙的研究
- 腦卒中肌電手勢(shì)識(shí)別的深度學(xué)習(xí)方案,從特征構(gòu)建到網(wǎng)絡(luò)設(shè)計(jì)的完整探索
- 科圣科技誠(chéng)聘技術(shù)工程師、商務(wù)助理
- 2025國(guó)際心臟研究學(xué)會(huì)年會(huì)ISHR-CTMWC第二輪通知
- 維拓啟創(chuàng)將攜新產(chǎn)品亮相第三屆體育人工智能大會(huì)
- 東樂自然基因講師招募:全網(wǎng)尋找電生理研究達(dá)人
- 平面微電極陣列與神經(jīng)退行性疾病檢測(cè)分享會(huì)圓滿舉辦
- 東樂成功參展中國(guó)神經(jīng)科學(xué)學(xué)會(huì)第十八屆學(xué)術(shù)會(huì)議
- 2025互聯(lián)網(wǎng)岳麓大會(huì)成功舉辦,康森特生物應(yīng)邀參加
- 平面微電極陣列與神經(jīng)退行性疾病技術(shù)分享會(huì)邀請(qǐng)函






