NETosis中性粒細(xì)胞胞外陷阱的機制、分型特征與在腫瘤研究中的價值
中性粒細(xì)胞作為機體固有免疫系統(tǒng)的核心組成部分,傳統(tǒng)認(rèn)知聚焦于其吞噬病原體、介導(dǎo)炎癥反應(yīng)的防御功能。而近年來研究發(fā)現(xiàn),中性粒細(xì)胞可通過一種特殊的細(xì)胞應(yīng)答方式——NETosis(中性粒細(xì)胞胞外陷阱形成)釋放網(wǎng)狀結(jié)構(gòu),在腫瘤微環(huán)境中扮演著“雙面角色”。這種由DNA與活性蛋白構(gòu)成的胞外陷阱,既可能參與抗腫瘤免疫,更常被腫瘤細(xì)胞“劫持”,成為促進腫瘤進展、轉(zhuǎn)移及血管生成的關(guān)鍵推手。本文將系統(tǒng)梳理NETosis的核心機制、分型特征及其在腫瘤領(lǐng)域的研究進展,為相關(guān)科研與轉(zhuǎn)化應(yīng)用提供參考。
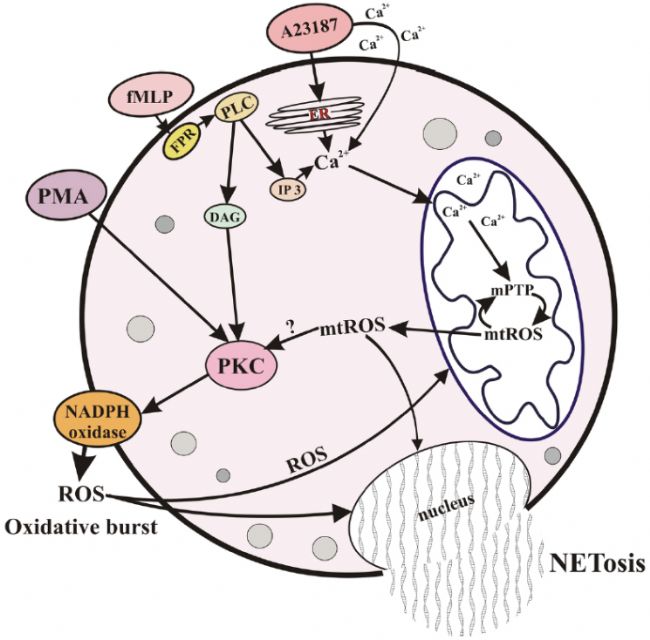
NETosis誘發(fā)機制示意圖
Vorobjeva NV, Chernyak BV. NETosis: Molecular Mechanisms, Role in Physiology and Pathology. Biochemistry (Mosc). 2020 Oct;85(10):1178-1190.
doi: 10.1134/S0006297920100065. PMID: 33202203; PMCID: PMC7590568.
一、NETosis的核心特征與分型機制
NETosis是中性粒細(xì)胞區(qū)別于凋亡和壞死的獨特生物學(xué)過程,其核心產(chǎn)物為中性粒細(xì)胞胞外陷阱(NETs)——以染色質(zhì)DNA為骨架,鑲嵌髓過氧化物酶(MPO)、中性粒細(xì)胞彈性酶(NE)、基質(zhì)金屬蛋白酶9(MMP9)等多種活性蛋白的網(wǎng)狀復(fù)合物。根據(jù)細(xì)胞存活狀態(tài)與信號通路差異,NETosis主要分為兩種核心分型:
(一)經(jīng)典途徑:自殺型NETosis(Suicidal NETosis)
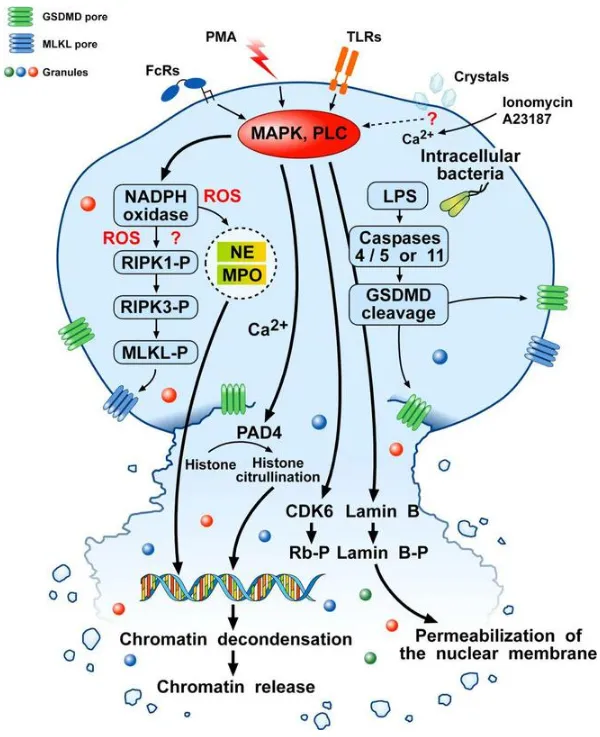
Suicidal NETosis機制示意圖
Fang Q, Stehr AM, Naschberger E, Knopf J, Herrmann M, Stürzl M. No NETs no TIME: Crosstalk between neutrophil extracellular traps and the tumor immune microenvironment. Front Immunol. 2022 Dec 23;13:1075260. doi: 10.3389/fimmu.2022.1075260. PMID: 36618417; PMCID: PMC9816414.
該途徑以中性粒細(xì)胞死亡為代價,是NETs形成的主要方式。其核心機制如下:
- 胞外刺激(如PMA、LPS、細(xì)菌等)激活胞內(nèi)絲裂原活化蛋白激酶(MAPK)和蛋白激酶C(PLC),通過Raf-MEK-ERK-MAP激酶通路與PKC通路放大信號;
- 信號下游引發(fā)NADPH氧化酶激活,產(chǎn)生活性氧(ROS),進而激活受體交互蛋白激酶3(RIPK3)和混合系激酶域樣蛋白(MLKL),啟動程序性死亡;
- ROS同時激活NE和MPO,增強核膜通透性并促進染色質(zhì)解凝,核內(nèi)Ca²⁺依賴的肽基精氨酸脫氨酶4(PAD4)介導(dǎo)組蛋白瓜氨酸化,進一步推動染色體解聚;
- CDK4/6、網(wǎng)膜母細(xì)胞瘤蛋白(Rb-P)和核纖層B(lamin B)介導(dǎo)核膜破裂,LPS激活的Caspases4/5或Caspases11促進成孔蛋白Gasdermin D(GSDMD)引發(fā)質(zhì)膜破裂,DNA-蛋白質(zhì)復(fù)合物釋放形成NETs,最終中性粒細(xì)胞死亡。
(二)非經(jīng)典途徑:活力型NETosis(Vital NETosis)
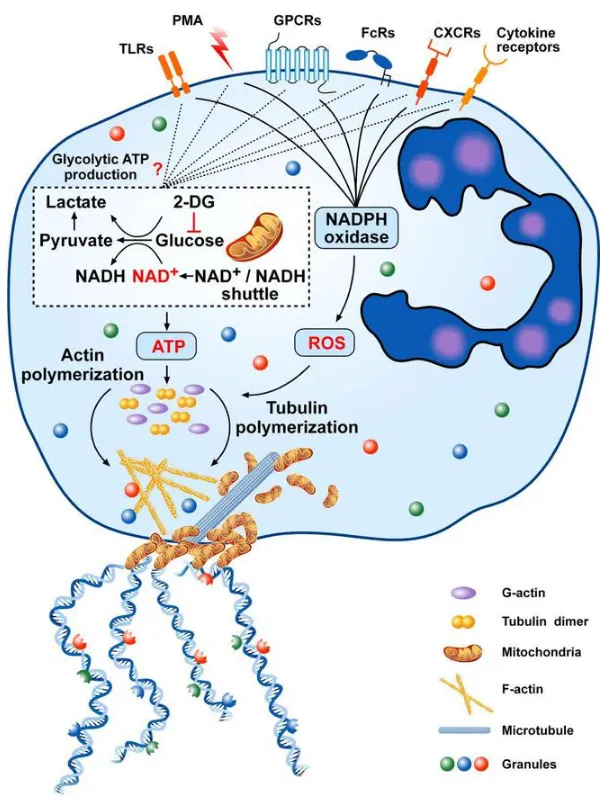
Vital NETosis機制示意圖
Fang Q, Stehr AM, Naschberger E, Knopf J, Herrmann M, Stürzl M. No NETs no TIME: Crosstalk between neutrophil extracellular traps and the tumor immune microenvironment. Front Immunol. 2022 Dec 23;13:1075260. doi: 10.3389/fimmu.2022.1075260. PMID: 36618417; PMCID: PMC9816414.
該途徑的核心特征是中性粒細(xì)胞釋放NETs后仍保持存活,核膜與質(zhì)膜結(jié)構(gòu)完整,可繼續(xù)發(fā)揮炎癥調(diào)控功能:
- 胞外刺激(如細(xì)胞因子、GPCRs激活等)觸發(fā)PAD4活化,無需NADPH氧化酶復(fù)合物參與;
- PAD4介導(dǎo)組蛋白瓜氨酸化與染色質(zhì)去凝集,形成的DNA-蛋白質(zhì)復(fù)合物被包裹于囊泡中; 囊泡與細(xì)胞膜融合后將復(fù)合物排出胞外,形成NETs,中性粒細(xì)胞保留無核細(xì)胞質(zhì),維持后續(xù)生物學(xué)功能;
- 該過程依賴糖酵解提供ATP,伴隨肌動蛋白與微管蛋白聚合,保障囊泡運輸與NETs釋放。
兩種分型的關(guān)鍵差異在于是否伴隨細(xì)胞死亡、是否依賴NADPH氧化酶及ROS產(chǎn)生,其選擇取決于刺激信號類型與微環(huán)境狀態(tài),共同構(gòu)成中性粒細(xì)胞的功能調(diào)控網(wǎng)絡(luò)。
二、腫瘤相關(guān)中性粒細(xì)胞(TANs)與NETosis的功能關(guān)聯(lián)
腫瘤微環(huán)境(TME)募集的中性粒細(xì)胞被稱為腫瘤相關(guān)中性粒細(xì)胞(TANs),其具有高度可塑性,可分為抗腫瘤表型(N1)與促腫瘤表型(N2),而NETosis主要由N2型TANs介導(dǎo),成為其促癌功能的核心執(zhí)行機制:
(一)TANs的表型特征與NETosis調(diào)控
- N1型TANs高表達(dá)TNFα、CCL3和ICAM-1,低表達(dá)精氨酸酶,通過產(chǎn)生ROS、MPO等細(xì)胞毒性介質(zhì)殺傷腫瘤細(xì)胞,其NETosis活性受抑制;
- N2型TANs上調(diào)CCL2、CXCL1、CXCL8等趨化因子,高表達(dá)VEGF、MMP9等促癌分子,在腫瘤趨化因子誘導(dǎo)下大量活化并發(fā)生NETosis;
- 干擾素β(IFN-β)可誘導(dǎo)N1型TANs向N2型轉(zhuǎn)化,增強NETs生成,而分泌性糖蛋白HRG等分子可通過結(jié)合TANs表面的FCγR1,抑制其募集與NETosis活性。
(二)NETs的促癌功能機制
NETs通過多重途徑參與腫瘤進展,其核心機制包括:
- 促進血管生成:NETs中的活性蛋白可刺激內(nèi)皮細(xì)胞增殖、遷移及小管形成,上調(diào)ANGPT2等血管生成相關(guān)分子,激活A(yù)KT/mTOR信號通路,在胃癌等腫瘤中已證實NETs浸潤與微血管密度正相關(guān);
- 加速腫瘤轉(zhuǎn)移:NETs的網(wǎng)狀結(jié)構(gòu)可捕獲循環(huán)腫瘤細(xì)胞,減少其凋亡,同時降解細(xì)胞外基質(zhì)(ECM),為腫瘤細(xì)胞侵襲開辟通道,在肝癌肺轉(zhuǎn)移模型中,抑制NETosis可顯著降低轉(zhuǎn)移灶形成率;
- 調(diào)控腫瘤壞死:在惡性黑色素瘤中,NETs可誘導(dǎo)腫瘤細(xì)胞鐵死亡,導(dǎo)致轉(zhuǎn)移灶壞死增加,且NETs浸潤程度與轉(zhuǎn)移灶大小高度相關(guān);
- 重塑免疫微環(huán)境:NETs可抑制抗腫瘤免疫細(xì)胞活性,促進免疫抑制性微環(huán)境形成,削弱機體對腫瘤的免疫監(jiān)視。
三、NETosis在不同腫瘤中的研究進展
NETosis的促癌作用已在多種腫瘤中得到驗證,其功能具有腫瘤類型特異性,為精準(zhǔn)靶向治療提供了方向:
(一)胃癌:血管生成的關(guān)鍵驅(qū)動因素

胃癌組織中存在廣泛的TANs浸潤與NETs生成,且與患者不良預(yù)后相關(guān)。體外實驗證實,NETs可促進胃癌細(xì)胞侵襲、轉(zhuǎn)移及上皮間質(zhì)轉(zhuǎn)化(EMT),并刺激內(nèi)皮細(xì)胞釋放組織因子激活凝血途徑;體內(nèi)小鼠皮下荷瘤模型顯示,NETs可顯著增強腫瘤血管生成,蛋白質(zhì)組學(xué)研究已篩選出多個NETs調(diào)控內(nèi)皮細(xì)胞功能的差異表達(dá)蛋白,為開發(fā)抗血管生成新靶點提供了依據(jù)。
(二)肝癌:肺轉(zhuǎn)移的重要調(diào)控介質(zhì)

肺轉(zhuǎn)移是肝細(xì)胞癌(HCC)死亡的主要原因,NETs在肝癌轉(zhuǎn)移前生態(tài)位形成中發(fā)揮關(guān)鍵作用。研究發(fā)現(xiàn),肝癌細(xì)胞分泌的趨化因子可募集中性粒細(xì)胞至肺部,誘導(dǎo)NETs生成,為腫瘤細(xì)胞定植創(chuàng)造條件;而HRG蛋白可通過FCγR1抑制中性粒細(xì)胞募集與NETosis,顯著減少肝癌肺轉(zhuǎn)移,證實NETosis是肝癌轉(zhuǎn)移的可靶向調(diào)控節(jié)點。
(三)惡性黑色素瘤:壞死與預(yù)后的關(guān)聯(lián)標(biāo)志物

黑色素瘤轉(zhuǎn)移灶中TANs浸潤與不良預(yù)后相關(guān),NETs水平與轉(zhuǎn)移灶大小、壞死程度高度相關(guān)。機制研究表明,中性粒細(xì)胞被募集至壞死腫瘤部位后,通過NETs誘導(dǎo)腫瘤細(xì)胞鐵死亡,加劇組織壞死;抑制NETosis可驅(qū)使TANs向N1型轉(zhuǎn)化,抑制腫瘤生長,提示NETs可作為黑色素瘤免疫治療之外的潛在靶點。
四、中性粒細(xì)胞研究相關(guān)因子檢測服務(wù)哪個公司有?
NETosis 作為腫瘤微環(huán)境中調(diào)控腫瘤進展的關(guān)鍵機制,其分型特征、分子邏輯及促癌功能的深入探索,離不開多維度技術(shù)平臺的支撐與系統(tǒng)化科研服務(wù)的保障。LabEx 作為專注于生物標(biāo)志物發(fā)現(xiàn)的一站式服務(wù)平臺,憑借多因子檢測、單細(xì)胞多組學(xué)、DSP 空間多組學(xué)、免疫組化等 30 + 核心技術(shù),以及累計 100 萬 + 樣本的檢測經(jīng)驗,可為 NETosis 相關(guān)研究提供從分子機制驗證、腫瘤組織標(biāo)志物篩選到臨床樣本關(guān)聯(lián)分析的全流程支持。無論是 NETs 相關(guān)因子的高通量定量、TANs 亞群的單細(xì)胞解析,還是腫瘤組織中 NETs 的空間定位與功能關(guān)聯(lián),LabEx 均能以標(biāo)準(zhǔn)化操作與專業(yè)數(shù)據(jù)分析,助力科研人員高效挖掘核心機制、篩選潛在靶點。未來,LabEx 將持續(xù)秉持專業(yè)嚴(yán)謹(jǐn)?shù)姆⻊?wù)理念,以全面的技術(shù)體系與深厚的行業(yè)積淀,為 NETosis 及腫瘤免疫相關(guān)研究提供精準(zhǔn)賦能,推動基礎(chǔ)科研向臨床轉(zhuǎn)化的關(guān)鍵突破,為腫瘤精準(zhǔn)治療研究添磚加瓦。
樂備實是國內(nèi)專注于提供高質(zhì)量蛋白檢測以及組學(xué)分析服務(wù)的實驗服務(wù)專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務(wù)技術(shù)平臺已擴展到單細(xì)胞測序、空間多組學(xué)、流式檢測、超敏電化學(xué)發(fā)光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學(xué)等30多個,建立起了一套涵蓋基因、蛋白、細(xì)胞以及組織水平實驗的完整檢測體系。
- 間充質(zhì)干細(xì)胞的特點、機制、功能、在疾病研究中的應(yīng)用及常見疑問解答
- 小膠質(zhì)細(xì)胞在體外細(xì)胞模型、體內(nèi)動物模型及體內(nèi)成像技術(shù)研究中的作用
- 文獻解讀:PCSK9通過LIN28A/HES5/JMY軸引發(fā)神經(jīng)管畸形的研究
- NETosis中性粒細(xì)胞胞外陷阱的機制、分型特征與在腫瘤研究中的價值
- HepG2、SMMC-7721、Hep3B、Huh-7肝癌細(xì)胞系培養(yǎng)合集
- HCT116、HT-29、SW620、LoVo結(jié)腸癌細(xì)胞系培養(yǎng)合集
- 巨噬細(xì)胞的微環(huán)境調(diào)控機制、研究新技術(shù)及在疾病治療中的應(yīng)用
- 大鼠腦間質(zhì)細(xì)胞DITNC1培養(yǎng)使用說明書






