使用HD-MEA技術實現高通量神經網絡篩查以及神經元功能性結構解析
高密度微電極陣列(HD-MEA)相比傳統電生理(如膜片鉗)或低密度微電極陣列,具備三大核心優勢:
高時空分辨率與大規模并行記錄: HD-MEA芯片擁有數千個緊密排列的電極,能同時從數百個神經元記錄毫秒級的電活動。
非侵入性長期功能追蹤: 該技術無需穿透細胞,可對同一批神經元網絡進行數周至數月的長期觀察。
功能性結構成像: HD-MEA獨有的軸突追蹤功能,可以通過分析動作電位在電極陣列上的傳播路徑和時間,反向推算出神經元的形態特征,如軸突長度和傳導速度。
這三大核心優勢使得HD-MEA能夠同時實現高通量網絡篩查與單神經元功能性結構解析,本次論文解讀介紹一個充分利用其 “高通量網絡篩查與單神經元解析” 優勢的典型案例,供大家參考。

論文的標題為“Human iPSC-derived glutamatergic neurons with pathogenic KCNQ2 variants display hyperactive bursting phenotypes”,由美國波士頓兒童醫院Mustafa Sahin教授團隊與加拿大多倫多病童醫院Stephen W. Scherer教授團隊于2025年9月25日在《Neurobiology of Disease》(IF2024=5.1)期刊上聯合發表。研究揭示了攜帶不同致病性KCNQ2變異的人源誘導多能干細胞衍生的谷氨酸能神經元均表現出網絡高興奮性表型。通過CRISPR-Cas9構建等基因對照并結合HD-MEA分析,發現特定變異(如G256W)可導致神經突生長異常與傳導速度加快,且其電刺激誘導的高興奮性可被鉀通道開放劑瑞替加濱(retigabine)逆轉。該研究為理解KCNQ2相關腦病的細胞機制及開發精準療法提供了重要的人源神經元模型與表型依據。
研究主要結果
本研究從三名攜帶不同KCNQ2致病性變異(L292_L293delinsPF、G256W、T274M)的患者獲取成纖維細胞(Fig. 1),重編程為iPSC,利用CRISPR-Cas9構建等基因對照。將iPSC分化為谷氨酸能神經元,通過神經突生長分析、RNA-seq、免疫熒光、微電極陣列(MEA)等功能測試,系統評估變異對神經元結構與功能的影響。
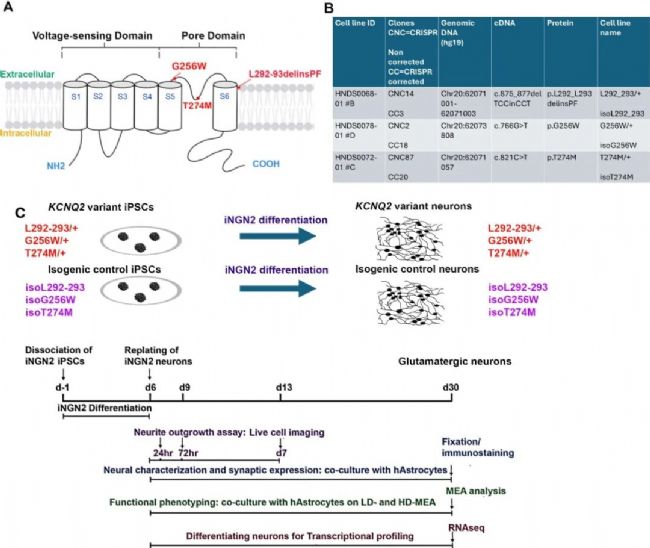
Fig. 1:
A: KCNQ2通道結構及三個變異位點示意圖。
B: 細胞系信息表,包括變異類型與CRISPR校正后命名。
C: iPSC分化為iNGN2神經元的時間線與實驗設計。
1、神經元形態學改變:KCNQ2變異導致神經突增長
在iPSC分化的谷氨酸能神經元中,兩個KCNQ2變異系(T274M/+ 和 G256W/+)在接種后24小時和72小時表現出顯著更長的神經突長度(Fig. 2)。至第7天,僅G256W/+仍保持顯著增長,而L292_L293delinsPF/+未顯示差異。
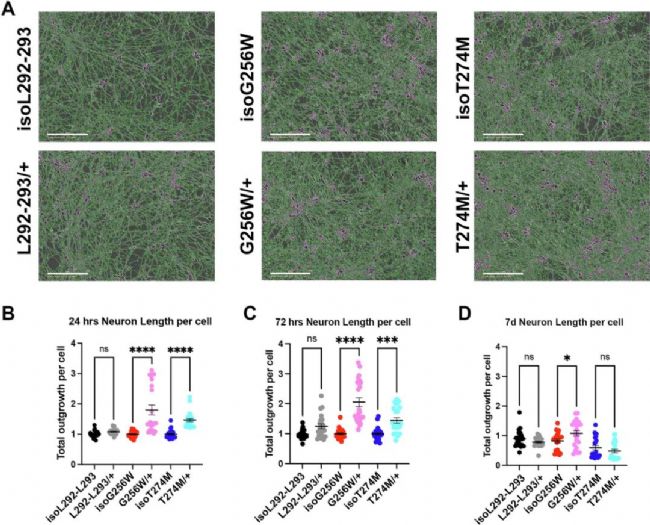
Fig. 2:
神經突生長分析:G256W/+ 和 T274M/+ 在24h、72h和7天時神經突長度顯著增加,L292_L293delinsPF/+ 無差異。
2、轉錄組分析:鉀通道及相關基因表達異常
RNA-seq顯示,L292_L293delinsPF/+ 和 T274M/+ 中KCNN1表達上調,T274M/+ 中KCNQ5下調,G256W/+ 中HCN1下調(Fig. 3)。共鑒定出9個在三系中共同差異表達的基因,如CHCHD2、DNAH9等。
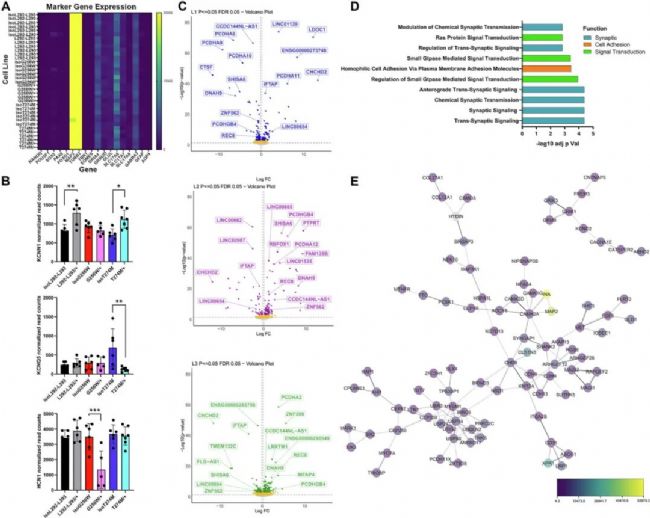
Fig. 3:
A: 神經元與突觸標記物表達熱圖。
B: 鉀通道基因表達差異。
C: 三組變異系與對照的差異表達基因火山圖。
D-E: WGCNA與GO分析顯示突觸傳遞、細胞粘附等通路富集。
3、突觸標記物表達增加
在分化第30天,L292_L293delinsPF/+ 和 T274M/+ 的MAP2陽性神經突上SYN1/PSD95雙陽性突觸點數顯著增加(Fig. 4),而G256W/+無顯著差異。
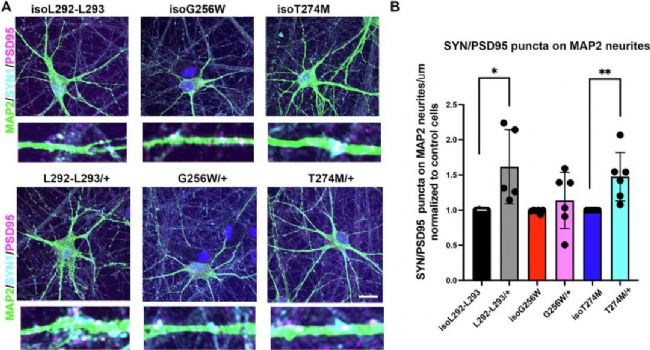
Fig. 4:
SYN1/PSD95免疫熒光顯示L292_L293delinsPF/+ 和 T274M/+ 突觸點數增加。
4、MEA揭示神經元網絡功能亢進
在微電極陣列(MEA)記錄中,所有三個KCNQ2變異系的爆發持續時間均顯著增加(Fig. 5)。L292_L293delinsPF/+ 和 T274M/+ 還表現出更高的網絡爆發頻率、同步性指數和每個爆發中的尖峰數。
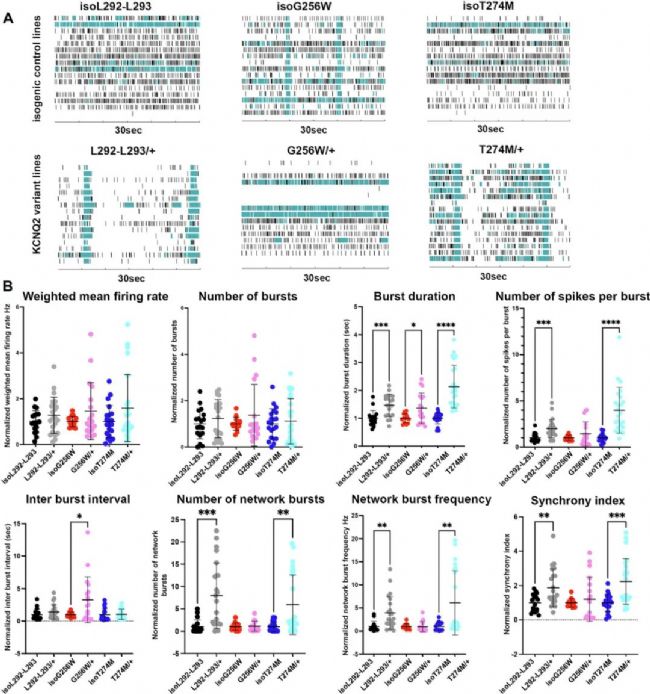
Fig. 5:
MEA記錄顯示所有變異系爆發持續時間增加,L292_L293delinsPF/+ 和 T274M/+ 網絡爆發頻率、同步性等指標上升。
5、MEA揭示單神經元功能異常
接下來利用Maxwell MEA特有的axon tracking功能來檢測神經元的軸突功能(Fig. 6),結果顯示,G256W/+ 神經元的傳導速度顯著增加,T274M/+ 的傳導速度下降,且其起始點振幅降低。G256W/+ 的總神經突長度也顯著增加。
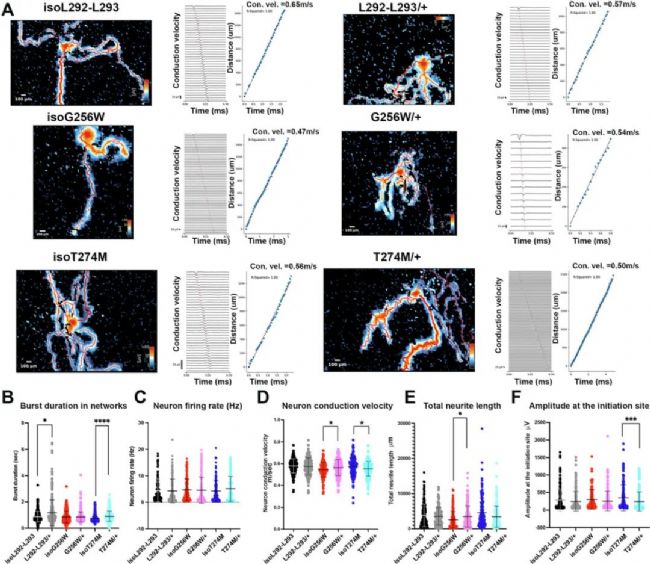
Fig. 6:
MEA分析顯示G256W/+ 傳導速度與神經突長度增加,T274M/+ 傳導速度與振幅下降。
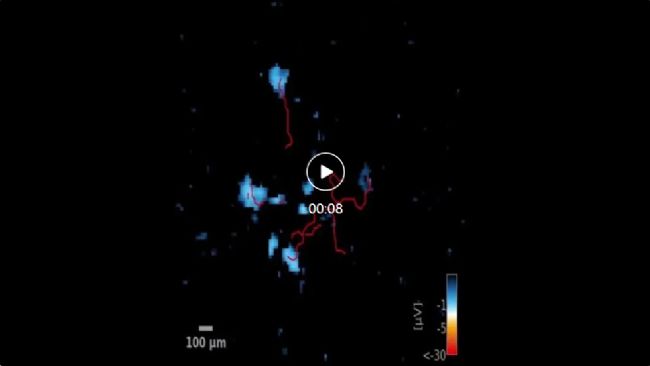
Movie 1:
分化第30天,在MEA上對等基因對照isoG256W神經元進行的功能性神經突追蹤。紅線顯示信號在單個神經元中從軸突起始段向神經突末端的傳播過程。
Movie 2:
分化第30天,在MEA上對患者來源的G256W/+神經元進行的功能性神經突追蹤。
買 MEA設備,找禮智生物!
本研究中使用的高密度微電極陣列(HD-MEA)設備由瑞士MaxWell Biosystems公司研發生產。HD-MEA技術在8.1 mm²芯片表面集成26,400個電極(密度3,259 electrodes/mm²,間距17.5 μm),將電信號采集的空間分辨率提升至亞細胞層級,可捕獲樣本的每一個神經元電信號。不僅支持急性腦切片、視網膜組織等生物樣本的急性實驗記錄,更支持體外培養神經元、類器官、心肌細胞的長時程檢測。
禮智生物是MaxWell中國區獨家授權代理商,積累了豐富的高密度MEA技術的實驗和數據分析經驗。歡迎聯系我們,了解這一技術的更多細節和資料!(聯系方式見文末)

6、藥物干預:Retigabine逆轉G256W/+的高興奮性
在900 mV電刺激下,G256W/+ 網絡的總尖峰數顯著增加,瑞替加濱(Retigabine,10 μM)可逆轉此現象(Supplemental Fig. 7),并在洗脫后恢復,表明KCNQ2通道增強劑具有治療潛力。
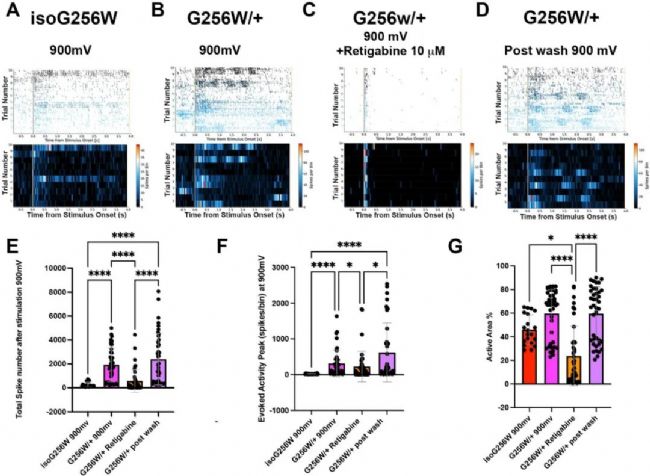
Supplemental Fig. 7:
MEA電刺激實驗證實G256W/+神經元網絡的高興奮性及Retigabine的藥理挽救。
研究總結
本研究利用HD-MEA的高時空分辨率與單神經元追蹤能力,首次在人類iPSC源性神經元中實現了功能性軸突傳導速度與振幅的量化,并揭示了KCNQ2變異導致的網絡高興奮性。G256W/+神經元的傳導速度增加與總神經突長度增長,均在HD-MEA中通過“軸突追蹤工具”精確量化,體現了HD-MEA技術在解析神經元結構與功能關系中的獨特優勢。
參考文獻
Sundberg M, Shum C, Norabuena EM, et al. Human iPSC-derived glutamatergic neurons with pathogenic KCNQ2 variants display hyperactive bursting phenotypes. Neurobiol Dis. 2025 Nov;216:107126. doi: 10.1016/j.nbd.2025.107126.