CAR-T細胞五代結構變化及體內CAR-T的核心結構設計與載體系統
文章來源公眾號:Biotecr視界 作者:慕羽
傳統嵌合抗原受體 T 細胞(CAR-T)療法在血液腫瘤治療中成績斐然,但體外制備復雜、成本高昂、T 細胞功能受損、難以多次給藥及對實體瘤療效有限等問題,一直制約其廣泛應用。如今,體內 CAR-T 療法橫空出世,為解決這些難題帶來新希望!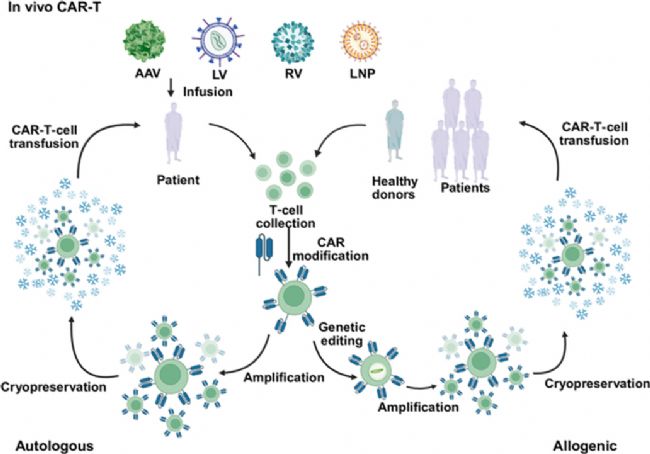
自體、異體和體內嵌合抗原受體(CAR)-T細胞療法的生產回輸流程
體內 CAR-T 療法通過遞送系統將 CAR 基因組件直接遞送至宿主 T 細胞,實現原位重編程,無需體外操作。在治療時效性上,能快速起效,大幅縮短治療周期;經濟可行性方面,簡化流程降低成本,提升治療效率;治療持續性上,可重復給藥應對單次治療后的療效衰減或復發;更重要的是,利用內源性健康 T 細胞,避免體外擴增導致的細胞耗竭,為提升治療安全性和有效性開辟新路徑。
一、CAR-T細胞五代結構變化
自誕生以來,CAR-T 細胞技術已歷經五代關鍵的結構演變,每一代均針對前序版本的局限進行優化,逐步提升細胞活化、增殖、抗凋亡能力及治療安全性,尤其在實體瘤治療領域持續突破,具體演進路徑如下:
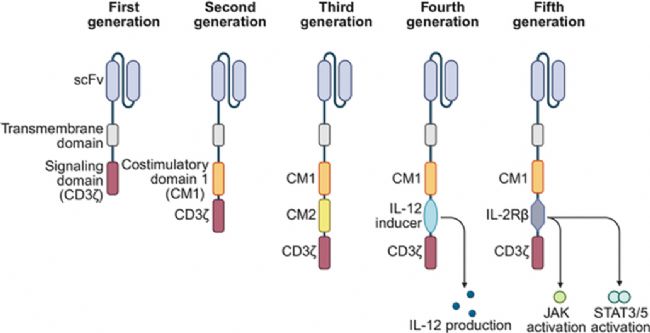
第一代 CAR-T 細胞是技術的基礎框架,其結構由三部分核心組件構成:負責識別腫瘤抗原的抗原結合域(單鏈可變區片段,scFv)、連接細胞膜內外的跨膜域,以及啟動 T 細胞基礎活化信號的CD3ζ 信號域。然而,僅依賴 CD3ζ 單一信號的激活模式存在明顯缺陷 ——T 細胞的細胞因子分泌量不足,體外及體內增殖能力較弱,最終導致治療效果受限,難以滿足臨床需求。
為解決第一代的功能短板,第二代 CAR-T 細胞引入關鍵改進:在原有結構基礎上整合共刺激分子(CD28 或 4-1BB)。這一優化產生了多重協同效應:不僅顯著增強 T 細胞的活化效率與增殖速率,提升細胞因子分泌水平,還能增強 T 細胞的抗凋亡能力、延長其在體內的存活時間。在臨床應用中,第二代 CAR-T 細胞展現出突出優勢,尤其在血液腫瘤(如 B 細胞急性淋巴細胞白血病、非霍奇金淋巴瘤)治療中療效最為顯著,成為當前血液腫瘤 CAR-T 治療的主流技術方向。
CAR結構設計演變
第三代 CAR-T 細胞試圖進一步強化共刺激信號,采用 “雙共刺激分子串聯” 設計,例如將 CD28 與 4-1BB 兩種共刺激分子同時整合到 CAR 結構中。理論上,雙重信號可能進一步提升 T 細胞功能,但實際臨床應用中,其治療效果與第二代相比未體現出明顯優勢,臨床優勢不突出,因此未實現大規模推廣。
第四代 CAR-T 細胞則轉向 “功能拓展與安全調控”,在第二代結構基礎上新增兩類核心模塊:一是細胞因子分泌模塊(如IL-12),可通過調節腫瘤微環境、增強免疫應答來改善治療效果;二是安全開關(如誘導型CASP9),能在出現嚴重不良反應時快速清除 CAR-T 細胞,降低治療風險。這一改進使 CAR-T 細胞在保持療效的同時提升安全性,尤其在實體瘤治療中展現出突破性潛力,為攻克實體瘤的免疫抑制微環境提供了新策略。
第五代 CAR-T 細胞聚焦 “T 細胞功能優化與毒性控制”,同樣以第二代結構為基礎,創新整合細胞因子受體信號域(如IL-2Rβ)。該信號域可激活 JAK-STAT 信號通路,從分子層面顯著增強 T 細胞的活性、體外增殖能力與體內持久性,同時優化 CAR-T 細胞的整體功能特性。更重要的是,其獨特的細胞因子調控機制能減少過量細胞因子釋放,從而降低細胞因子釋放綜合征(CRS)的發生風險。
二、載體系統多樣
在體內遞送 CAR 時,需滿足精準靶向 T 細胞、高效基因編輯能力及低毒性等嚴格標準。目前,病毒載體、非病毒載體與可植入生物支架是 CAR 遞送系統中已被廣泛研究和應用的三大核心類型。
載體類型
病毒載體
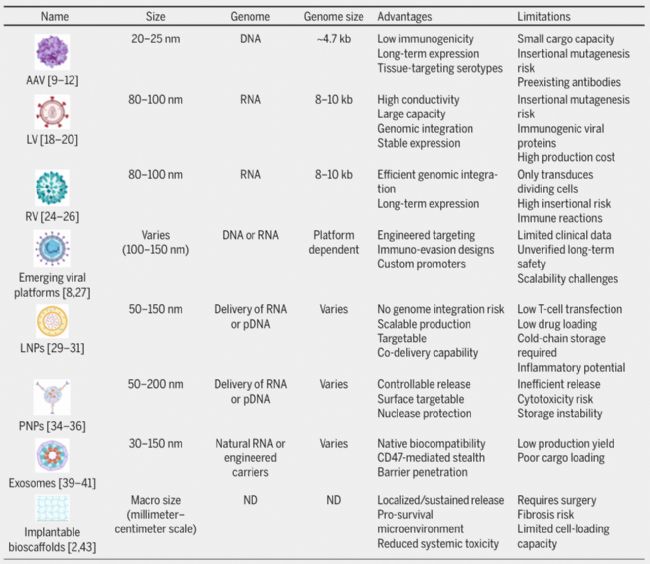
1. 腺相關病毒載體(AAV)作為無包膜小型病毒載體,其遺傳物質為約 4.7kb 的環狀 DNA,治療基因可在細胞核內以附加體形式穩定表達。它免疫原性低,能高效穿透肝臟、肌肉、大腦等多個器官,但存在載體容量有限、基因有極小概率整合到人類 DNA 引發腫瘤風險,且約半數人群血液中存在中和抗體限制其效用。當前通過利用不同 AAV 亞型的器官靶向能力、采用組織特異性啟動子來優化,同時需長期監測大劑量 AAV 在人體中的肝臟安全性。
2. 慢病毒載體(LV)
可突破細胞狀態限制,感染分裂或靜息期細胞,能將治療基因永久整合到細胞 DNA 實現長期表達。其 8kb 的大容量足以裝載復雜 CAR 結構,且天然靶向 T 細胞,但存在基因整合意外破壞關鍵基因致癌、生產依賴復雜多質粒組裝系統導致成本高,以及部分病毒蛋白可能引發免疫反應或細胞因子風暴等問題。現有自滅活載體、CRISPR-Cas9 引導靶向整合到安全基因組位點、整合缺陷型載體等策略降低風險,同時需通過高通量測序監測整合位點并建立長期隨訪機制。
3. 逆轉錄病毒載體(RV)
僅感染活躍分裂細胞,可通過逆轉錄酶將 RNA 基因組轉錄為 DNA 并整合到宿主細胞基因組,實現外源基因長期穩定表達。但強隨機整合特性易破壞關鍵基因(如 2003 年 X-SCID 治療中引發 T 細胞白血病),且免疫反應強、生產效率低,目前主要用于體外 CAR-T 細胞制備,體內遞送需嚴格設計安全開關并開展詳細風險評估。
4. 新興病毒平臺
通過衣殼蛋白工程重塑病毒外殼增強器官靶向能力、啟動子優化實現精準基因調控、添加聚乙二醇 “隱形涂層” 避免免疫清除等基因改造,大幅提升遞送性能,但長期生物安全性及大規模生產可擴展性仍需進一步驗證。
非病毒載體
1. 脂質納米顆粒(LNPs)通過帶正電脂質分子自動包裹核酸形成穩定納米復合物,可高效遞送多種治療分子。能將難溶性藥物吸收率提升 3-5 倍,雙層結構抵御光照、氧氣及酶降解,4℃下可穩定半年以上,表面修飾 CD3 抗體等可實現精準細胞遞送,還支持同時包裹多種分子用于聯合治療。不過載藥量低,對儲存條件敏感,部分陽離子脂質可能引發輕度炎癥,生產依賴精密微流控技術,新型可電離脂質工藝已推動其性能突破。
2. 聚合物納米載體
通過靜電吸附攜帶基因藥物,表面修飾定位裝置后特定細胞攝取率超 80%,聚合物外殼可保護基因免受核酸酶降解,且能通過調節聚合物分子量與單體組成控制藥物釋放速率。但約 30% 載體因穩定性過高無法完全釋藥,20% 因過早降解泄漏藥物,生產需復雜工藝控制粒徑與載藥量導致成本高,聚乙烯亞胺等材料可能引發劑量依賴性細胞毒性且儲存易聚集,未來需引入 pH 敏感鍵、優化凍干工藝及利用機器學習設計聚合物結構。
3. 外泌體
人體自身分泌的載體,天然生物相容性好,表面 CD47 “別吃我” 信號延長體內存活時間,可通過膜蛋白導向特定器官并穿透血腦屏障。但生產效率低、載藥效率差、穩定性不足,且不同來源外泌體風險各異(如 CAR-T 細胞來源外泌體有抗原偏移引發免疫攻擊風險),臨床轉化需解決長期基因組整合風險、免疫原性變化等安全問題,同時推動生產標準化與體內精準追蹤技術發展。
4. 可植入生物支架
通過優化表面涂層技術,可將降解時間控制在數周至數月。能局部原位生成 CAR-T 細胞降低全身毒性,但需手術植入增加感染風險且延長患者恢復周期,支架材料可能引發免疫排斥形成瘢痕組織損害 CAR-T 細胞功能,物理尺寸與材料特性也限制載藥能力。小鼠模型中 MASTER 支架生成釋放的 CAR-T 細胞持久性與抗腫瘤效果優于傳統療法,目前需更多臨床試驗驗證其長期安全性及潛在免疫反應。
寫在最后
載體選擇對 CAR-T 治療成功至關重要,各類載體優勢與挑戰鮮明:病毒載體中,LV 因大容量與天然 T 細胞靶向性成體外制備主流,AAV 受限于容量、預存抗體及肝毒性,RV 基本退出體內遞送。
非病毒載體中,LNPs 引領體內 mRNA 遞送創新,聚合物載體面臨釋藥與毒性問題,外泌體受困于生產與載藥效率;生物支架需突破手術、排斥及載藥限制。臨床轉化中,不同載體應用場景差異顯著,需針對性優化以推進 CAR-T 治療發展。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






