Insulin激素作為調控代謝的核心信號分子在科研領域的應用
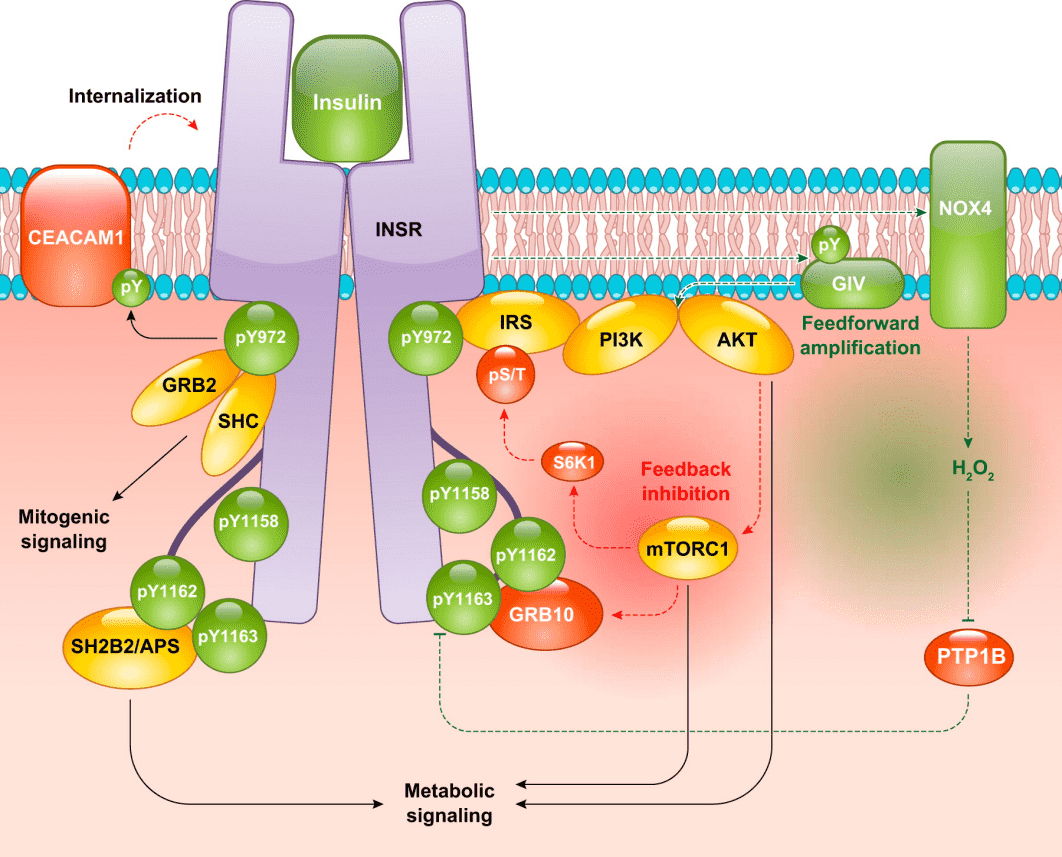
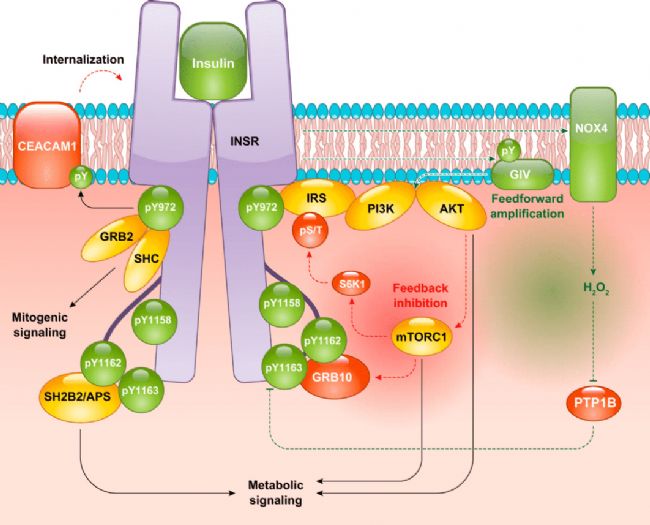
Insulin(Human,AbMole,M9194)是一種由胰島β細胞合成和分泌的蛋白質類激素,在生命體的代謝調控網絡中扮演著核心角色。Insulin可與靶細胞表面的Insulin受體(一種具有內在酪氨酸激酶活性的跨膜蛋白)結合。當Insulin與其受體結合后,會誘發受體構象的變化,并引發受體β亞基的自身磷酸化,隨后激活下游的信號轉導級聯反應,從而啟動兩條關鍵的信號通路:PI3K/Akt通路 和 Ras/MAPK通路。其中,PI3K/Akt通路是Insulin產生代謝效應的核心通路,它能夠促進葡萄糖轉運蛋白GLUT4向細胞膜的轉位,極大地加速細胞對葡萄糖的攝取與利用;同時,該通路通過調節一系列關鍵的酶和轉錄因子,促進糖原、脂質與蛋白質的合成代謝,并抑制糖異生和脂肪分解等代謝過程。而Ras/MAPK通路則更多地與Insulin的促細胞生長、增殖與分化效應相關[1]。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
Insulin(Human,AbMole,M9194)主要作為一種重要的生物活性分子在科研領域中被廣泛應用。例如Insulin可用于構建胰島素抵抗的細胞和動物模型。有研究將脂肪細胞長期暴露于濃度為150 nM的Insulin中,實現了體外胰島素抵抗模型的構建[2]。Insulin也可用于某些細胞的定向分化誘導,例如10 μg/ml的Insulin 、1 μM Dexamethasone 、0.5 mM IBMX(PDE抑制劑)和5 μM Rosiglitazone 組成的分化培養基可以誘導前體脂肪細胞分化為成熟的脂肪細胞,這為研究脂肪細胞發育和代謝調控提供了重要的實驗模型[3]。此外,在神經科學研究領域,Insulin(Human,AbMole,M9194)同樣展現出重要的應用價值。有研究表明,Insulin能夠通過血腦屏障,影響中樞神經系統的功能,參與調節食欲、能量平衡以及認知功能等過程。例如,通過腦室內注射Insulin,可以觀察到動物攝食量的顯著減少,這一發現為肥胖的研究提供了新的思路[4]。同時,Insulin(Pig,AbMole,M9336)在神經免疫反應中也具有重要的功能。Insulin能抑制小膠質細胞介導的神經炎癥,保護神經元免受應激損傷[5]。Insulin信號還可通過調節線粒體功能和多巴胺能神經元的存活影響帕金森病(PD)動物模型的進展[6]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
范例詳解
Sci Adv. 2025 Jul 25;11(30):eadi2370.
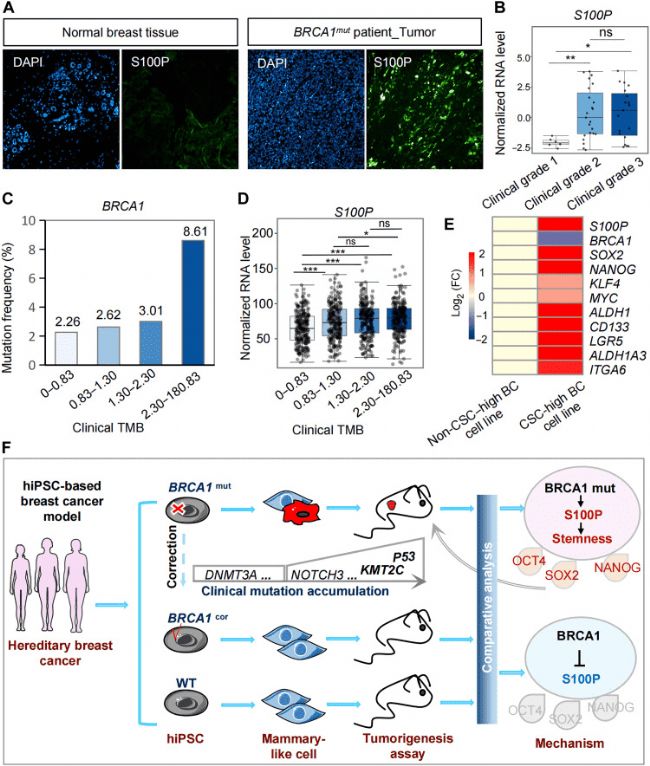
中山大學的科研團隊在上述論文中開發了一種誘導多能干細胞生成功能性乳腺樣細胞(MC)和乳腺類器官的方法。上述模型可用于模擬乳腺組織的發育過程和解析乳腺癌產生的分子機制。此外,實驗人員通過上述模型還揭示了S100P 是乳腺癌腫瘤發生的關鍵基因。由AbMole提供的Insulin(Human,AbMole,M9194)在上述實驗中,作為培養基中重要的組成成分之一,維持乳腺相關細胞的存活、增殖和正常功能。在3D 培養體系中Insulin(10 μg/ml)還用于誘導 iPSC-MCs 形成乳腺樣類器官,保障類器官結構形成與功能穩定[8]。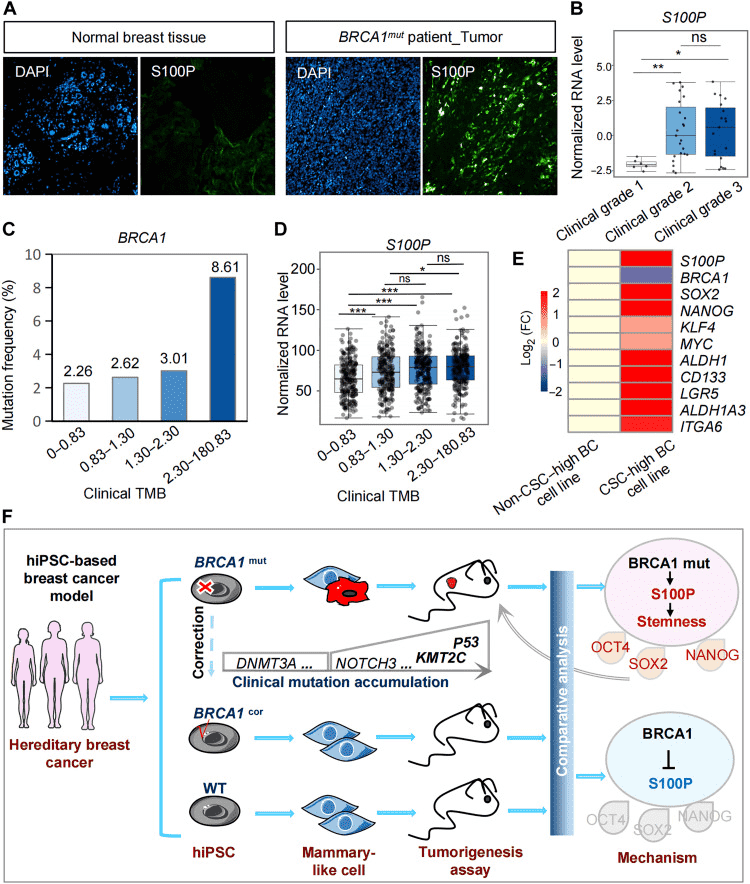
AbMole是ChemBridge中國區官方指定合作伙伴。
 *本文所述產品僅供科研使用
*本文所述產品僅供科研使用
參考文獻及鳴謝
[1] Max C. Petersen, Gerald I. Shulman, Mechanisms of Insulin Action and Insulin Resistance, 98(4) (2018) 2133-2223.
[2] A. Rossi, M. Eid, J. Dodgson, et al., In vitro characterization of the effects of chronic insulin stimulation in mouse 3T3-L1 and human SGBS adipocytes, Adipocyte 9(1) (2020) 415-426.
[3] Ji-Huan Qin, Jun-Zeng Ma, Xing-Wei Yang, et al., A Triterpenoid Inhibited Hormone-Induced Adipocyte Differentiation and Alleviated Dexamethasone-Induced Insulin Resistance in 3T3-L1 adipocytes, Natural Products and Bioprospecting 5(3) (2015) 159-166.
[4] M. Dahiya, M. Yadav, C. Goyal, et al., Insulin resistance in Alzheimer's disease: signalling mechanisms and therapeutics strategies, Inflammopharmacology 33(4) (2025) 1817-1831.
[5] C. C. Huang, S. F. Tsai, S. C. Liu, et al., Insulin Mediates Lipopolysaccharide-Induced Inflammatory Responses and Oxidative Stress in BV2 Microglia, Journal of inflammation research 17 (2024) 7993-8008.
[6] S. K. Bhattamisra, L. Y. Shin, Hibm Saad, et al., Interlink Between Insulin Resistance and Neurodegeneration with an Update on Current Therapeutic Approaches, CNS & neurological disorders drug targets 19(3) (2020) 174-183.
[7] Max C Petersen, Gerald I %J Physiological reviews Shulman, Mechanisms of insulin action and insulin resistance, (2018).
[8] J. Liu, C. Zhao, J. Chen, et al., Human iPSC-based breast cancer model identifies S100P-dependent cancer stemness induced by BRCA1 mutation, Science advances 11(30) (2025) eadi2370.
Insulin(Human,AbMole,M9194)主要作為一種重要的生物活性分子在科研領域中被廣泛應用。例如Insulin可用于構建胰島素抵抗的細胞和動物模型。有研究將脂肪細胞長期暴露于濃度為150 nM的Insulin中,實現了體外胰島素抵抗模型的構建[2]。Insulin也可用于某些細胞的定向分化誘導,例如10 μg/ml的Insulin 、1 μM Dexamethasone 、0.5 mM IBMX(PDE抑制劑)和5 μM Rosiglitazone 組成的分化培養基可以誘導前體脂肪細胞分化為成熟的脂肪細胞,這為研究脂肪細胞發育和代謝調控提供了重要的實驗模型[3]。此外,在神經科學研究領域,Insulin(Human,AbMole,M9194)同樣展現出重要的應用價值。有研究表明,Insulin能夠通過血腦屏障,影響中樞神經系統的功能,參與調節食欲、能量平衡以及認知功能等過程。例如,通過腦室內注射Insulin,可以觀察到動物攝食量的顯著減少,這一發現為肥胖的研究提供了新的思路[4]。同時,Insulin(Pig,AbMole,M9336)在神經免疫反應中也具有重要的功能。Insulin能抑制小膠質細胞介導的神經炎癥,保護神經元免受應激損傷[5]。Insulin信號還可通過調節線粒體功能和多巴胺能神經元的存活影響帕金森病(PD)動物模型的進展[6]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。


圖1 Insulin參與的信號通路[7]
范例詳解
Sci Adv. 2025 Jul 25;11(30):eadi2370.
中山大學的科研團隊在上述論文中開發了一種誘導多能干細胞生成功能性乳腺樣細胞(MC)和乳腺類器官的方法。上述模型可用于模擬乳腺組織的發育過程和解析乳腺癌產生的分子機制。此外,實驗人員通過上述模型還揭示了S100P 是乳腺癌腫瘤發生的關鍵基因。由AbMole提供的Insulin(Human,AbMole,M9194)在上述實驗中,作為培養基中重要的組成成分之一,維持乳腺相關細胞的存活、增殖和正常功能。在3D 培養體系中Insulin(10 μg/ml)還用于誘導 iPSC-MCs 形成乳腺樣類器官,保障類器官結構形成與功能穩定[8]。


圖 2. Clinical analysis reveals an association of S100P and BRCA1 in tumorigenesis[8].
AbMole是ChemBridge中國區官方指定合作伙伴。

 *本文所述產品僅供科研使用
*本文所述產品僅供科研使用參考文獻及鳴謝
[1] Max C. Petersen, Gerald I. Shulman, Mechanisms of Insulin Action and Insulin Resistance, 98(4) (2018) 2133-2223.
[2] A. Rossi, M. Eid, J. Dodgson, et al., In vitro characterization of the effects of chronic insulin stimulation in mouse 3T3-L1 and human SGBS adipocytes, Adipocyte 9(1) (2020) 415-426.
[3] Ji-Huan Qin, Jun-Zeng Ma, Xing-Wei Yang, et al., A Triterpenoid Inhibited Hormone-Induced Adipocyte Differentiation and Alleviated Dexamethasone-Induced Insulin Resistance in 3T3-L1 adipocytes, Natural Products and Bioprospecting 5(3) (2015) 159-166.
[4] M. Dahiya, M. Yadav, C. Goyal, et al., Insulin resistance in Alzheimer's disease: signalling mechanisms and therapeutics strategies, Inflammopharmacology 33(4) (2025) 1817-1831.
[5] C. C. Huang, S. F. Tsai, S. C. Liu, et al., Insulin Mediates Lipopolysaccharide-Induced Inflammatory Responses and Oxidative Stress in BV2 Microglia, Journal of inflammation research 17 (2024) 7993-8008.
[6] S. K. Bhattamisra, L. Y. Shin, Hibm Saad, et al., Interlink Between Insulin Resistance and Neurodegeneration with an Update on Current Therapeutic Approaches, CNS & neurological disorders drug targets 19(3) (2020) 174-183.
[7] Max C Petersen, Gerald I %J Physiological reviews Shulman, Mechanisms of insulin action and insulin resistance, (2018).
[8] J. Liu, C. Zhao, J. Chen, et al., Human iPSC-based breast cancer model identifies S100P-dependent cancer stemness induced by BRCA1 mutation, Science advances 11(30) (2025) eadi2370.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






