In vivo CAR-T與AlloCAR-T兩種技術(shù)的區(qū)別和優(yōu)勢
文章來源公眾號:醫(yī)藥學術(shù) 作者:醫(yī)藥學術(shù)編輯部
在今年的國際科技博覽會開幕式上,中國科學技術(shù)信息研究所發(fā)布了《顛覆性技術(shù)前瞻(2025)》報告,遴選出40項最具突破性價值技術(shù)。其中,生命科學領域就包括10項。如果讓您選,這10項都包括什么?思考一下~公布答案,這10項分別是:
侵入式腦機接口、AI蛋白質(zhì)生成、下一代RNA藥物、通用型CAR-T細胞療法、靶向蛋白降解技術(shù)、細胞重編程技術(shù)、大片段DNA操縱技術(shù)、異種移植技術(shù)、體電子顯微鏡和單原子編輯技術(shù)。
這10項技術(shù)是在你意料之內(nèi)還是意料之外?
看到通用型CAR-T細胞療法,我就在想,通用/異體CAR-T和in vivo CAR-T兩者都超越了傳統(tǒng)意義上的CAR-T療法,那這兩者間又有什么不同呢?從應用角度講,哪個更有開發(fā)潛力呢?我們就一起梳理一下~
為了寫起來方便,我們統(tǒng)一稱,體內(nèi)CAR-T:in vivo CAR-T;通用/異體CAR-T:AlloCAR-T。
Allo CAR-T制備流程
先看“官方”的解釋:通過白細胞分離術(shù)從健康供體采集T淋巴細胞。病毒載體介導的轉(zhuǎn)基因技術(shù)或基因敲入技術(shù),可將編碼CAR的重組DNA永久整合至上述淋巴細胞內(nèi),并可同時插入其他基因,如共刺激受體。通過上述技術(shù)還能消除T細胞中αβ T細胞受體(TCR)和CD52的表達。隨后使用抗CD3/抗CD28磁珠及細胞因子對T細胞進行擴增。殘留的αβ TCR陽性細胞通過抗αβ TCR抗體進行磁珠分選去除。最終將AlloCAR-T分裝至凍存管,在需要時運抵醫(yī)療機構(gòu)。
通俗的講,其實就是:從健康的捐贈者(非患者本人)體內(nèi)采集T細胞→進行基因工程改造(裝上CAR)→同時,通過基因編輯技術(shù)(如CRISPR/Cas9)敲除可能引起排斥的基因→擴增后制成“現(xiàn)貨”產(chǎn)品,冷凍儲存→當有患者需要時,可直接解凍輸注。
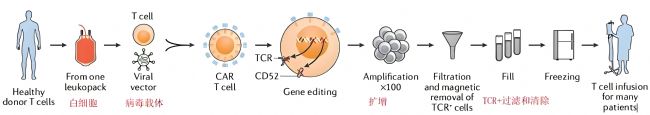
圖1 Allo CAR-T制備流程
看到“官方”的制備過程,其實我主要思考的有兩個問題:
為何要去除T細胞中αβ T細胞受體(TCR)和CD52的表達?
為何選擇使用抗CD3/抗CD28磁珠進行T細胞擴增?
帶著這兩個問題,又查了一些資料,總結(jié)如下:
Allo CAR-T制備過程中,去除T細胞中αβ T細胞受體和CD52,是為了解決兩大根本性挑戰(zhàn):安全性和有效性/持久性。
去除 αβ TCR 的表達,其核心目的是防止移植物抗宿主病(GvHD)!
什么是GvHD?
捐贈者的T細胞不僅帶有我們?nèi)斯氲腃AR,還天然表達它們自己的TCR。捐贈者的TCR會識別患者(宿主)體內(nèi)正常組織的主要組織相容性復合體(MHC/HLA)為“外來異物”。一旦識別,這些輸入的CAR-T細胞就會攻擊患者的正常組織器官(如皮膚、肝臟、腸道等),引發(fā)GvHD。GvHD是一種非常嚴重且可能致命的并發(fā)癥。而αβ TCR是介導GvHD的主要TCR類型。所以要進行去除。
去除 CD52 的表達:核心是為了解決Allo CAR-T有效性和持久性問題。
這里又不得不提到另外一個概念,宿主免疫排斥(HvGR)。什么是HvGR?患者的免疫系統(tǒng)會將輸入的、來自他人的CAR-T細胞識別為“外來物”并發(fā)動攻擊,試圖將其清除。這會導致CAR-T細胞在患者體內(nèi)無法擴增或迅速被消滅,從而使治療失敗。
CD52是一種廣泛表達在T細胞、B細胞、NK細胞、單核細胞等免疫細胞表面的蛋白。清除CD52,其實就是為了消除患者自身免疫細胞“排除異己”的能力。
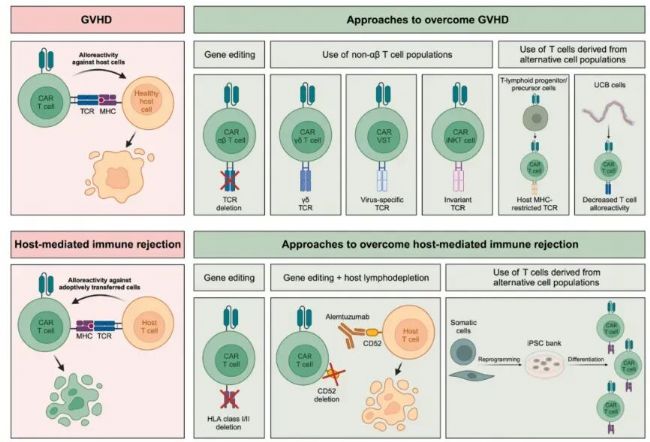
圖2 Allo CAR-T療法GvHD和HvGR
根據(jù)已發(fā)表的文獻,Allo CAR-T療法主要有:
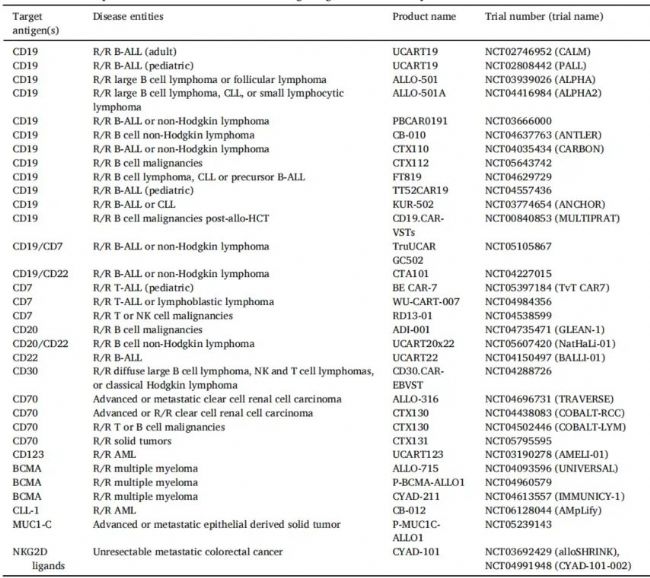
絕大多數(shù)還是針對血液系統(tǒng)疾病。
in vivo CAR-T
in vivo CAR-T,可簡單理解為:“體內(nèi)基因療法”。它不再是輸注細胞,而是輸注一種攜帶CAR基因的工程化病毒載體。這個載體像一枚“智能導彈”,進入人體后,會尋找并感染T細胞,然后將CAR基因整合進T細胞的DNA中,從而讓這些T細胞“原地變身”為CAR-T細胞。目前大多處于臨床前或早期臨床研究階段,技術(shù)挑戰(zhàn)更大,但如果成功,將是顛覆性的。
支持in vivo CAR-T的兩大技術(shù)平臺以及臨床進展,我們也已經(jīng)進行了詳細的總結(jié),詳見“CAR-T療法之父”Carl H. June詳述:支持in vivo CAR-T的兩大平臺及臨床進展。這里就不再贅述in vivo CAR-T的制備過程。
總結(jié)
對比一下這兩種技術(shù):
表1 in vivo CAR-T vs Allo CAR-T
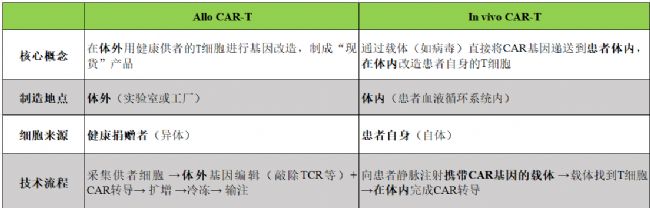
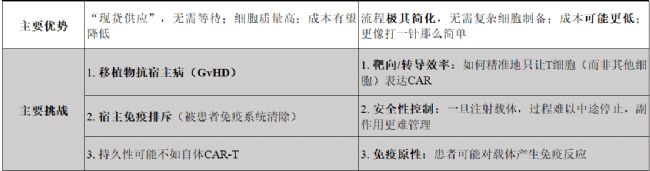
我們再設身處地的想,如果我是一個決策者,我們會選擇布局Allo CAR-T賽道還是In vivo CAR-T賽道?
我的理解是這樣:
短期可行性
Allo CAR-T技術(shù)路徑更明確,已有臨床2期數(shù)據(jù)支持其安全性,適用于血液瘤的快速商業(yè)化。例如,Allogene公司的ALLO-501A在1期試驗中總緩解率達78%,且已啟動2期研究。其挑戰(zhàn)在于療效持久性和免疫排斥的優(yōu)化,但通過基因編輯技術(shù)(如NK細胞抑制性受體敲除)可逐步改善。
長期顛覆性潛力
In vivo CAR-T代表下一代CAR-T療法的方向,通過簡化生產(chǎn)流程和降低成本,可能徹底改變CAR-T的商業(yè)模式。例如,Capstan Therapeutics(獲諾華、輝瑞等投資)和Azalea Therapeutics(CRISPR技術(shù)加持)正探索基于mRNA-LNP的體內(nèi)遞送系統(tǒng)。但需克服遞送效率和安全性問題(如載體引發(fā)的免疫原性)。
in vivo CAR-T,可簡單理解為:“體內(nèi)基因療法”。它不再是輸注細胞,而是輸注一種攜帶CAR基因的工程化病毒載體。這個載體像一枚“智能導彈”,進入人體后,會尋找并感染T細胞,然后將CAR基因整合進T細胞的DNA中,從而讓這些T細胞“原地變身”為CAR-T細胞。目前大多處于臨床前或早期臨床研究階段,技術(shù)挑戰(zhàn)更大,但如果成功,將是顛覆性的。
支持in vivo CAR-T的兩大技術(shù)平臺以及臨床進展,我們也已經(jīng)進行了詳細的總結(jié),詳見“CAR-T療法之父”Carl H. June詳述:支持in vivo CAR-T的兩大平臺及臨床進展。這里就不再贅述in vivo CAR-T的制備過程。
總結(jié)
對比一下這兩種技術(shù):
表1 in vivo CAR-T vs Allo CAR-T


我們再設身處地的想,如果我是一個決策者,我們會選擇布局Allo CAR-T賽道還是In vivo CAR-T賽道?
我的理解是這樣:
短期可行性
Allo CAR-T技術(shù)路徑更明確,已有臨床2期數(shù)據(jù)支持其安全性,適用于血液瘤的快速商業(yè)化。例如,Allogene公司的ALLO-501A在1期試驗中總緩解率達78%,且已啟動2期研究。其挑戰(zhàn)在于療效持久性和免疫排斥的優(yōu)化,但通過基因編輯技術(shù)(如NK細胞抑制性受體敲除)可逐步改善。
長期顛覆性潛力
In vivo CAR-T代表下一代CAR-T療法的方向,通過簡化生產(chǎn)流程和降低成本,可能徹底改變CAR-T的商業(yè)模式。例如,Capstan Therapeutics(獲諾華、輝瑞等投資)和Azalea Therapeutics(CRISPR技術(shù)加持)正探索基于mRNA-LNP的體內(nèi)遞送系統(tǒng)。但需克服遞送效率和安全性問題(如載體引發(fā)的免疫原性)。
- Hepcidin-25的作用機制及在炎癥、心血管與腫瘤等動物模型中的應用
- Klotho蛋白的分子形式、功能及其在疾病與衰老進程中的核心作用
- 二甲雙胍(Metformin)在代謝、腫瘤、衰老與神經(jīng)疾病動物模型中的作用
- Romidepsin作為HDAC1/2抑制劑在細胞分化與損傷修復中的作用
- 白細胞介素-2(IL-2)的功能、信號調(diào)控機制及對免疫穩(wěn)態(tài)調(diào)控的雙面性
- 腫瘤/纖維化EMT研究中mIHC染色指標的組合及選擇方法
- Hepcidin-25(鐵調(diào)素)在鐵代謝與免疫反應中的調(diào)節(jié)機制
- Vadimezan作為多功能STING激動劑與血管破壞劑的作用機制
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






