Simoa單分子蛋白檢測技術助力揭示tau蛋白在WM退化中的核心作用

引言
阿爾茨海默病(Alzheimer's Disease, AD)是一種神經退行性疾病,其病理特征包括β-淀粉樣蛋白(Aβ)斑塊和tau蛋白纏結的積累。近年來,研究表明白質(White Matter, WM)退化在AD進程中扮演關鍵角色,但微結構(如分數各向異性, Fractional Anisotropy, FA)與宏觀結構(如白質高信號, White Matter Hyperintensities, WMH)變化的時序關系及其與AD病理的關聯尚不明確。文章通過多模態神經影像數據,揭示了tau蛋白聚集與微結構WM退化(FA降低)的緊密聯系,且FA減少先于WMH增加,為AD早期診斷提供了新見解。Simoa單分子蛋白檢測技術,以其超高靈敏度(比傳統ELISA高1000倍),能夠檢測外周血中低豐度蛋白生物標志物(如Aβ、tau、GFAP等),為AD早期診斷提供技術支撐。
研究背景與實驗設計
基于阿爾茨海默病神經影像倡議(ADNI)和粵港澳大灣區健康老齡化腦研究(GHABS)兩大隊列,共納入328名ADNI參與者和78名GHABS參與者,收集了基線及縱向的Aβ PET、tau PET、擴散磁共振成像(dMRI)和T2 FLAIR數據。研究通過廣義線性模型(GLM)和線性混合效應模型(LME)分析FA和WMH與AD病理(Aβ和tau)、年齡、血管風險因素的關聯,并依據修訂的AD生物分期標準(A/T profiles)進行分組比較。實驗設計強調了多模態數據的整合,Simoa技術可在此框架下用于驗證血液生物標志物與影像發現的相關性。
實驗結果
微結構FA與tau蛋白的關聯:
揭示早期WM退化的關鍵
通過tau PET成像顯示,Braak I-VI區域的tau標準攝取比值(SUVR)與多個WM腦區的FA水平呈負相關(如海馬扣帶回CGH、穹窿FX等),且縱向數據表明tau聚集加速了FA下降。這一發現提示tau蛋白是微結構WM退化的主要驅動因子。Simoa技術的高靈敏度可直接檢測血液中的tau蛋白(如pTau-181、pTau-217),與PET數據形成互補。

▲圖:展示了WM腦區與tau PET的關聯
AD不同生物階段的FA變化:
Simoa助力早期分期
比較了A/T分期(如A-T-、A+T-、A+THIGH+)群體的FA水平,發現即使在高tau負荷前(A+T-階段),FA已出現加速下降,表明微結構退化早于宏觀WMH變化。Simoa的多重檢測能力(如Neuro 4-Plex試劑盒可同時測量Aβ42、Aβ40、GFAP、NfL)可對應AD分期需求。

▲圖:顯示了不同AD分期的FA差異
年齡和血管因素對WM完整性的影響:
Simoa擴展應用場景
發現年齡與FA降低和WMH增加顯著相關,但血管風險因素(如高血壓)的影響較弱。Simoa技術可用于探索年齡相關蛋白變化,如炎癥因子(IL-6、TNF-α)或神經退化標志物(GFAP),可用于多因素交互研究。

▲圖:展示了年齡與WM參數的關聯
微結構與宏觀結構WM退化的序列關系:
Simoa驗證縱向變化
通過縱向模型證明,基線FA水平可預測WMH增加速率,但反之不成立,支持微結構退化先于宏觀結構的序列。Simoa技術可通過血液樣本頻繁監測,自動化特性減少了操作誤差,適用于大規模隊列。
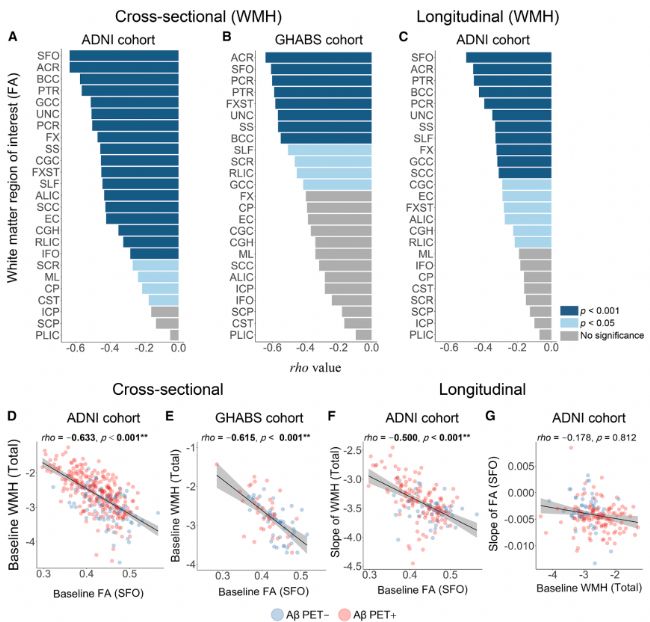

▲圖:揭示了FA與WMH的因果關系
討論與展望
本文系統性研究揭示了tau蛋白在WM退化中的核心作用,而Simoa技術為這些發現提供了轉化途徑。Simoa的超高靈敏度可檢測AD早期血液標志物,彌補影像技術的侵入性和成本限制。未來,結合Simoa的定制化開發,可探索新型WM相關蛋白標志物,如文中提到的limbic系統特異性蛋白。局限性包括DTI指標的不足,Simoa可聯合先進dMRI技術(如NODDI)提升精度。Simoa技術有望成為AD超早期檢測和藥物療效評估的標準工具,推動精準醫療發展。
Simoa單分子蛋白檢測技術原理概述
Simoa技術是由哈佛大學醫學院David Walt教授開創的數字ELISA平臺,其核心在于通過飛升級微孔(50 fL)實現單分子檢測。技術流程包括:抗體偶聯磁珠形成免疫復合物,磁珠落入微孔后,酶催化底物產生熒光信號,經CCD攝像頭數字化分析。Simoa的靈敏度達到飛克級別(fg/mL),可直接檢測血液中傳統方法無法觸及的蛋白標志物,如AD相關的tau、Aβ等。與傳統ELISA相比,Simoa反應體積縮小20億倍,避免了信號稀釋,實現了真正的單分子檢測。







