小分子蛋白WB檢測(cè)技巧及獲得理想條帶的辦法
凝膠體系
有研究者提出可以減少電泳中SDS的用量,但效果并不佳。Schagger[1]等提出可以在高離子強(qiáng)度下電泳來實(shí)現(xiàn)更好的分離效果,他們用三羥甲基氨基甘氨酸(Tricine)代替甘氨酸(Gly),形成了一種新的Tricine-SDS-PAGE凝膠電泳體系。與Gly(pK 9.6)相比,Tricine(pK 8.15)在pH為6.8~8.8時(shí),更多以陰離子形式存在,在膠中的遷移速度更快,能夠顯著提高對(duì)小分子蛋白的分離效果。用兩種體系對(duì)相同樣本進(jìn)行檢測(cè),Tricine-SDS-PAGE能夠有效分離17.2-2.5kDa的蛋白(Fig.1a),而相同實(shí)驗(yàn)步驟下,Glycine-SDS-PAGE體系分離效果較差,條帶并未被分離(Fig.1 b)。
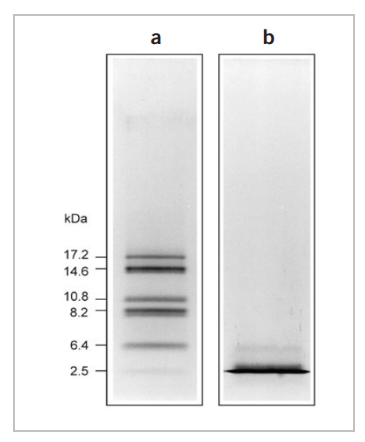
與常規(guī)的體系相比,Tricine-SDS-PAGE凝膠系統(tǒng)一般需要使用2種不同的緩沖液:陽極緩沖液和陰極緩沖液,陰極緩沖液中用Tricine代替Glycine。電泳時(shí)在電泳槽底部加入陽極緩沖液,兩塊膠的中間槽加入陰極緩沖液,實(shí)現(xiàn)對(duì)小分子蛋白更有效的分離。
凝膠濃度
凝膠濃度決定孔徑,孔徑是影響蛋白在電場(chǎng)中遷移速度的重要影響因素。凝膠的孔徑越小,小分子蛋白在其中遷移的速度越慢,分辨效果也越好。
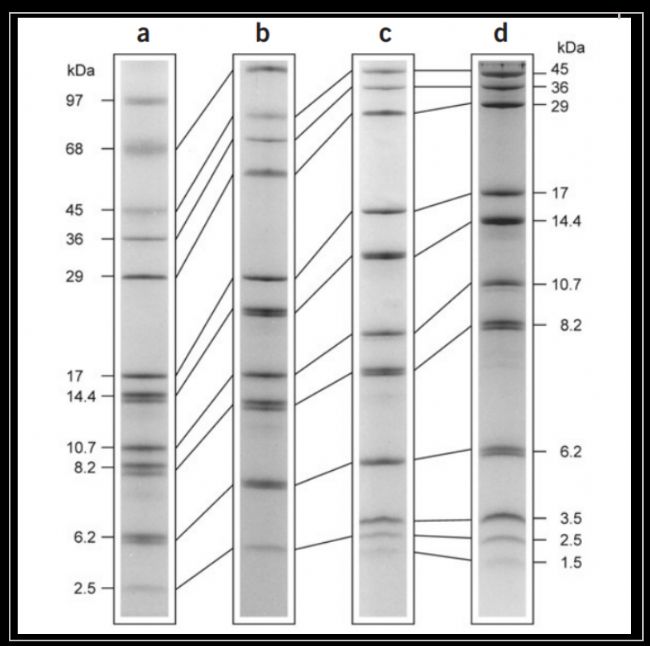
分離膠中丙烯酰胺和雙丙烯酰胺的比例會(huì)影響凝膠的孔徑大小。在Tricine-SDS-PAGE體系中,通過對(duì)比凝膠中丙烯酰胺和雙丙烯酰胺的不同比例和交聯(lián)度,發(fā)現(xiàn)經(jīng)過改進(jìn)的比例較原先的分離效果更好,可以更精細(xì)地分辨1-100kDa之間的蛋白[2]。如Fig.2a、b、c,改變凝膠中兩種單體的百分比和交聯(lián)度對(duì)于同一樣品的分離效率不同。
在分離膠中添加尿素也可以提高膠的分離效果。尿素可以改變凝膠的結(jié)構(gòu),降低凝膠孔徑的大小。在分離膠中添加一定比例的尿素,可以增強(qiáng)對(duì)小分子蛋白的分離效果[3,4](Fig.2d)。另有一些研究發(fā)現(xiàn)在分離膠中添加甘油也可以起到與尿素一樣的效果[5]。
電泳條件
在電泳時(shí)控制跑膠時(shí)間,保證小分子蛋白與內(nèi)參分開,盡量不要跑太久,前沿接近膠底部即可。嘗試用恒流進(jìn)行電泳,濃縮膠推薦30mA,分離膠推薦45mA。
電泳過程中注意降溫,溫度升高會(huì)加快小蛋白分子的運(yùn)動(dòng),增加彌散速度。
轉(zhuǎn)膜條件
可以適當(dāng)減少轉(zhuǎn)膜時(shí)間,降低轉(zhuǎn)膜的電壓電流,防止過轉(zhuǎn)。同時(shí)在轉(zhuǎn)膜后可以用麗春紅染色確保轉(zhuǎn)膜成功。建議使用0.22μm孔徑的膜,且可以將膜在甲醇中激活的時(shí)間延長(zhǎng)至2~3min,增加膜與蛋白的結(jié)合率。
其他小細(xì)節(jié)
(1)確定樣本中靶標(biāo)蛋白的表達(dá)量,可以通過The Human Protein Atlas、GeneCards、BioGPS等數(shù)據(jù)庫(kù)查詢。很多小分子蛋白需要適當(dāng)刺激才能誘導(dǎo)表達(dá),所以實(shí)驗(yàn)前要做好充分的文獻(xiàn)調(diào)研。
(2)在樣本制備過程中添加蛋白酶和磷酸酶抑制劑,防止蛋白降解;在制樣過程中增加超聲處理,盡可能的充分裂解樣品,暴露抗原表位。盡量使用新鮮樣本進(jìn)行實(shí)驗(yàn)。
(3)小分子蛋白由于彌散拖尾現(xiàn)象較多,最好是保留3個(gè)以上marker,或者做全膜,避免蛋白被裁去。
推薦產(chǎn)品助力您的實(shí)驗(yàn):
|
產(chǎn)品貨號(hào) |
產(chǎn)品名稱 |
|
Color-coded Prestained Protein Marker, Low Range (1.7-42 kDa) |
|
|
藍(lán)色預(yù)染蛋白 Marker (3.3-31kDa) |
|
|
預(yù)制膠(15%,10wells) |
|
|
預(yù)制膠(15%,15wells) |
|
|
預(yù)制膠(8-20%,10wells) |
|
|
3-5kDa小分子量預(yù)制膠(16.5%,15wells) |
|
|
3-5kDa小分子量預(yù)制膠(16.5%,10wells) |
|
|
3-5kDa小分子量預(yù)制膠試劑盒(16.5%,10wells) |
|
|
3-5kDa小分子量預(yù)制膠試劑盒(16.5%,15wells) |
|
|
Tris-Tricine陽極緩沖液(5×) |
|
|
Tris-Tricine陰極緩沖液(5×) |
|
|
小分子蛋白上樣緩沖液(2×) |
|
|
PVDF膜(0.22μm) |
|
|
麗春紅S染色液 |
參考文獻(xiàn):
[1] Schägger H, von Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem. 1987 Nov 1;166(2):368-79. doi: 10.1016/0003-2697(87)90587-2. PMID: 2449095
[2] 曹佐武.有效分離1kDa小肽的Tricine-SDS-PAGE方法[J]. 中國(guó)生物工程雜志, 2004(01): 74-76. DOI:10.13523/j.cb.20040118.
[3] Schägger H. Tricine-SDS-PAGE. Nat Protoc. 2006;1(1): 16-22.doi: 10.1038/nprot.2006.4. PMID: 17406207
[4] 詹玉春,劉文斌.用SDS-PAGE電泳測(cè)定豆粕酶解物中的低分子多肽分子量[J].畜牧與獸醫(yī), 2004(11): 4-6.
[5] 江龍法,錢志剛,楊海麟等.用于分離小分子肽的凝膠電泳的改進(jìn)研究[J].化學(xué)世界, 2007(04): 200-202. DOI: 10.19500/j.cnki.0367-6358.2007.04.003.
- Hepcidin-25的作用機(jī)制及在炎癥、心血管與腫瘤等動(dòng)物模型中的應(yīng)用
- Klotho蛋白的分子形式、功能及其在疾病與衰老進(jìn)程中的核心作用
- 二甲雙胍(Metformin)在代謝、腫瘤、衰老與神經(jīng)疾病動(dòng)物模型中的作用
- Romidepsin作為HDAC1/2抑制劑在細(xì)胞分化與損傷修復(fù)中的作用
- 白細(xì)胞介素-2(IL-2)的功能、信號(hào)調(diào)控機(jī)制及對(duì)免疫穩(wěn)態(tài)調(diào)控的雙面性
- 腫瘤/纖維化EMT研究中mIHC染色指標(biāo)的組合及選擇方法
- Hepcidin-25(鐵調(diào)素)在鐵代謝與免疫反應(yīng)中的調(diào)節(jié)機(jī)制
- Vadimezan作為多功能STING激動(dòng)劑與血管破壞劑的作用機(jī)制






