類器官解析膽管癌的異質性及肝外膽管癌祖細胞生態位
近日,海軍軍醫大學附屬東方肝膽醫院/國家肝癌科學中心王紅陽院士、付靜教授團隊在《Journal of Hematology & Oncology》上發表研究,利用單細胞轉錄組、空間轉錄組、類器官及小鼠模型揭示了不同膽管癌亞型之間的細胞和微環境差異,并鑒定到一群eCCA 特異性的基底樣 LY6D+腫瘤細胞亞群,富含ISG15分子的微環境有助于提高eCCA 細胞的干性、基底樣特征和耐藥性,突出了其在維持LY6D+祖細胞生態位中的關鍵作用,這些發現有助于CCAs 的新型預后生物標志物、治療靶點和治療策略的開發。

發表時間:2025.6
期刊名稱:Journal of Hematology & Oncology
影響因子:29.5
研究樣本:慢性膽道炎癥,iCCA,eCCA-P,eCCA-D
實驗平臺:scRNA-seq、空間ISS,PDO
01 臨床困局:解析膽管癌亞型異質性
膽管癌(CCA)分為肝內膽管癌(iCCA)和肝外膽管癌(eCCA)。eCCA進一步細分為肝門部膽管癌(eCCA-P)和遠端膽管癌(eCCA-D),并且從胚胎學角度來看iCCA源于肝母細胞,eCCA起源于前腸內胚層,但由于解剖位置的局限性導致組織獲得較為困難,進而影響了其多組學水平的異質性研究。
02 研究思路
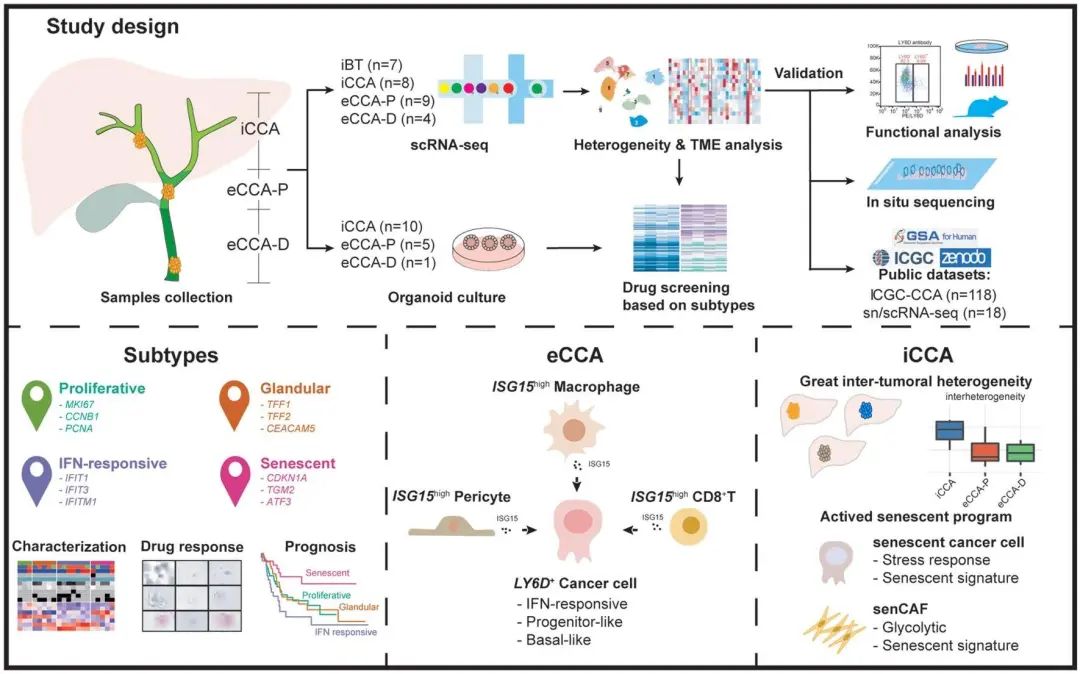
03 主要結論
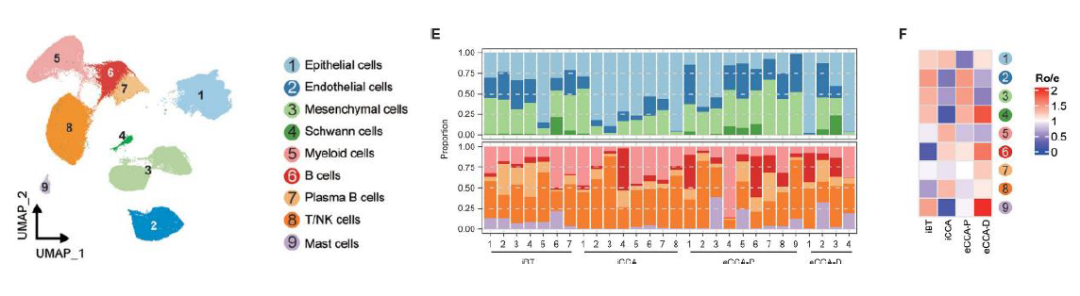
1. 單細胞解析CCA亞型異質性圖譜
該研究對7例iBT,8例iCCA,9例eCCA-P,4例eCCA-D病人進行單細胞轉錄組測序,共獲得 109,071細胞,進一步注釋之后發現不同疾病和不同病人之間存在顯著的異質性,其中eCCA-D亞型中顯著富集了施旺細胞和肥大細胞,而淋巴細胞則主要在腫瘤樣本中較為豐富。
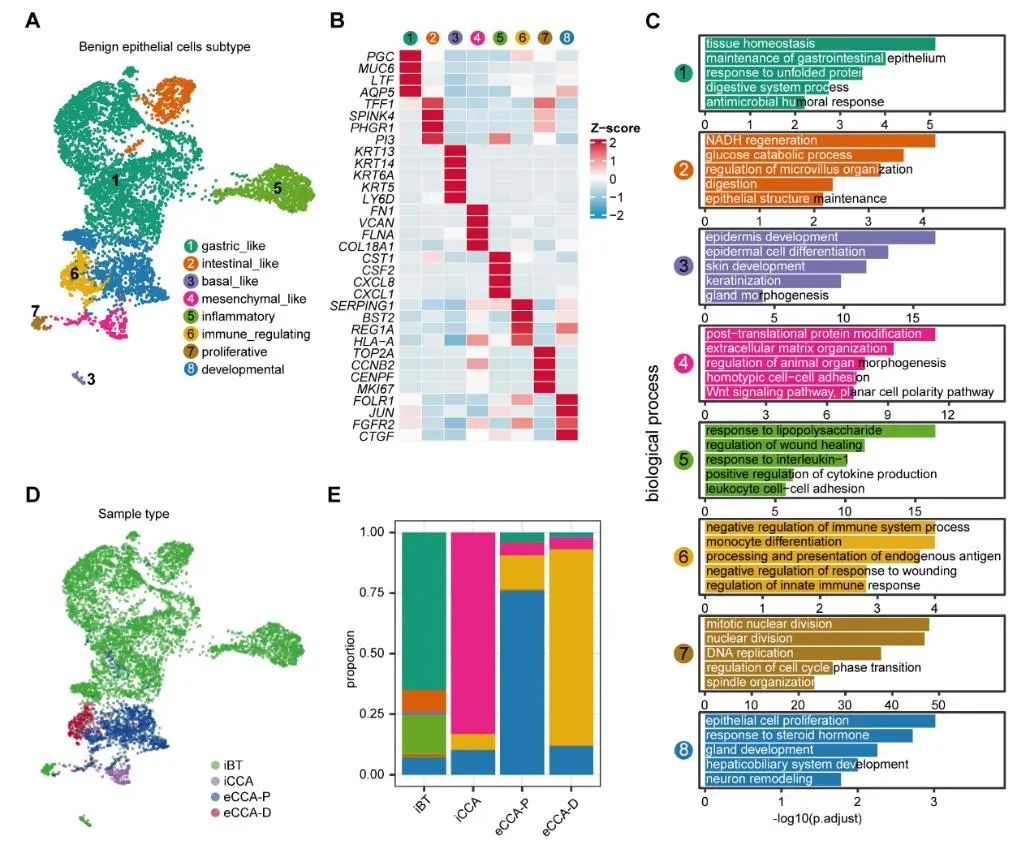
2. CNVlow的上皮細胞揭示CCA亞型具有不同的致癌驅動程序
對CNVlow的上皮細胞進行亞群分析,發現在BTC中存在胃樣、腸樣和炎性樣上皮細胞的功能說明其正常再生途徑已被劫持,而腫瘤中CNVlow的上皮細胞則在iCCAs、eCCA-Ps 和 eCCA-Ds中分別表現出間充質樣、發育和免疫調節細胞狀態,說明不同 CCA 亞型的致癌作用可能是由不同的過程驅動的。
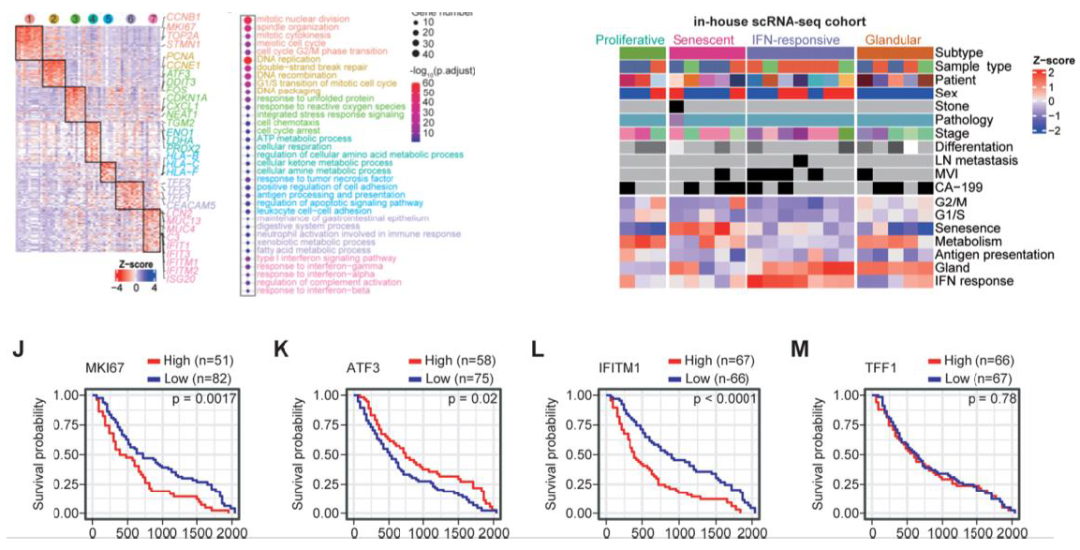
3. 惡性腫瘤細胞不同的表達程序與腫瘤的預后有關
進一步對惡性細胞進行NMF分析,得到7個程序模塊,其中iCCA表現為衰老程序,eCCA則表現為腺體和 IFN響應程序,進一步將樣本按照7個MP分類后進行聚類,得到4種亞型,其中增殖亞型和IFN響應亞型與更差的預后相關,衰老亞型與更好的生存結局相關,而IFN應答亞型主要在eCCA中富集,這些結果將CCA的不同亞型與其臨床結局進行了關聯。
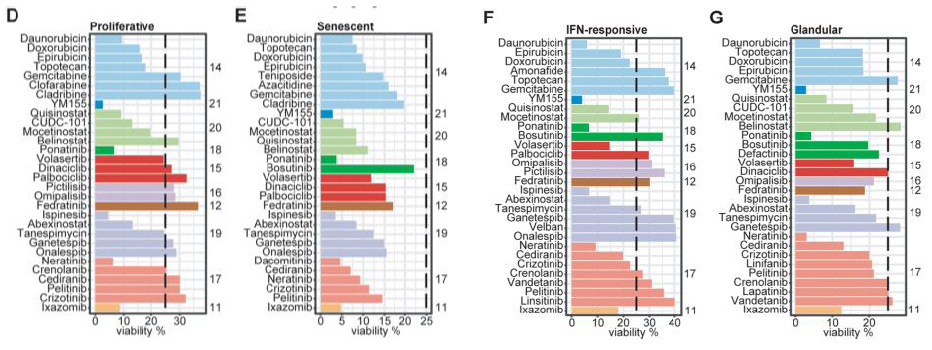
4. 類器官庫藥物篩選實驗揭示惡性腫瘤細胞不同的表達程序與腫瘤的精準治療療效有關
接下來研究者利用類器官模型來驗證這四個亞型的精準治療策略,首先建立了16個類器官穩定株,并根據亞型進行了175種化合物篩選,發現IFN響應亞型始終表現出更高的耐藥性,而衰老和腺體亞型通常表現出更高的藥物敏感性。
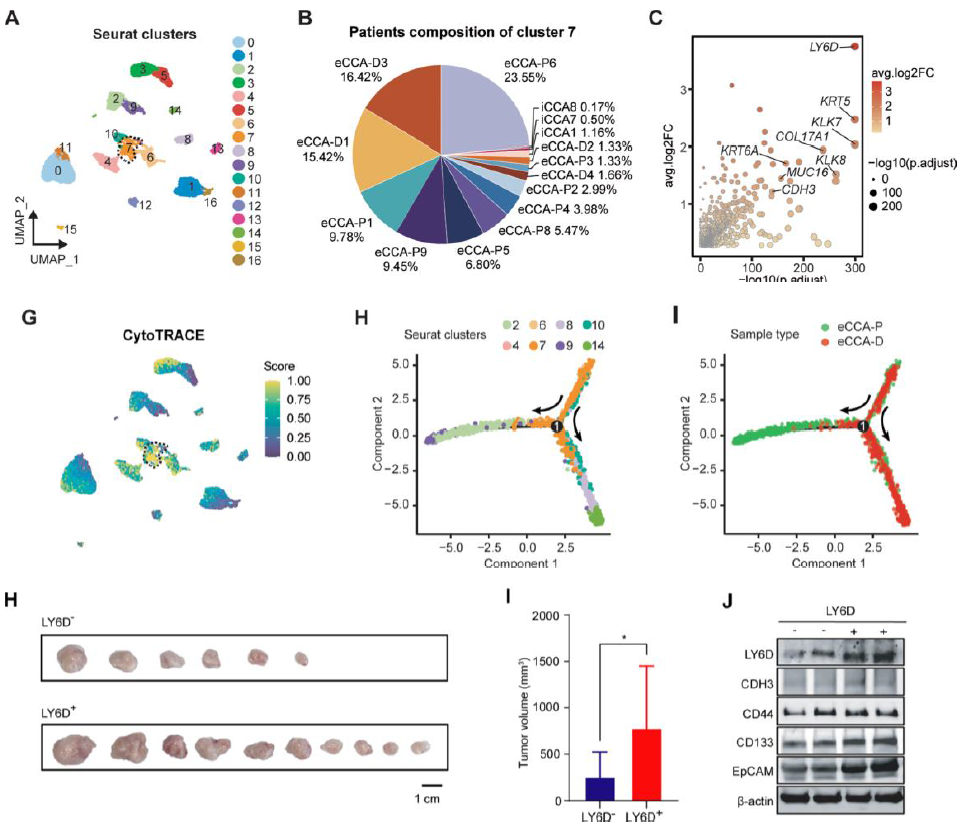
5. eCCA中鑒定到一群eCCA 特異性的基底樣 LY6D+祖細胞腫瘤細胞亞群
惡性腫瘤細胞亞群分析及軌跡分析,發現c7 群在eCCA中特有,具有發育和干性特征,并且位于軌跡的起始端,其高表達的LY6D等相關基因隨著軌跡方向逐漸下降,并且c7相關基因主要富集在表皮發育/分化和 IFN響應相關通路。在更多單細胞數據及ISS空間轉錄組數據中也同樣驗證了LY6D+細胞的存在,并且高表達基底樣標志物(KLK7、KRT5、KRT10)、干細胞標志物(CD44、SOX9、EPCAM)和增殖標志物(MKI67、PCNA),體外體內實驗也表明LY6D+的細胞表現更強的干性和耐藥性。
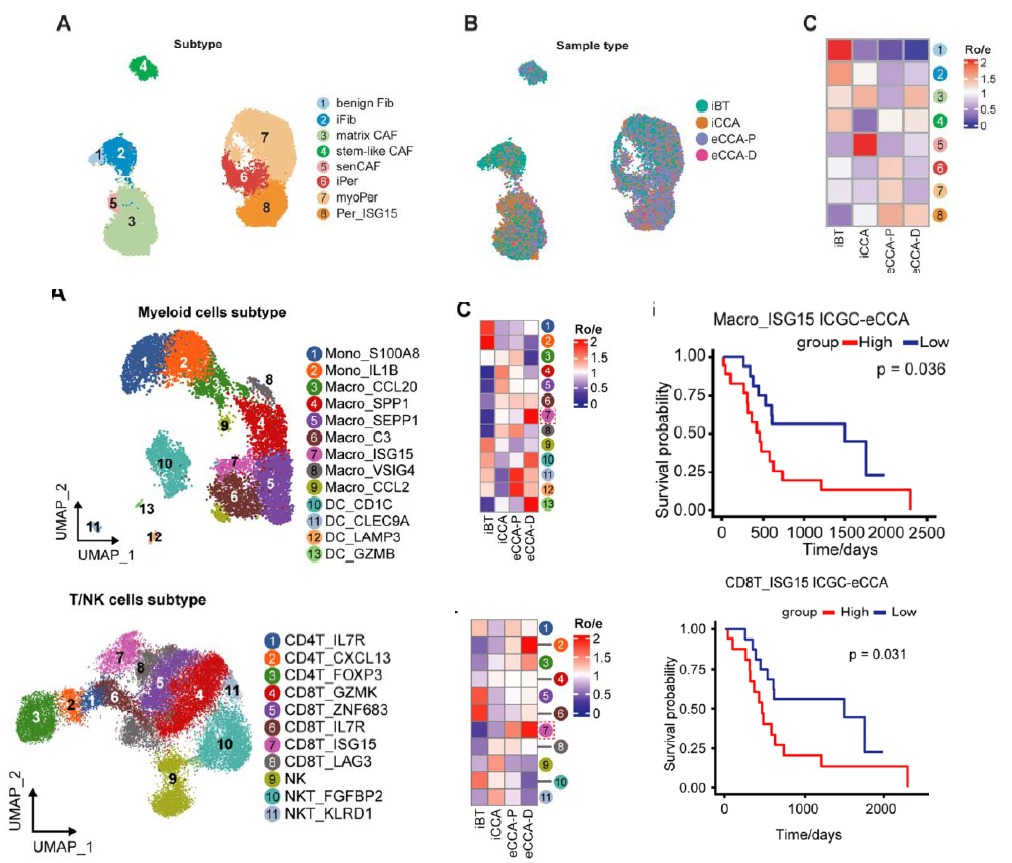
6. LY6D+祖細胞生態位的維持高度依賴于ISG15富集的間充質與免疫微環境
進一步對基質微環境和免疫微環境的異質性進行分析,發現了Per-ISG15,Macro-ISG15,CD8T-ISG15細胞群在eCCA中高度富集,他們均高表達ISG15,且與C7 mEPC(LY6D+ EPCs)亞群存在互作,其中 CD8T-ISG15和Macro-ISG15細胞群與eCCA的較差預后相關,進一步通過ISS空間轉錄組數據發現以上細胞與LY6D+ EPCs細胞存在明顯的共定位,基于類器官的ISG15功能實驗表明 ISG15 對于維持癌細胞干性和增強腫瘤對各種抗癌藥物的抵抗力至關重要,以上結果說明eCCA 內特有的LY6D+ EPCs祖細胞亞群的穩定依賴于 ISG15 高間充質和免疫生態位維持。

結論
本研究全面揭示了膽管癌單細胞圖譜及不同亞型的異質性,首次鑒定到了高表達ISG15的腫瘤微環境與eCCA特有的LY6D+基底樣祖細胞亞群形成生態位,闡明該生態位和臨床耐藥之間的關聯,為精準診療提供了新靶點。






